

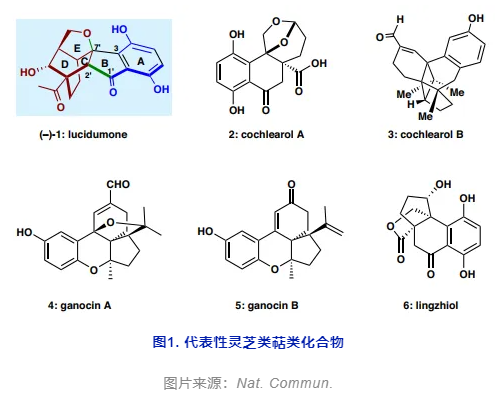
图1. 代表性灵芝类萜类化合物
正文
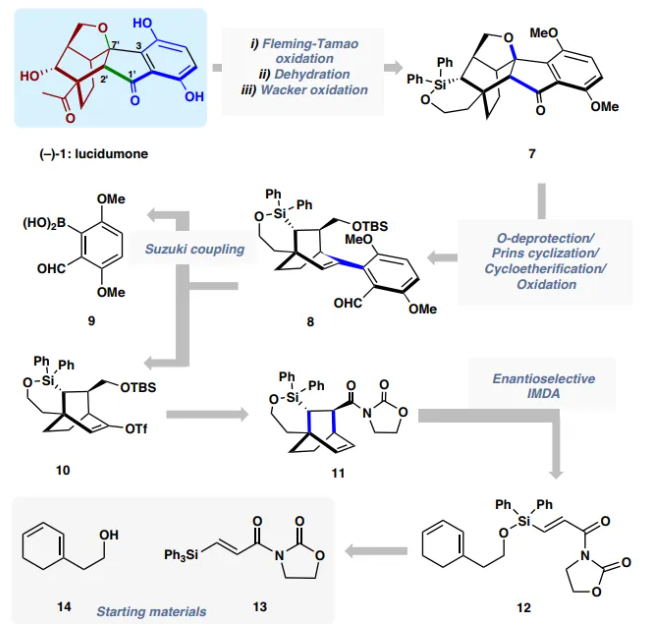
图2. (−)-lucidumone的逆合成分析
图片来源:Nat. Commun.
(−)-lucidumone (−)−1的逆合成分析如下:作者想通过Fleming-Tamao 氧化反应、Wacker氧化和O-去甲基化从六环中间体7中获得(−)-1。稠合的茚满酮框架可以通过关键的8的O-脱保护/Prins反应/环醚化序列来构建,而8又可以通过硼酸9和乙烯基三氟甲磺酸酯10之间的Suzuki偶联得到。10可以追溯到 11,而11是12的不对称分子内Diels-Alder反应的产物,12可以从已知的二烯14和容易获得的丙烯酸酰亚胺13获得。
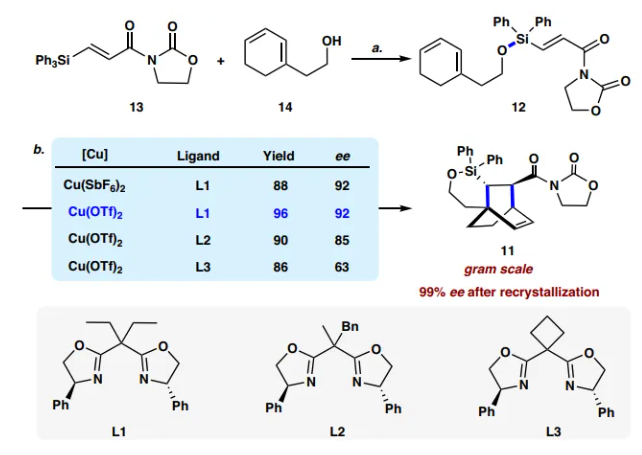
图片来源:Nat. Commun.
1的合成路线如下,首先从12的制备开始(图3)。按照 Sieburth开发的方案,将容易获得的丙烯酸酰亚胺13暴露于三氟甲磺酸,然后添加已知的伯醇14,以91%的产率得到硅烷基醚12。在Et2AlCl(0.1当量)存在下,12在0 °C下的 Diels-Alder 环加成反应顺利进行,以90%的收率得到所需的环加合物,为单一endo非对映异构体。接着,作者探索了这一反应的不对称版本,通过改变反应温度、配体和铜源来筛选反应条件,最终确定了50 °C 下,Cu(OTf)2 (10 mol%)和配体(S,S)-L1 (11 mol%)的优化反应条件,在该条件下,以96%的收率和92% ee分离出环加合物11。在Cu(OTf)2 (0.3 mmol)、(S,S)-L1 (0.33 mmol)存在下,在3.0 mmol下进行反应,11的收率和对映选择性没有明显下降(95%收率,92% ee)。重结晶后ee值可进一步提高至99%。11的绝对构型通过其衍生物的X-射线衍射分析来确证。
在完成克级规模手性双环[2.2.2]辛烷中间体11的合成后,作者开始合成高功能化的六环中间体22(图4)。11的水解得到羧酸15,产率94%。另一方面,用LiBH4还原11得到醇16,产率85%。用BH3·THF(-30 °C 至室温)处理 15,然后添加NaBO3·4H2O,通过同时还原羧酸得到混合二醇产物。无需纯化,该二醇通过一系列选择性O-保护和氧化转化为酮17及其区域异构体18,总产率为89% (rr = 3.4:1)。通过单晶确定了三环酮17的绝对构型。根据合成计划,17将提供左旋目标分子(−)-lucidumone (−)-1。值得注意的是,对醇16应用相同的条件,以1:1 的比例分离出两种区域异构酮的混合物。这些结果表明羧酸是硼氢化步骤中更好的导向基团。
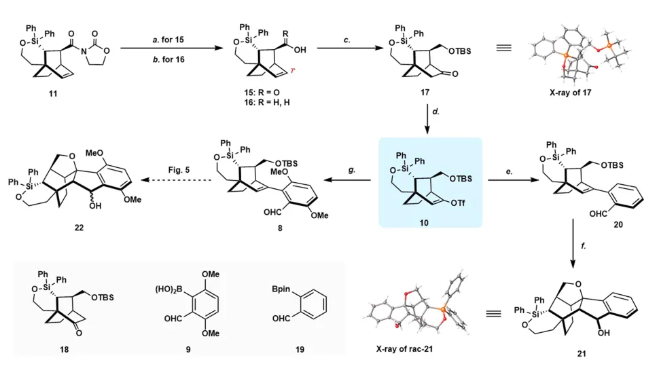
图片来源:Nat. Commun.
接下来,作者将构建天然产物的A-B-E环。在-78 ℃下用KHMDS对酮17进行去质子化,然后添加PhNTf2,得到所需的三氟甲磺酸乙烯酯10,分离收率为94%。Pd催化的10和已知的硼酸9之间的Suzuki-Miyaura交叉偶联反应顺利进行,以69%的产率得到官能团化的四环中间体8。接下来将寻求将8一步转化为22,这是合成中的一个战略步骤。在真实底物之前首先尝试了模型反应。前体20是通过10和市售的2-甲酰基苯基硼酸频哪醇酯19之间的Suzuki-Miyaura交叉偶联生成的,在各种酸性条件下筛选关键转化。最终,在 HCl(10 当量)存在下,在DCM中,在10 °C下,以89%的产率和20:1非对映选择性获得了所需的21。然而,四环的8不稳定,采用前述相同条件处理时会分解。所需产物作为一对非对映异构体22可以在一系列酸性条件下分离,同时形成Prins环化产物23。为了最大限度地减少副产物的产生,使用不同的酸[TFA、HCl、p-TsOH·H2O , (−)-CSA]和Lewis酸[BF3·Et2O、AlCl3、Sc(OTf)3、TBSOTf、TMSOTf等]在不同温度下不同溶剂中进行筛选(图5),HCl 仍然是最合适的启动子。最佳反应条件包括在过量HCl(2M乙酸乙酯溶液,10 当量)存在下,在 -78 °C下搅拌8的DCM溶液24小时,以一对非对映异构体的形式生成22,产率为86%,也可以直接被Dess-Martin periodinane氧化,以一锅法序列得到所需的产物7,总产率为80%(图6)。通过X-射线晶体学分析证实了7的结构和绝对构型。其中,必须仔细控制反应温度和时间,以避免副产物的形成。
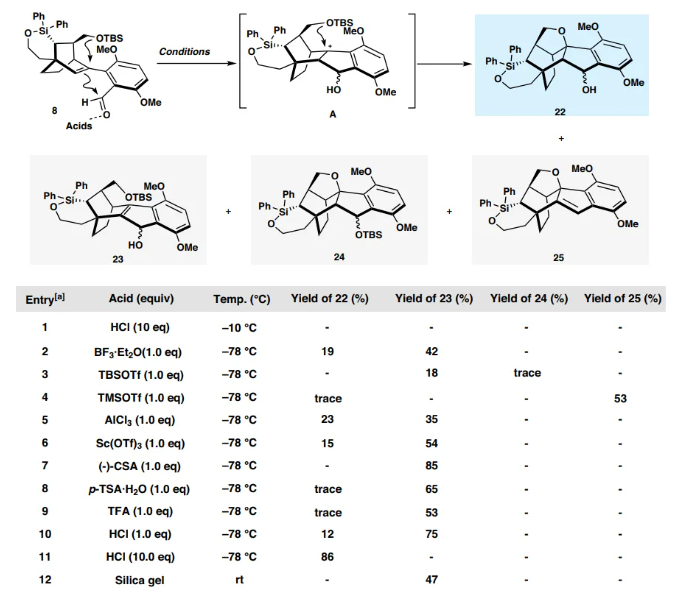
图片来源:Nat. Commun.
如图 6 所示,最后就是将六环7合成为(−)-1。7的 Fleming-Tamao氧化(KF、H2O2、甲醇/THF,v/v = 1:1)得到二醇 26,产率91%。值得注意的是,在连续的Dess-Martin氧化和Fleming-Tamao氧化下,通过自发脱保护/oxa-Michael加成,副产物23也可以转化为二醇26。根据Grieco的方案,26的脱水过程顺利进行,得到所需产物 27,分离产率为50%。正如Kawamoto和Ito提到的,乙烯基27到甲基酮28的后期Wacker氧化是具有挑战性的。在经典条件下,可能由于空间位阻效应,由反马氏加成产生的醛为主要产物。然后,作者借鉴了铁催化Wacker型烯烃氧化为酮的方法。值得庆幸的是,将其标准条件应用于27 [Fe(dbm)3, PhSiH3, EtOH, RT],能以65%的产率获得甲基酮28。最后,Lewis酸催化28的双O-去甲基化,以70%的分离产率得到 (−)-lucidumone (−)-1。合成的(−)-lucidumone (−)-1的表征数据与天然产物报道的数据一致。
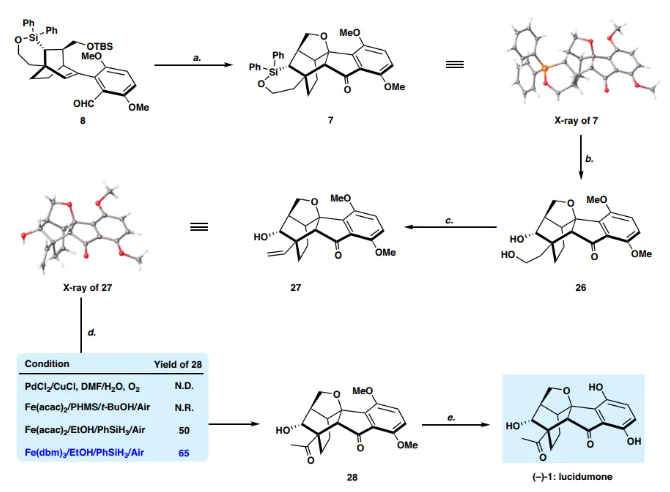
总结
李广课题组完成了(−)-lucidumone (−)-1的对映选择性全合成。该合成路线包括以下几个关键的转化:双(噁唑啉)铜(II)配合物催化的对映选择性分子内Diels-Alder反应,以构建多功能双环[2.2.2]辛烷部分,一种Brønsted酸促进串联O-脱保护/Prins反应/环醚化,然后氧化以同时安装四氢呋喃和稠合茚满酮部分,Fleming-Tamao氧化提供仲羟基,以及铁催化的受阻乙烯基的后期Wacker型氧化为甲基酮。该合成策略简洁高效,将为灵芝类相关天然产物的合成及其生物活性研究提供重要基础。
导师详情
李广,研究员,博士生导师,国家海外高层次青年人才引进计划入选者。2008年毕业于西南大学获得理学学士学位,2013年毕业于中国科学院化学研究所,获得理学博士学位,师从史一安教授。2013年9月至2016年10月于清华大学药学院从事博士后研究,师从祖连锁教授。2017年1月至2021年6月于瑞士洛桑联邦理工学院 (EPFL) 进行博士后研究,师从祝介平教授 (Prof. Jieping Zhu) 。2021年7月加入中国医学科学院药物研究所,目前主要从事活性天然产物全合成及后续的药物化学和化学生物学研究。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn