


针对该临床问题,北京航空航天大学常凌乾团队报道了一种新型纳米医疗芯片,可以快速检测肺癌循环肿瘤细胞(CTCs)内PD-L1基因表达、以及肿瘤细胞响应免疫细胞的行为表型;进一步对患者来源的CTCs进行亚群划分,依此预测肺癌患者对免疫疗法的治疗效果。与传统组织活检技术相比,临床准确率(AUC值)由57%显著提高到90%以上。成果以“Genetic and phenotypic profiling of single living circulating tumor cells from patients with microfluidics”为题,发表在《PNAS》上。
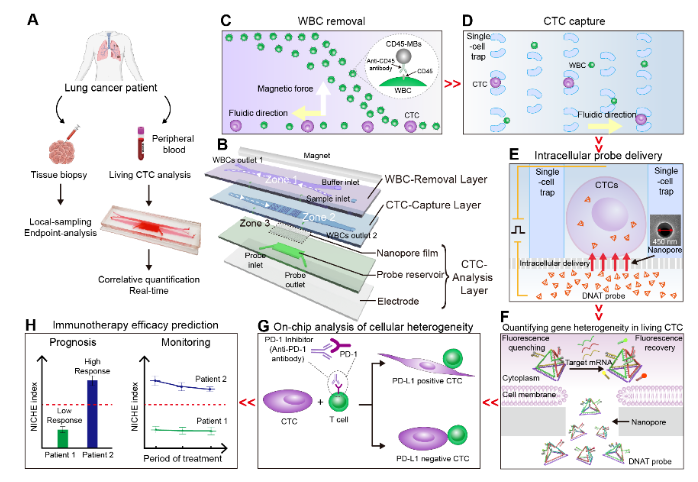
图1. 循环肿瘤细胞(CTCs)捕获、原位培养和基因分析芯片系统NICHE,用于肺癌免疫治疗的精准预测与监测。
该纳米芯片采用磁场和细胞尺寸,高效去除(> 93%)血样中的白细胞,并捕获CTCs使其形成单细胞阵列(>95%)。为了实现活CTCs内PD-L1基因的准确检测,研究者们设计了一种具有四面体结构的探针,实现对活细胞内PD-L1基因、内参GAPDH基因、以及CTCs鉴定基因的同时检测。芯片采用实验室标签递送技术——纳米电穿孔,在2秒内将探针递送至95%细胞内,且保持良好的细胞安全性(90%),递送性能显著优于与其他常规方法(图2)。
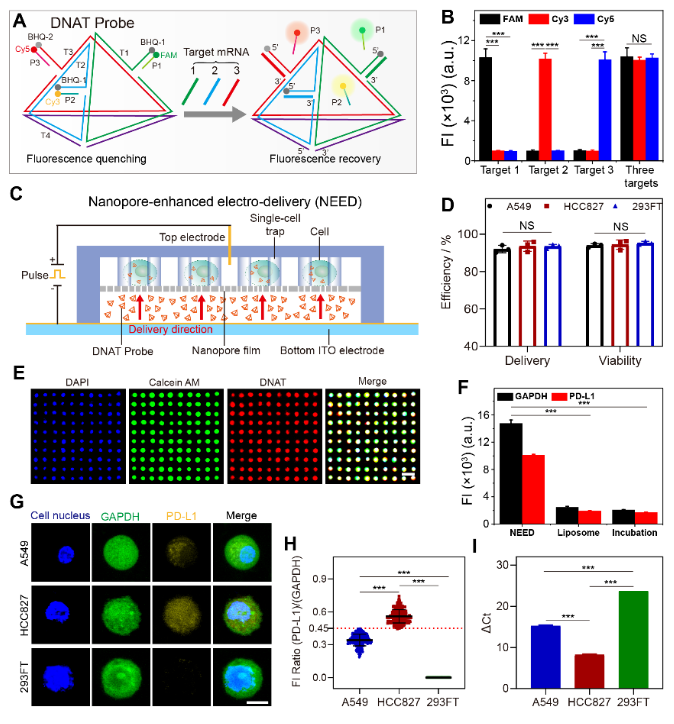
图2. 在单个活细胞水平CTCs内PD-L1 mRNA的精准量化。
完成基因检测的CTCs,保持了良好的活性。通过与免疫T细胞的共培养,研究者们发现,部分肿瘤细胞在免疫抑制剂存在时,细胞形态发生了明显的变长,且细胞增殖行为被显著抑制(图3)。根据肿瘤细胞PD-L1的表达情况,研究者们划分出了PD-L1高表达与低表达的阈值;另外,根据肿瘤细胞与免疫细胞共培养的结果,研究者们划分出了肿瘤细胞形态发生变化的阈值。综合CTCs中PD-L1高表达(PD-L1high)且表型发生变化(PA+)的占比,该研究定义了一种新的指标,“NICHE指数”,用于预测癌症患者响应免疫疗法的疗效。
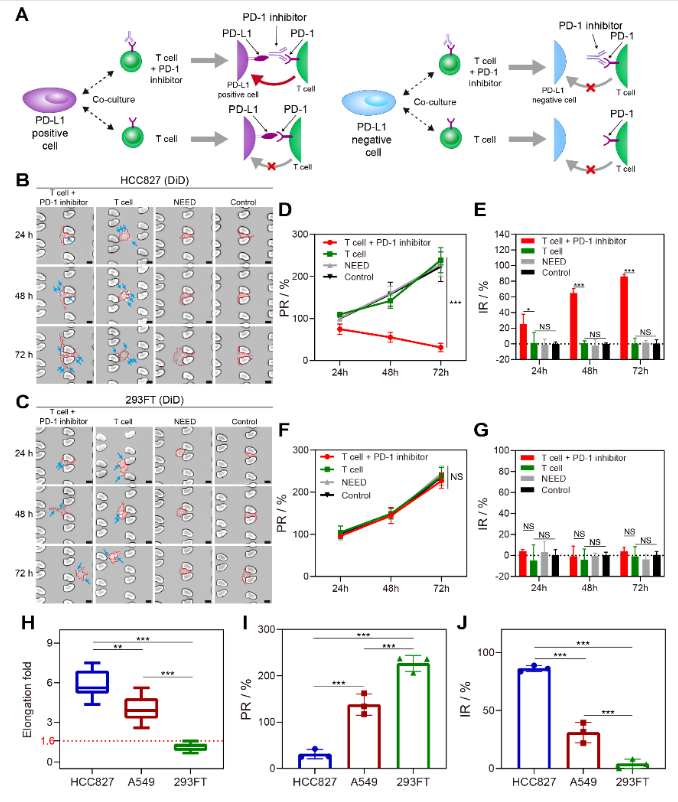
图3. CTCs与免疫细胞共培养下发生形态改变。
为了评估NICHE在临床上预测免疫疗效的性能,收集了80 名非小细胞肺癌患者的外周血,通过在NICHE平台上的检测,证明了该平台捕获 CTCs 并鉴定其基因和行为表型的能力(图4)。NICHE指数在预测临床预后方面,表现出高准确性(AUC=0.906),明显高于目前临床上基于肿瘤组织中PD-L1表达细胞占比的标准参考方法(AUC=0.578)。目前,该团队正在联合北大肿瘤医院吴楠主任,制定一项行业标准,用于肺癌免疫治疗获益人群筛选,以达到肺癌个性化医疗,有望降低临床癌症医疗负担。
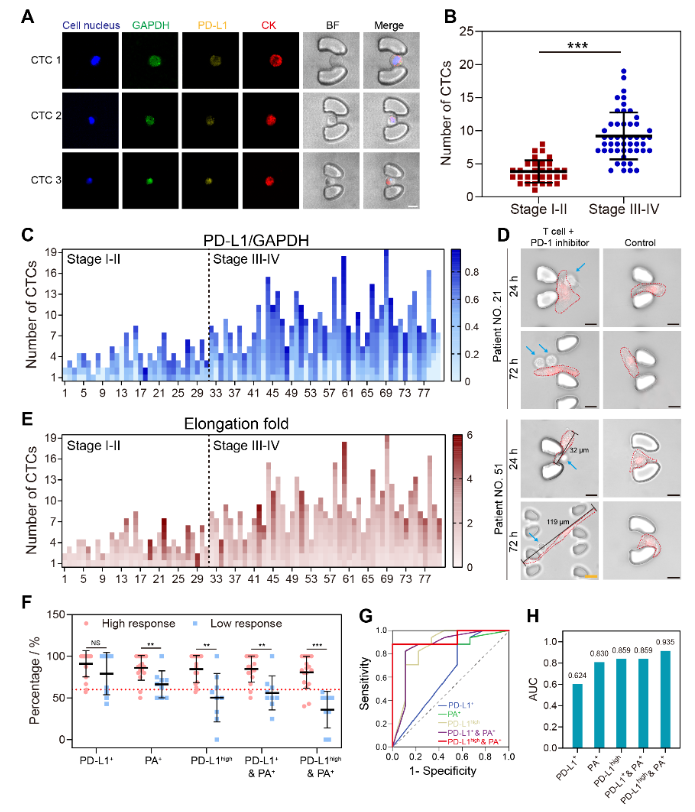
图4. 采用NICHE系统对肺癌血样中的CTCs进行捕获与分析,并实现了患者免疫治疗的精准预测。
该论文的其他通讯作者包括北京大学肿瘤医院吴楠教授、格拉斯哥大学Jonathan M. Cooper 教授、北京机械设备研究所杨明珠研究员。第一作者为北航医学科学与工程学院董再再(助理教授)、北航生物与医学工程学院汪于森硕士、北京大学肿瘤医院刘冰博士、上海市感染和免疫疾病科技创新中心徐高连教授。
文章链接:https://www.pnas.org/doi/10.1073/pnas.2315168121
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn