

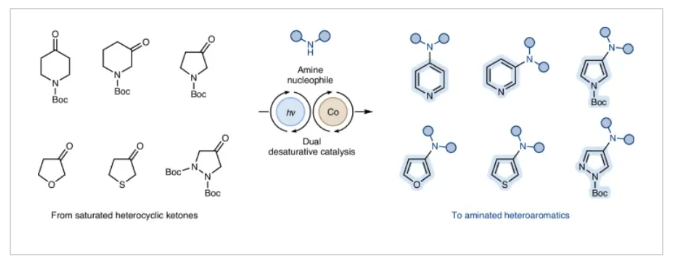
(图片来源:Nat. Catal.)
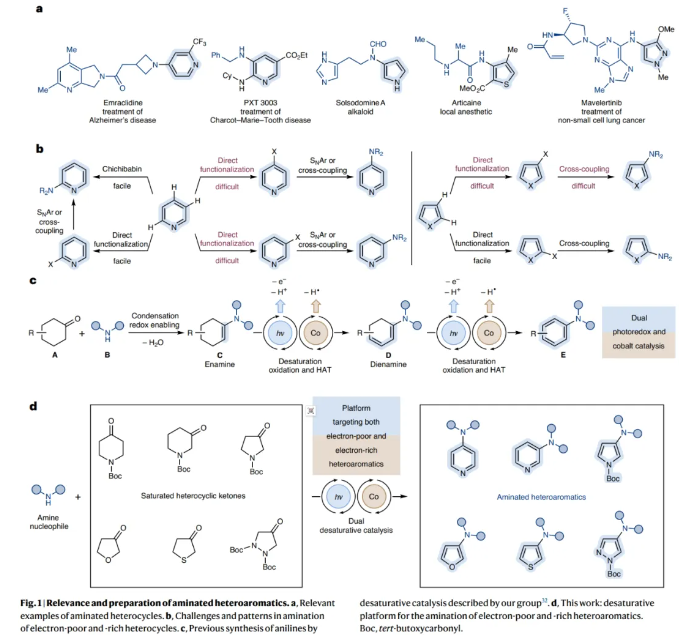
正文
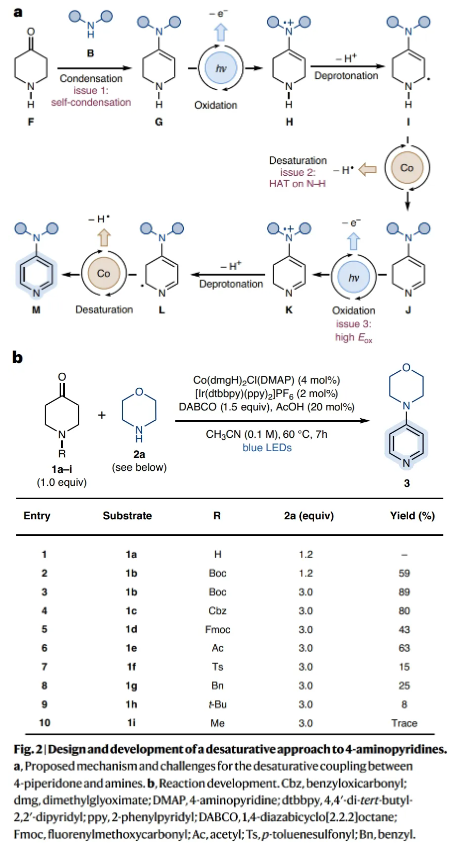
作者认为反应机理可能是通过如下过程进行的(Fig. 2a):首先F与胺亲核试剂通过缩合形成富电子烯胺G来构建C-N键。此时光氧化还原氧化会生成烯胺自由基H,其在去质子化之后,可以转化为富电子的7-π-电子体系I。基于作者之前的研究工作(Nature, 2020, 584, 75; ACS Catal., 12, 10326),[Co(II)]介导的HAT会使体系去饱和得到α,β-不饱和亚胺J。然后通过新一轮的光氧化还原氧化(K)和去质子化(L)以及随后的[Co(II)]介导的去饱和反应,得到所需的4-胺基化的吡啶产物M。然而,上述概念掩盖了一个高度复杂的级联反应,A中的C4亚甲基单元被NH取代会带来许多潜在的缺陷。最重要的是,F需要优先与胺反应而不是自缩合;α-烯胺自由基(I)生成后,[Co]催化剂需要在N-H键上进行去饱和,这在该领域很少有先例;推-拉亚胺-烯胺中间体J预计比标准的二烯胺(D)更难氧化,从而阻碍了第二次光氧化还原活化。接下来,作者对反应条件进行了筛选(Fig. 2b),当使用1b (1.0 equiv), 2a (3.0 equiv), Co(dmgH)2Cl(DMAP) (4 mol%), [Ir(dtbbpy)(ppy)2]PF6 (2 mol%), DABCO (1.5 equiv), AcOH (20 mol%),在CH3CN (0.1 M)中,蓝光照射下60 oC反应7小时,可以以89%的产率得到4-氨基化的吡啶产物3(entry 3)。
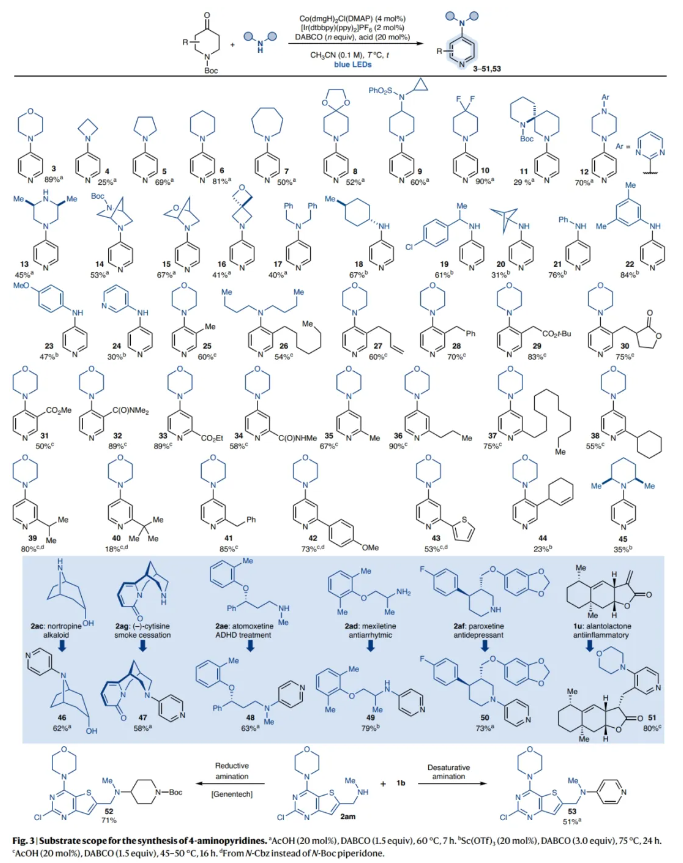
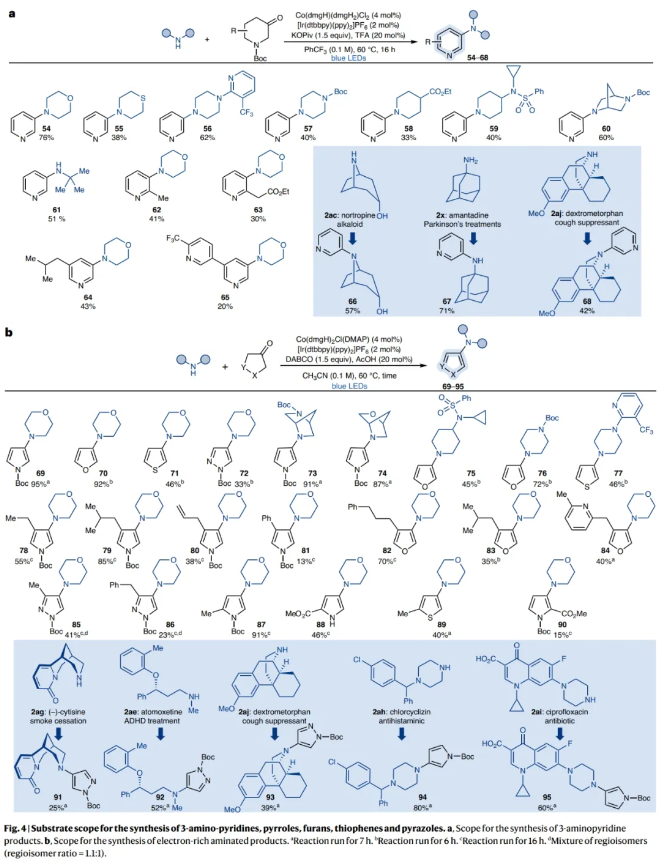
在得到了最优反应条件后,作者对此转化的底物范围进行了探索(Fig. 3)。实验结果表明,一系列不同的NH化合物,如氮杂环丁烷、吡咯烷、哌啶、氮杂环庚烷、吗啡啉、哌嗪、芳基胺等以及不同取代的哌啶酮均具有良好的兼容性,以18-89%的产率得到相应的产物3-45。值得注意的是,利用此转化还可以实现复杂生物活性分子如nortropine、(–)-cytisine、atomoxetine、mexiletine、paroxetine的后期官能团化,以58-80%的产率得到相应的去饱和产物46-51。此外,1b可以与复杂的胺2am通过Genetech还原胺化以71%的产率得到潜在的磷酸肌肽3-激酶抑制剂前体52。而利用作者所发展的去饱和策略可以以相同的起始原料以51%的产率得到去饱和产物53。
目前,在吡啶在C3位实现胺化仍然是一个合成挑战,且目前并没有通用的解决方案。作者基于此策略对反应条件进行了进一步的优化(PhCF3作溶剂,三氟乙酸作为酸添加剂,Co(dmgH)(dmgH2)Cl2为钴肟),可以实现N-Boc哌啶酮1j与一级胺或二级胺的偶联(Fig. 4a)。一系列不同的NH化合物和哌啶酮均具有良好的兼容性,以20-76%的产率得到相应的去饱和产物54-68。此外,此策略还可以扩展到实现3-吗啡啉基呋喃、噻吩、N-Boc-吡唑、哌嗪、哌啶等杂环构建的转化,以15-95%的产率得到相应的产物69-90。值得注意的是,作者还使用(–)-cytisine 2ag、atomoxetine 2ae、dextromethorphan 2aj以及dextromethorphan 2ah和dextromethorphan 2ai探索了生物活性分子的后期吡唑啉化和吡咯烷化,以25-80%的产率得到相应的产物91-95,进一步证实了该策略的高官能团耐受性。
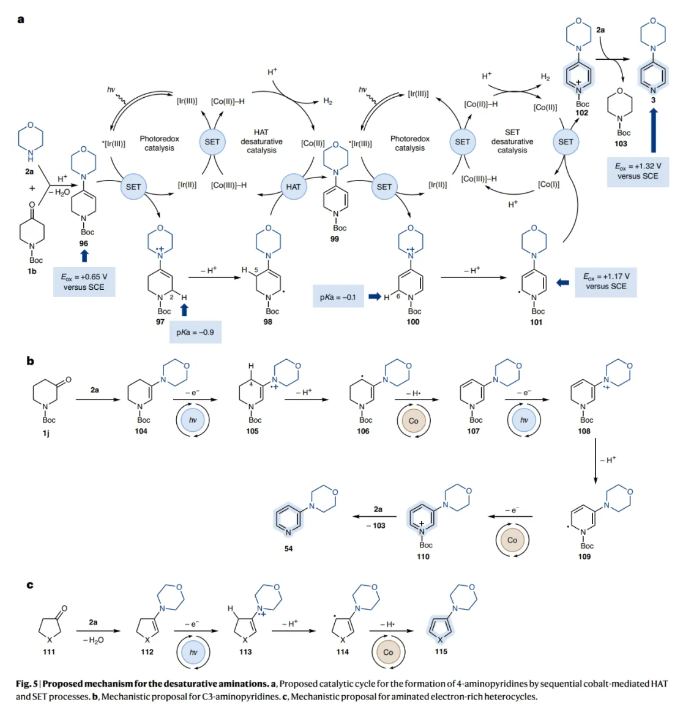
经历去饱和偶联得到C4-氨基官能团化吡啶的机理如Fig. 5a所示:1b和2a之间的缩合是通过弱Brønsted酸促进的,从而形成富电子烯胺96。该物种可被光激发的*[Ir(III)]催化剂氧化为相应的烯胺自由基阳离子中间体97,并在C2处活化去质子化。然而,由于N-Boc官能团的存在,富电子的7π-电子体系98不能在C2-N上发生钴介导的去饱和过程。相反,由于该物种在C4处具有相当大的自旋密度,作者认为在C5处会通过HAT去饱和从而得到二烯胺99。至此,已经完成第一次去饱和过程,第二次光氧化还原氧化将产生烯胺自由基阳离子100,随后经历C6去质子化得到自由基101。最后,经历[Co(II)]介导的二烯胺自由基101的氧化可生成N-Boc-吡啶盐102,并将Boc转移到2a得到3和103。
这一反应过程同样可以解释C3-哌啶酮1j的胺化过程(Fig. 5b)。首先,烯胺的形成和随后的氧化会得到自由基阳离子105。基于计算数据,该物种应优先在C4位去质子化而不是C6位,从而得到自由基中间体106。随后通过HAT进行钴介导的去饱和反应生成交叉共轭二烯胺107。接下来,107将经历光氧化还原氧化(108)、去质子化(109)和钴介导氧化得到产物。最后,Fig. 5c展示了通过去饱和偶联实现3-胺化富电子杂环的机理过程。在此情况下,首先通过烯胺形成(112),随后是氧化(113)、C3去质子化(114)和钴介导的HAT去饱和(115)过程。
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn