

正文
上海药物所黄蔚课题组长期从事多肽蛋白质药物相关的研究,致力于发展新颖、实用的修饰新方法,助力多肽蛋白质药物的开发(Angew. Chem. Int. Ed. 2024, 63, e202401394; Nat. Commun. 2023, 14, 7169; Angew. Chem. Int. Ed. 2022, 61, e202204132; Angew. Chem. Int. Ed. 2020, 59, 19940)。在前期工作基础上,黄蔚课题组联合黄河课题组基于钯催化的肉桂基化反应在蛋白N端独特的反应特性,首次发展了一种通用的蛋白N端可逆修饰策略,拓展了蛋白可逆修饰的化学空间,为相应的化学生物学研究和药物设计提供了思路(图1)。
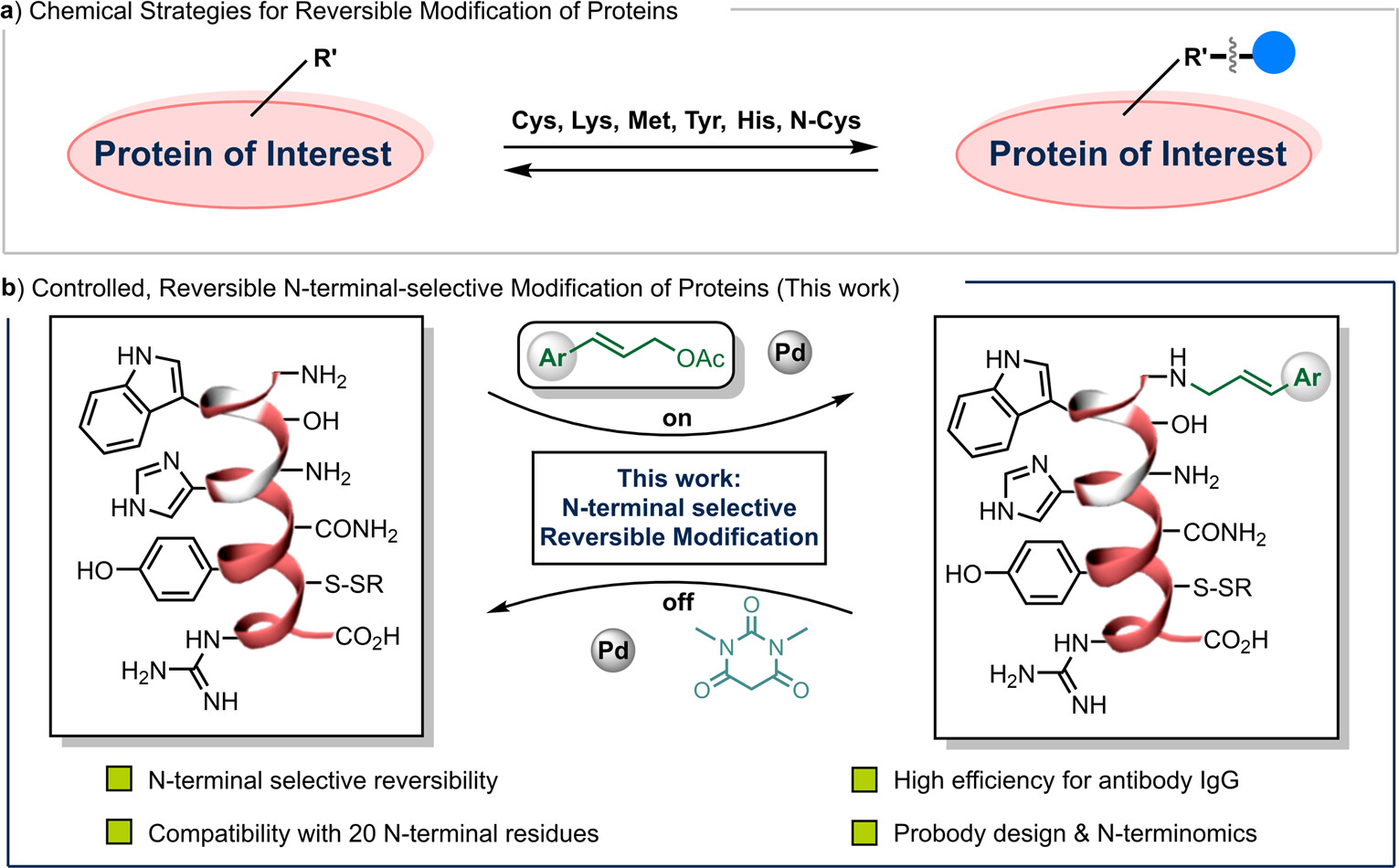
图1. 蛋白质可逆修饰的化学策略
该研究中,研究人员发现在生理pH条件下钯催化肉桂基化反应对于多肽N端α-NH2具有独特的反应性,验证了N端20种天然氨基酸侧链(除半胱氨酸外)在该体系中的兼容性,实现了对多种药用肽、蛋白、纳米抗体的结构修饰。同时,研究人员发现该方法对于曲妥珠单抗的N端修饰表现优秀,优于目前广泛使用的基于吡啶甲醛的N端修饰方法,揭示出该方法在复杂蛋白底物改造中的潜力。基于修饰后的曲妥珠单抗,研究人员方便地制备了位点特异性的抗体药物偶联物和抗体荧光素偶联物,并进行了相应的生物学表征(图2)。
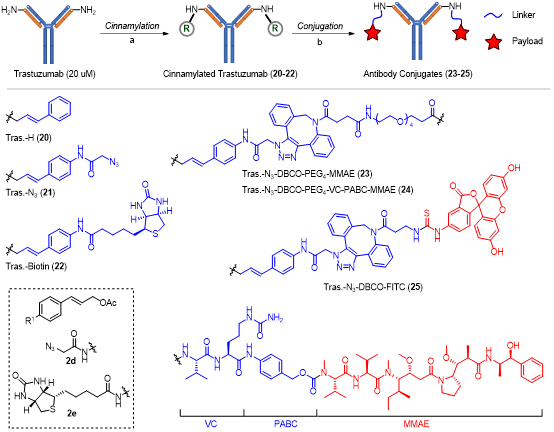
图2. 抗体N端选择性修饰及抗体偶联物的制备
进一步,研究人员发现,修饰后的肉桂基团在钯催化剂和1,3-二甲基巴比妥酸的条件下可以被高效地脱除,释放出原型多肽或蛋白分子,这一脱除过程同样兼容N端20种天然氨基酸。基于这一可逆的修饰过程,研究人员实现了对于抗体亲和力的调控和细胞裂解液中蛋白的无痕富集,为相应的抗体前药的设计和蛋白组学研究提供了参考(图3)。
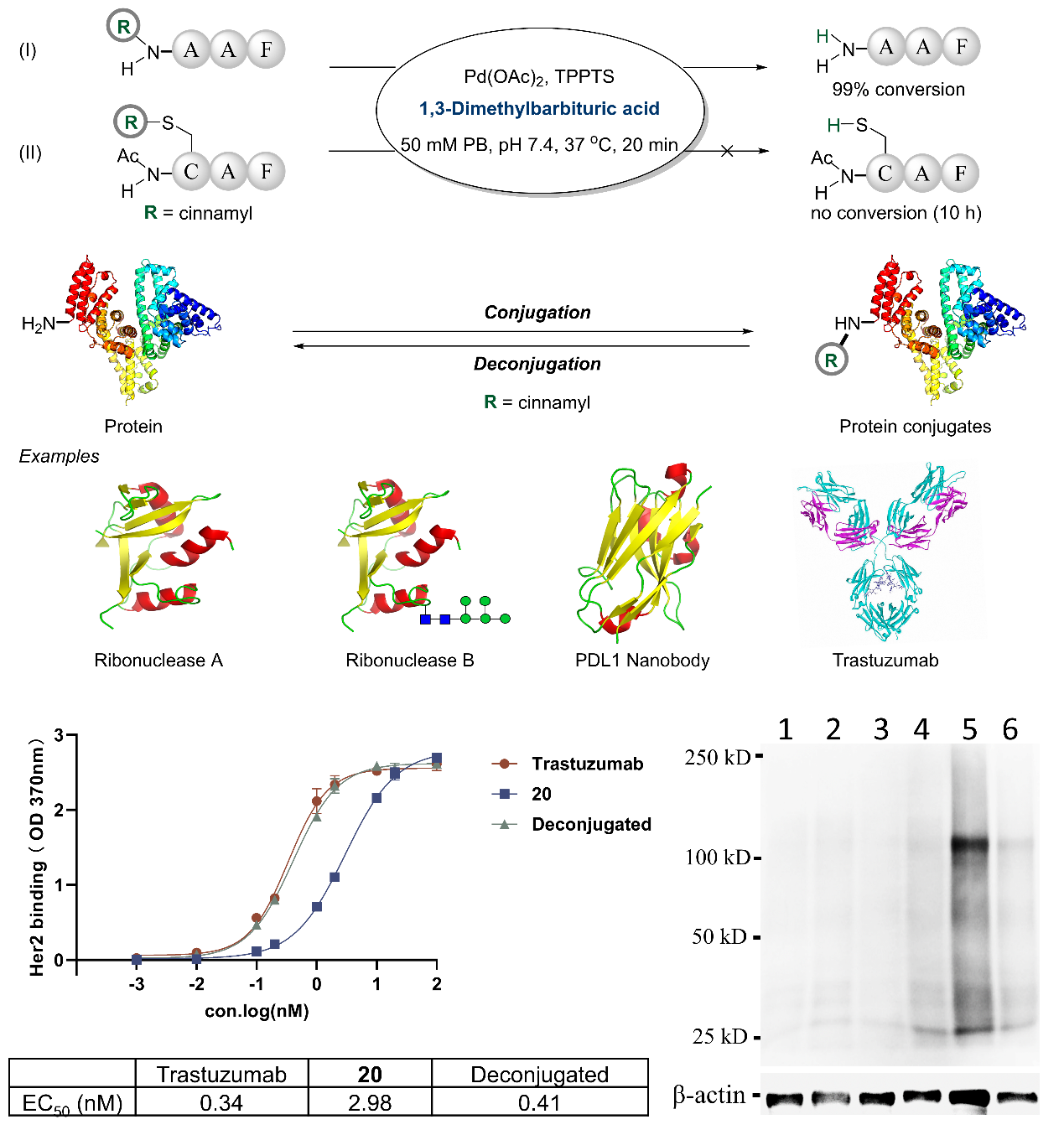
图3. 蛋白N端可逆修饰及其应用
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn