

(图片来源:J. Am. Chem. Soc.)
正文
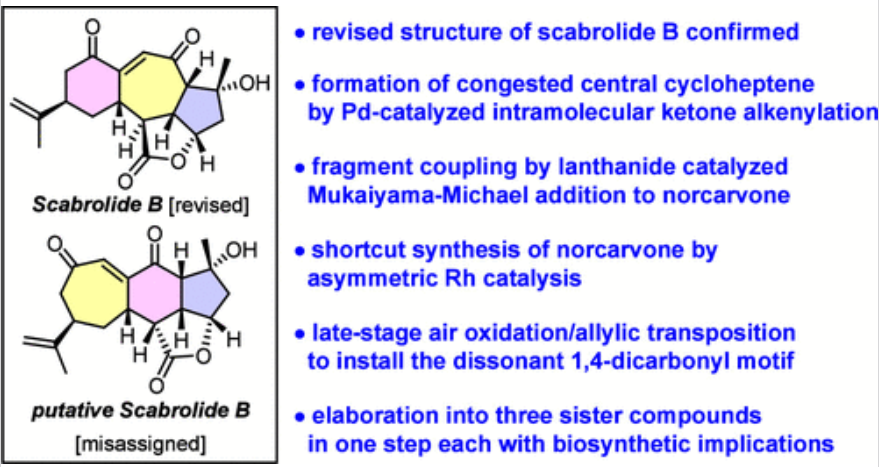
Scabrolide A(1)是一种有趣的降西松烷类化合物,来源于Sinularia属的软珊瑚。利用了早期的生物合成考虑,1是通过双键异构化从Scabrolide B(2)中衍生出来的(Figure 1)。虽然这种转化可以几乎定量的收率实现,但作者注意到了一个令人困惑的不一致:合成1与Scarrolide A完全对应,但其前体2与推测的Scarrolid B根本不匹配。基于DFT计算研究发现,作者对Scarrolid B(2)的结构进行了修订,重新定义为Scarrolid B(3)。天然产物Scabrolide B(3)与Scabrolide A(1)的显著不同之处在于,它具有6−7−5而不是7−6−5的碳三环骨架。因此,它与Sinuscalide C(4)及其脱水子类密切相关,也与Fragilolide A(5)密切相关,其中C3酮被还原。除了这种结构差异之外,1和3的C12立体中心具有相反的构型,从而能够将Scabrolide B(3)与Inelenolide(6)区分开来。化学加_合成化学产业资源聚合服务平台,欢迎下载化学加APP关注。

(图片来源:J. Am. Chem. Soc.)
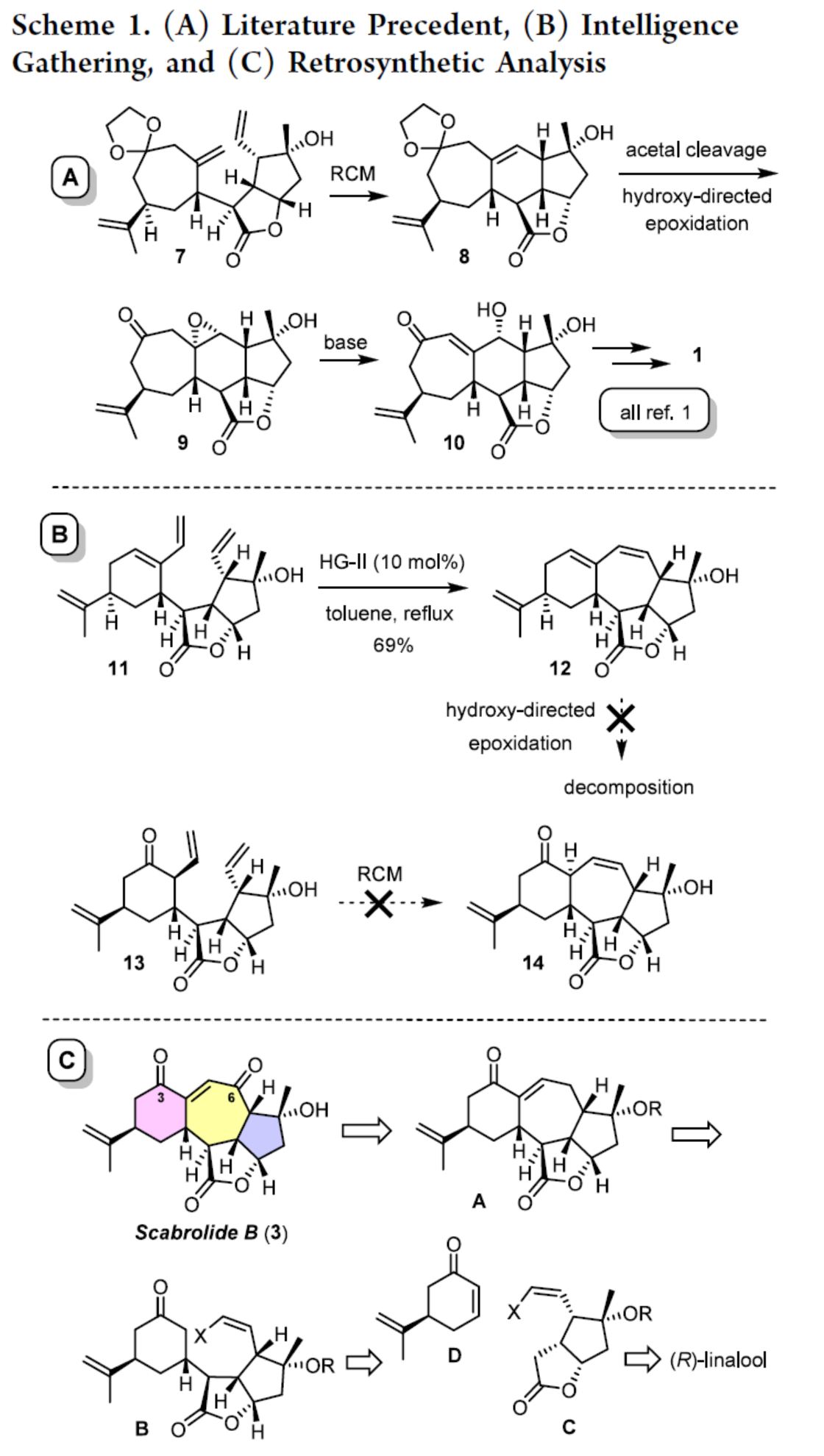
最初,作者对Scabrolide A(1)的合成路线进行一些调整,其也可能合成Scabrolide B(3)。具体来说,1的中心六元环是通过闭环复分解(RCM)构建。将所得烯烃化合物8进行羟基导向环氧化,然后进行碱诱导开环,以实现不协调的1,4-二氧化模式(Scheme 1A)。通过上述几个步骤,可将化合物10转化为目标产物。然而,这种策略不能延伸到Scabrolide B的合成(Scheme 1B)。虽然二烯化合物11能够顺利进行了闭环,但在12参与的羟基导向环氧化反应均失败。同时,化合物13通过RCM制备化合物14的尝试也未能成功。因此,作者进行了相关的逆合成分析(Scheme 1C)。首先,Scabrolide B(3)可由砌块A通过分子内烯醇化烯基化/氧化制备。其次,砌块A可由环化前体B制备。此外,环化前体B可由内酯化合物C与烯酮D通过Michael加成制备。
(图片来源:J. Am. Chem. Soc.)
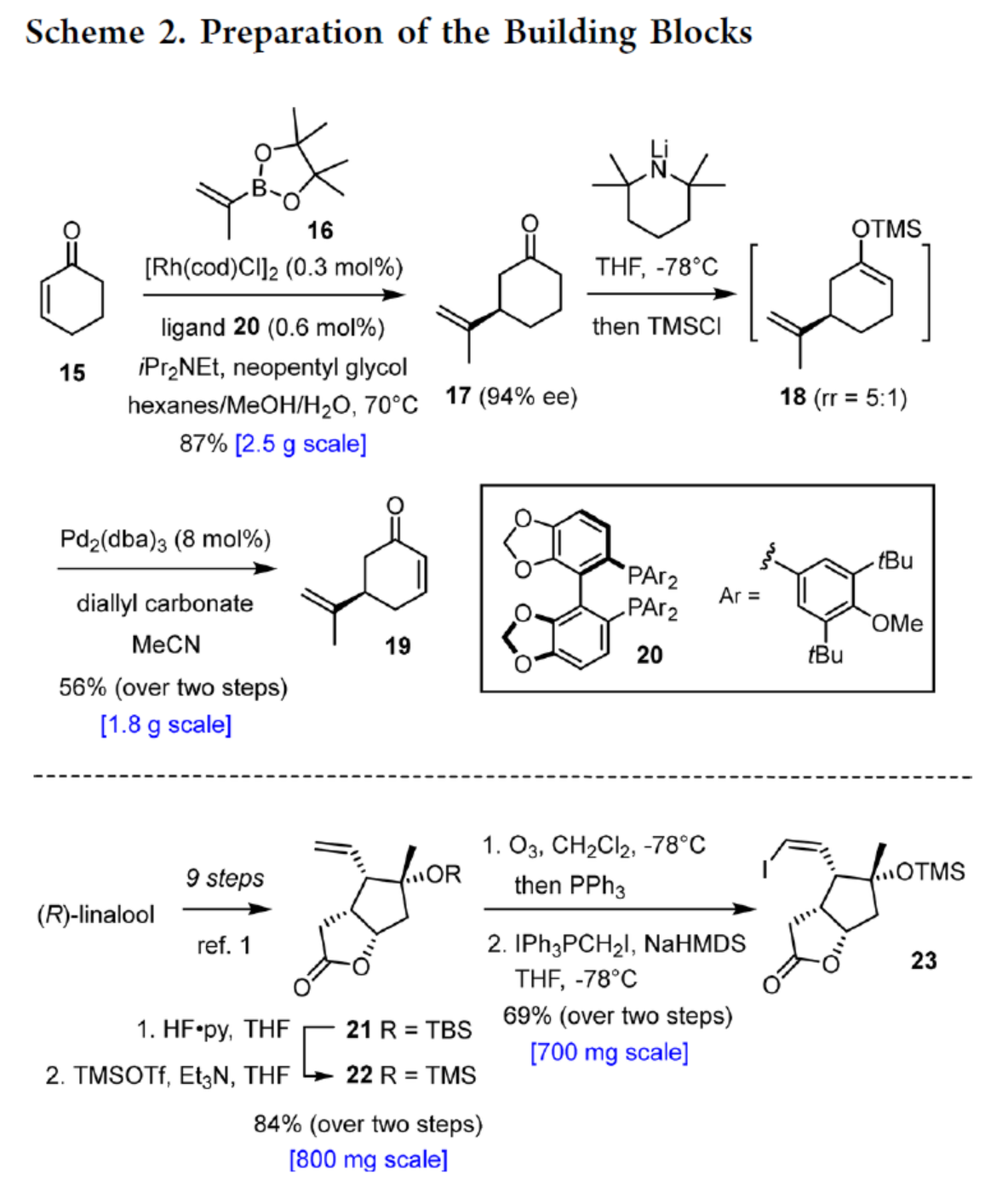
砌块19的合成(Scheme 2)。以环己烯酮(15)与硼酸酯(16)为底物,通过不对称铑催化1,4-加成反应,可以87%的收率得到中间体17,ee为94%。其次,使用位阻大的LiTMP进行脱质子化后,再使用TMSCl进行淬灭,生成硅基烯醇醚18作为主要异构体(rr ≥ 5:1,无需分离)。随后,以Pd2(dba)3为催化剂,碳酸二烯丙酯为终端氧化剂,无需任何额外配体,可直接进行Saegusa-型氧化反应,可以两步56%的总收率得到(R)-Norcarvone砌块19。
砌块23的合成(Scheme 2)。以(R)-芳樟醇为底物,按照文献的工艺(J. Am. Chem. Soc. 2022, 144, 1528; Chem. Rev. 2017, 117, 11753.),可制备中间体21。中间体21在HF·Py/THF与TMSOTf/Et3N/THF条件下进行保护基团替换,可以两步84%的总收率合成中间体22。中间体22通过进一步的臭氧化与Stork-Zhao烯基化反应,可以两步69%的总收率得到Z-烯基碘化物中间体23。
(图片来源:J. Am. Chem. Soc.)
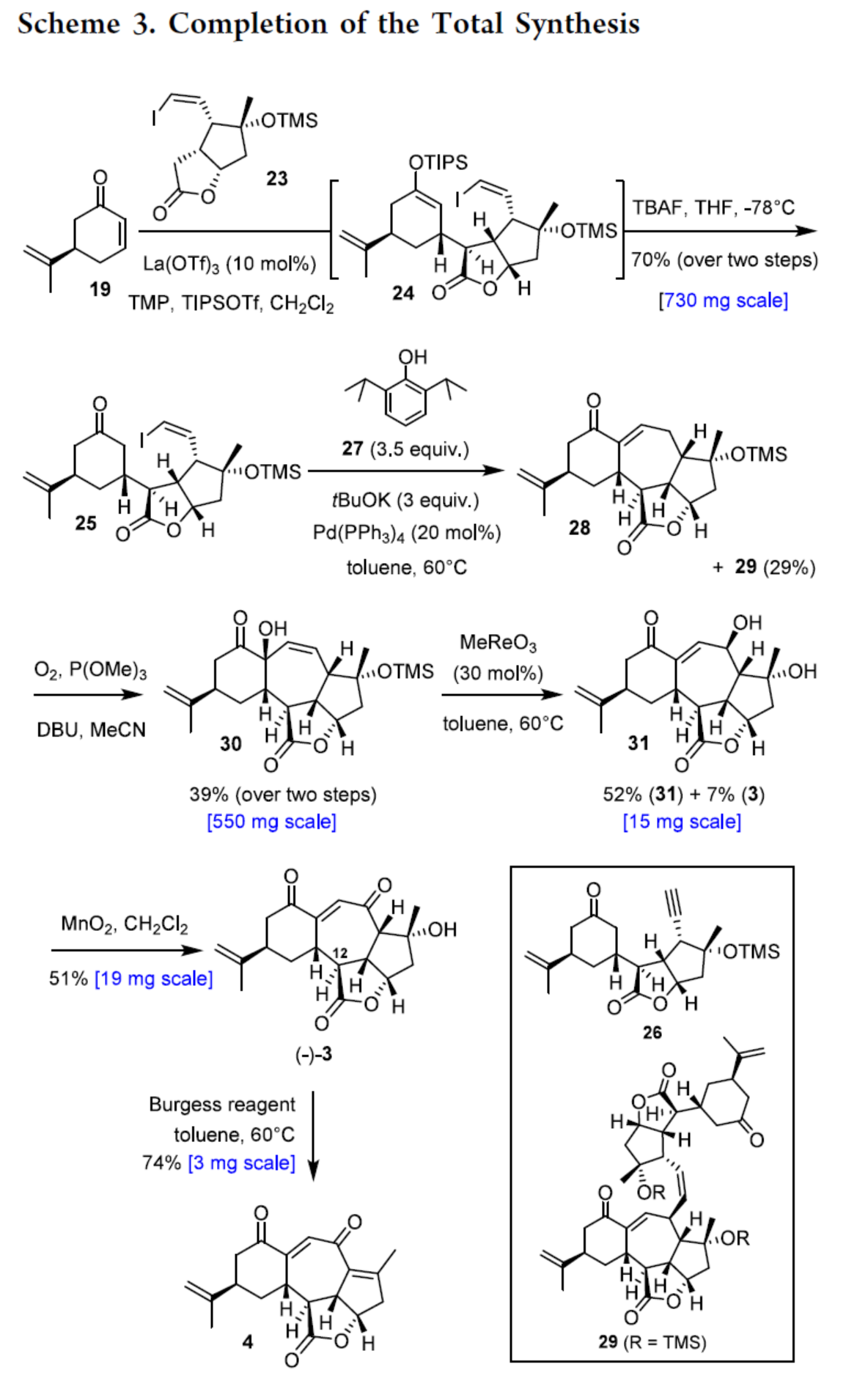
Scarrolid B(3)和Sinuscalide C(4)的全合成(Scheme 3)。以砌块19和砌块23为底物,在La(OTf)3/TMP/TIPSOTf条件下进行Mukaiyama-Michael加成反应,并在TBAF/THF条件下进行硅基烯醇醚的选择性断裂,可以两步70%的总收率合成中间体25。同时,通过X-射线单晶衍射分析,作者对位阻较大的C12-C13键上新形成的立体中心进行了确证(Figure 2)。通过对反应条件的大量尝试后发现,中间体25在2,6-二异丙基苯酚(27)/tBuOK/ Pd(PPh3)4条件下进行环化反应,可生成三环烯酮中间体28(收率约60%)和二聚体副产物29(收率为29%),无需进行进一步的分离。通过对反应条件的大量优化后发现,上述的混合物28和29在O2/P(OMe)3/ DBU条件下进行烯丙基重排/氧化反应,可以两步39%的总收率合成单一的非对映异构体30。中间体30在MeReO3条件下进行1,3-烯丙基重排反应,可以52%的收率得到中间体31。中间体31在MnO2/CH2Cl2条件下进行氧化反应,可以51%的收率得到(−)-3。同时,通过X-射线衍射分析,进一步证明了(−)-3结构的正确性(Figure 3)。(−)-3在Burgess试剂存在下进行脱水反应,可以74%的收率得到Sinuscalide C(4),表征数据和文献报道的一致。
(图片来源:J. Am. Chem. Soc.)
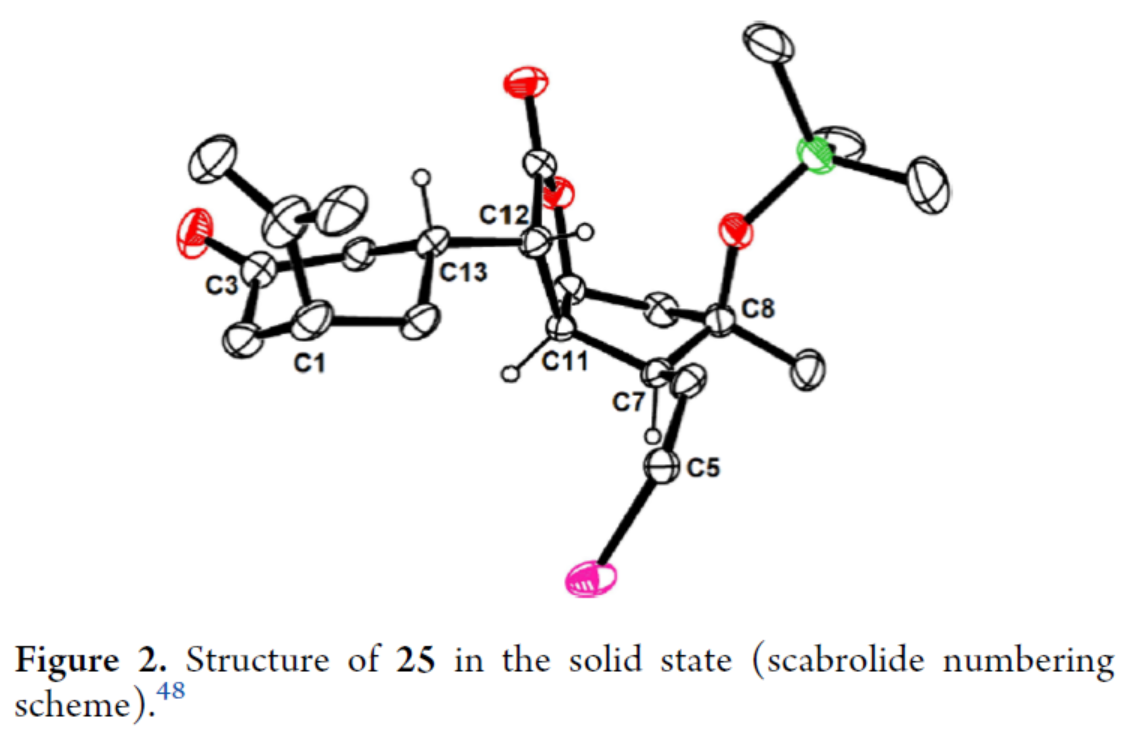
(图片来源:J. Am. Chem. Soc.)
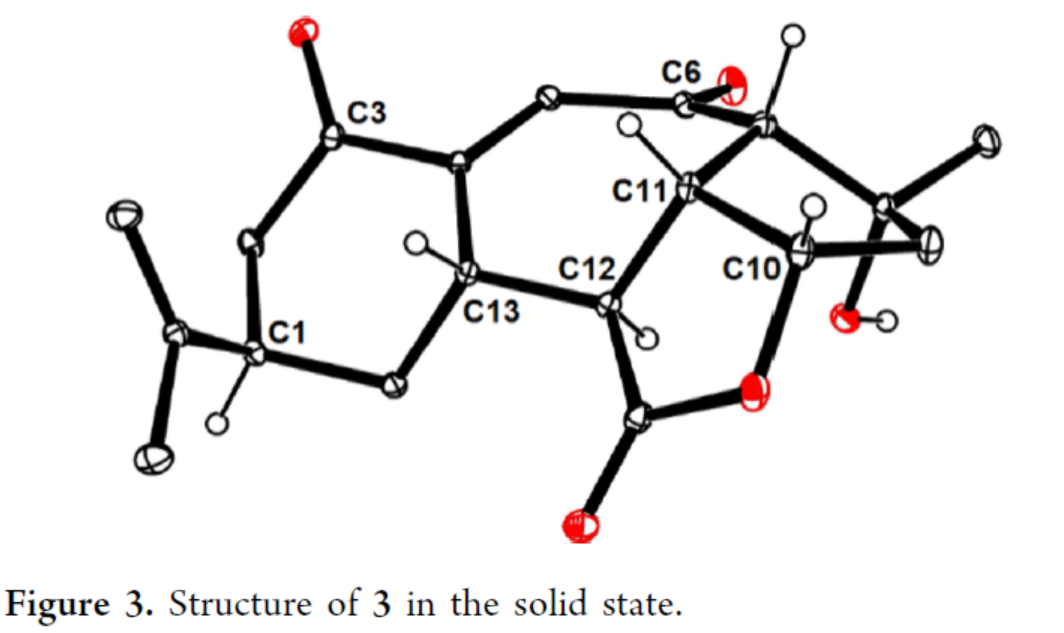
(图片来源:J. Am. Chem. Soc.)
Ineleganolide(6)和Horiolide(34)的全合成(Scheme 4)。通过对反应条件的大量尝试后发现,以(−)-3为底物,在Et3N/MeOH/MeCN条件下进行串联反应,包括C8−OH基团在烯酮上的oxa-Michael加成反应和C12立体中心的差向异构化,可以20%的收率得到Ineleganolide(6)。Ineleganolide(6)通过进一步的retro-oxa-Michael反应,得到中间体32,32接着发生retro-aldol反应,得到中间体33,33再发生Michael加成,可以25%的收率得到Horiolide(34)。
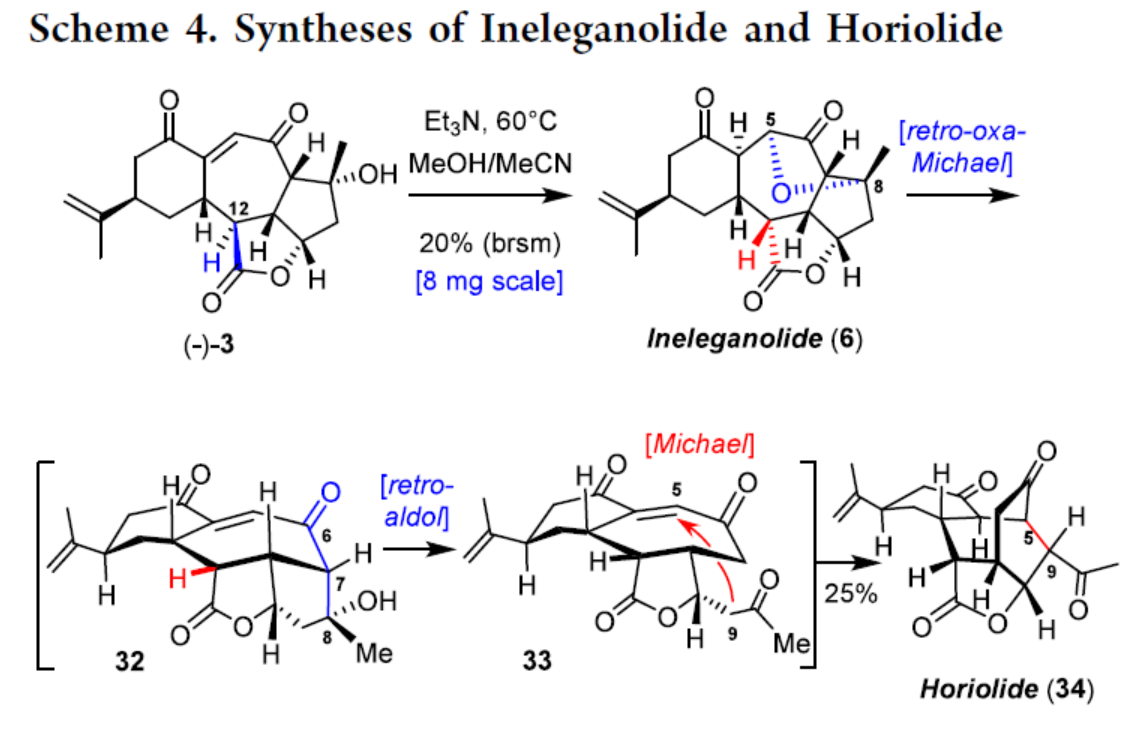
(图片来源:J. Am. Chem. Soc.)
总结
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn