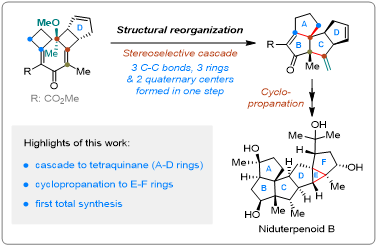
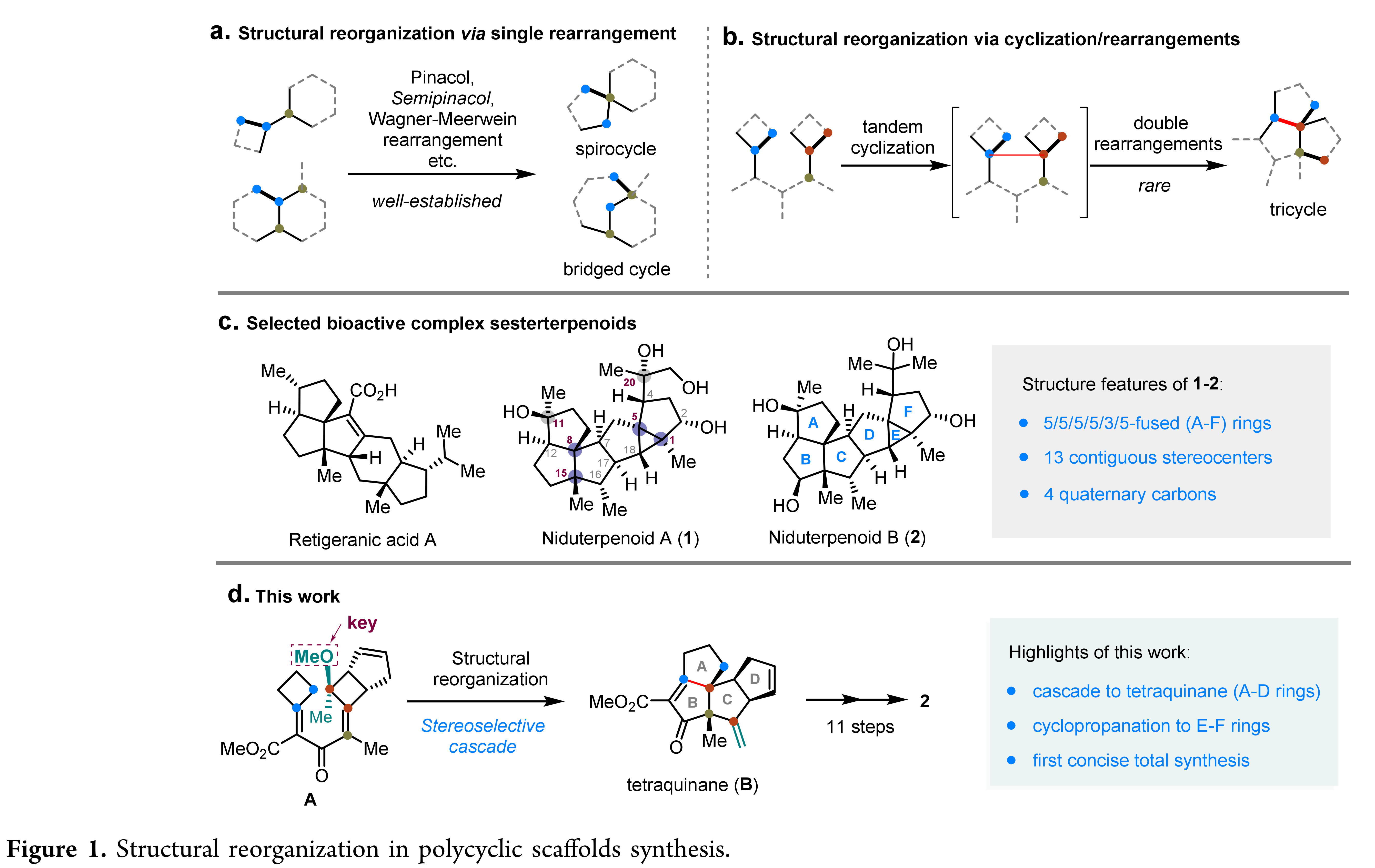
二倍半萜具有复杂的分子结构和广泛的生物活性,包括抗菌、抗肿瘤、免疫抑制等活性。Niduterpenoids A 和 B 是华中科技大学张勇慧教授课题组从构巢曲霉中分离得到的一种结构新颖的二倍半萜。 初步活性研究表明, Niduterpenoids A 和 B是雌激素受体α(ERα)的潜在拮抗剂,同时Niduterpenoid A以剂量依赖的方式抑制了17-雌二醇诱导的乳腺肿瘤细胞系 MCF-7 的增殖 (IC50 = 11.42 ± 0.85 μM)。从合成的角度来看,Niduterpenoids A和B中排列紧密的5/5/5/5/3/5六环全碳骨架存在几个极为严峻的合成挑战:(1)稠合的四奎烷(A-D环)和高张力的3/5并环(E-F环)骨架;(2)13个连续的立体中心,包括4个全碳季碳和2个氧杂季碳手性中心。骨架重组策略,即通过断裂和形成碳-碳单键,将易于制备的原料转化为难以直接合成的化学结构,为构建桥环、并环或螺环提供独特的机会,可以突破一些其他方法和策略难以触及的合成挑战。同时,开发更复杂的结构重组策略,即通过对多个碳-碳单键重组的精确调控,实现具有连续季碳中心的复杂聚奎烷骨架的合成,则更具挑战。2022年,涂永强院士团队设计并发展了一类新型的串联环化/重排反应,通过多次碳-碳单键重组,实现了角三奎烷结构(5/5/5角三环)的高效合成,为多奎烷天然产物的合成提供了一种极为有效的合成途径(Nat. Commun. 2022, 13, 2335)。基于前期的研究基础,涂永强院士团队利用结构重组策略完成了Niduterpenoid B 的首次全合成。该工作的关键是Niduterpenoid B骨架的构建:即在路线早期构筑四奎烷结构(A-D环),在后期组建3/5并环(E-F环)。作者预期通过分子内环丙烷化反应高效构建3/5并环,实现4到3的转化。化合物4可以由化合物5引入重氮侧链得到,而四奎烷5可以通过串联反应从二烯酮化合物6获得。在关键的串联4π电环化/两次扩环/消除反应中,作者认为6先发生环化产生烯丙基碳正离子Int 1,随后通过区域选择性的C16-C8(至C15)键和C9-C12(至C8)键的两次迁移以及甲氧基消除,得到预期的关键中间体5。作者期望通过引入甲氧基来控制所需要的迁移顺序。作者推测,在Int 1中,甲氧基的孤对电子与C16-C8的反键轨道之间的n-σ*非共价相互作用提高了了C16-C8键HOMO轨道的能量,从而降低了C15在碳正离子Int 1中的空p轨道的能垒,使C16-C8键优先迁移。最后,化合物6可以由多取代环丁酮7大量制备。从2-甲氧基丙酰氯和环戊二烯出发,通过[2+2]反应大量制备化合物7,之后通过Horner–Wadsworth–Emmons反应、水解反应以及与丙二酸单甲酯镁盐的缩合反应得到化合物9,最后通过Knoevenagel 缩合反应制备二烯酮6。作者对串联环化/扩环/消除反应的可能性进行了分析和尝试。化合物6中处于烯丙位的甲氧基对酸较为敏感,且拥挤的氧杂季碳中心对环化反应也是一个挑战,通常会不会使Nazarov环化发生。在多种Lewis 酸 (TiCl4,InCl3,AgSbF6等)条件下,化合物6被完全消耗,但是并没有检测到所预期产物5。经过系统的筛选反应条件,作者发现了B(C6F5)3, 樟脑磺酸(CSA)和4Å分子筛的的新反应体系,能够有效的促进该串联反应。该反应体系能够以41%的产率(克级规模)得到产物5。进一步研究表明,如果没有甲氧基,会生成C16位置立体化学不正确或是环系不正确的产物。这也进一步证实了甲氧基在控制该串联反应区域选择性方面的关键作用。 值得一提的是,高度拥挤的、多官能团的四奎烷5仅需五步就能从商业可得的原料大量制备。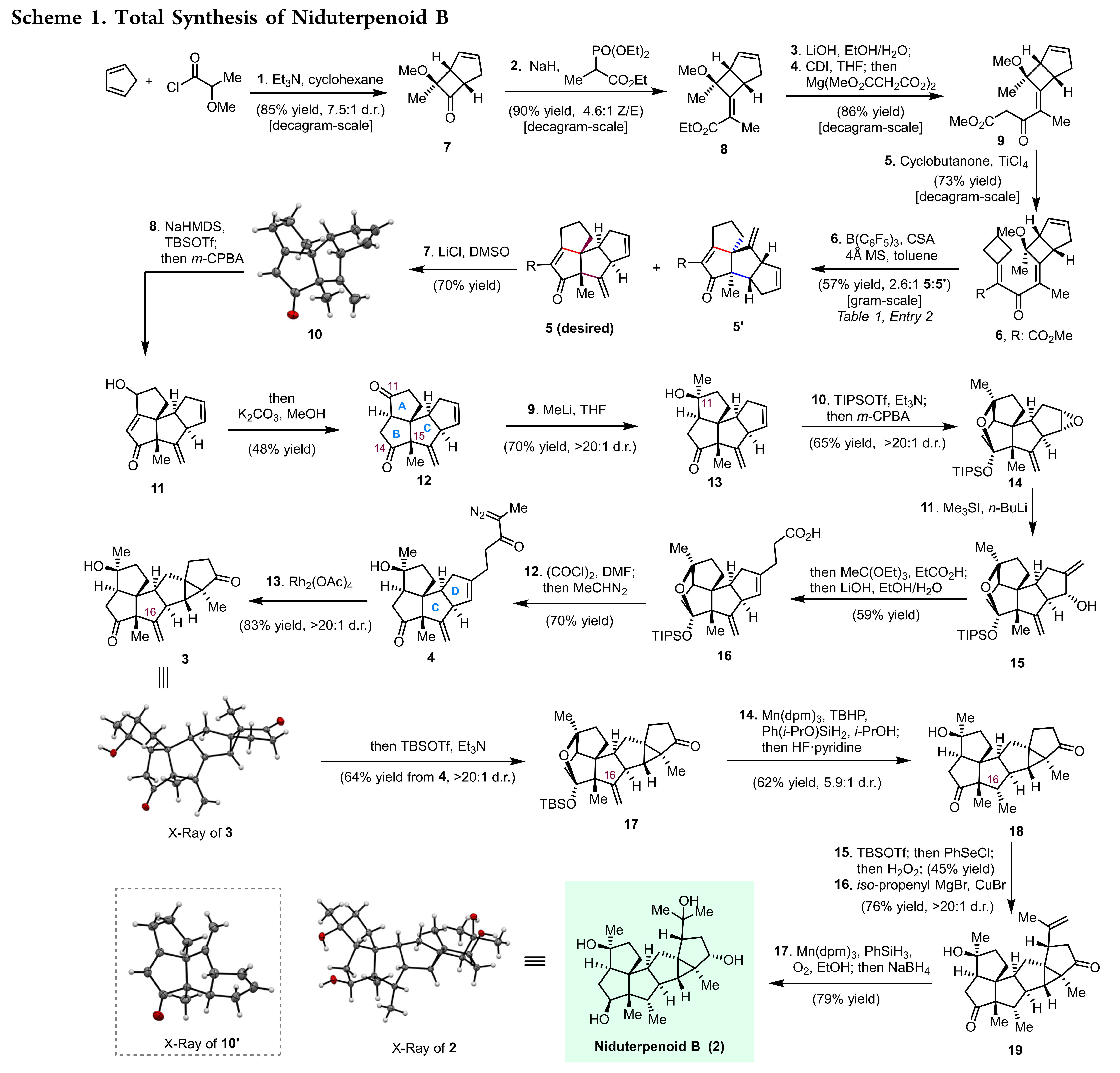
化合物5经Krapcho脱羧反应、γ-羟基化和碱性条件下的异构化反应得到二酮化合物12。化合物12经甲基锂的1,2加成反应生、硅基保护和环氧化反应转化为环氧化合物14。α-重氮酮化合物4可以从14 通过以下转化得到:1)在硫叶立德的作用下发生区域选择性的环氧开环得到烯丙醇15;2)与原乙酸三乙酯发生Johnson-Claisen重排和随后的水解反应得到羧酸16;2)羧酸16先与草酰氯反应转化为酰氯,再与重氮乙烷反应得到α-重氮酮化合物4。化合物4在醋酸铑的催化下顺利发生环丙烷化反应,以高收率和高非对映选择性得到预期六环产物3(单晶X射线衍射确证结构)。化合物3在Shenvi的自由基氢化反应条件下,得到C16位甲基构型不正确的氢化产物。随后作者通过硅基保护,制备了具有醚桥环结构的笼状化合物17,该底物在Shenvi的反应条件下能够以较高的收率得到预期产物18。酮18经氧化脱氢反应、异丙烯基共轭加成反应、Mukaiyama 水合反应和NaBH4还原,转化为目标天然产物 Niduterpenoid B (2),其结构通过单晶X射线衍射确定。最后,作者通过Corey-Bakshi-Shibata还原反应实现了(+)-Niduterpenoid B的不对称全合成,并通过比旋光度对比确证了天然产物的绝对构型。
该工作首次实现了Niduterpenoid B的全合成。亮点包括:(1)通过甲氧基控制的串联4π电环化/扩环/消除反应,以可预测的方式快速、高立体选择性地构建具有邻近全碳季碳中心的拥挤的5/5/5/5四环骨架(A-D环)。(2)通过高非对映选择性的铑催化的分子内环丙烷化反应,构建了具有相邻全碳季碳中心的5/3/5 三环骨架(D-F 环)。这种创新的合成方法展示了结构重组策略在快速构建复杂稠合多环体系和多个季碳中心的高效性。同时,其高效的合成路线也凸显了这种策略在复杂分子合成中的优势。该合成工作为设计和制备Niduterpenoid类似物以及发现用于乳腺癌治疗的新型 ERα 抑制剂提供一个多样化的研究平台。无论从重排反应本身所产生的结构官能团的变化,化学键重排的多重性,产生结构的复杂性多官能团性,还是完成更为复杂天然产物的潜力来说,这都是一个变革性进展。我们相信这个工作可以作为样板,推动更多复杂多环天然产物的合成进展。文献详情:
Total Synthesis of the Hexacyclic Sesterterpenoid Niduterpenoid B via Structural Reorganization Strategy
Yuan Xue, Si-Hua Hou*, Xiang Zhang, Fu-Min Zhang, Xiao-Ming Zhang, Yong-Qiang Tu*
J. Am. Chem. Soc. 2024,
https://doi.org/10.1021/jacs.4c09555