

尽管酰胺与烯烃的[3+2]环化已有初步的研究(局限于二级酰胺与桥环烯烃,图1a),但相应的自由基型[3+2]环化反应还未被研究,其中有两个重要的因素。第一是:酰胺难以被单电子还原而启动自由基反应;第二个是,酰自由基与烯烃的反应往往以氢原子转移(HAT)或单电子转移(SET)结束,发生加成反应(图1b),难以进一步环化。
近日,中山大学赵德鹏团队报道了首例芳酰胺与烯烃的自由基型[3+2]环化反应(图1c)。为了克服上述两个挑战,他们以亚胺盐为关键中间体进行了对应的设计。第一,采用亲电活化策略,原位将酰胺转化为易还原的亚胺盐,在温和条件下引发自由基。第二,在反应中间体中,芳环受亚胺盐的吸电子效应影响,自身电子云密度降低,与亲核性自由基反应性增强,从而实现环化,而不是广泛报道的加成后生成直链酮的反应。
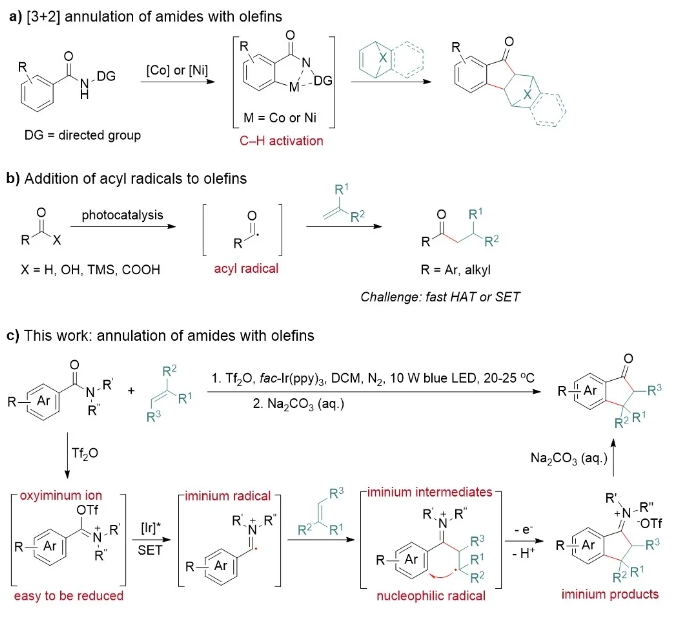
图1 酰胺与烯烃的[3+2]环化,酰基自由基与烯烃的加成
在最优条件下,作者考察了底物范围(图2)。在芳酰胺方面,反应对各种取代模式的芳环和酰胺均适用(3a-3z);在烯烃方面,末端烯烃、部分内烯烃和环烯烃均可以转化为目标产物(3al-4i),反应兼容F、Cl、Br、 I、MeO、酯基、氰基、磺酰胺、醚、胺等官能团,对酰胺具有较高的选择性。值得一提的是,作者直接分离出一批亚胺盐产物(4a-4i),为反应过程的理解提供了证据,同时为方法的进一步应用提供了基础。
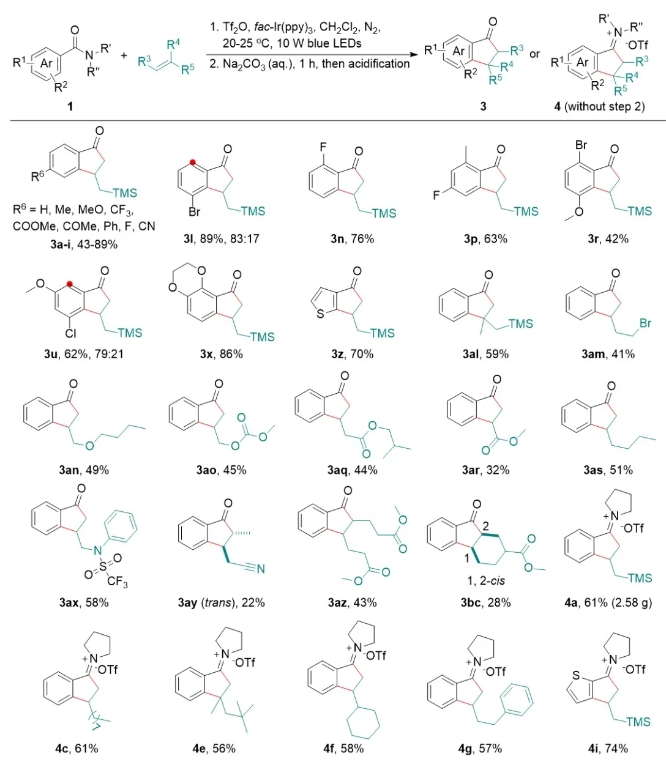
图2 部分底物
在底物扩展的基础上,作者进行了产物衍生化和方法的应用研究(图3)。首先,作者进行了原位衍生化,一锅法合成了烯胺和胺(图3a)。然后作者对亚胺盐产物和酮产物分别进行了衍生化,包括氟代、扩环、稠环衍生、合成抑制剂等(图3b)。最后,作者将方法应用在活性分子的后期结构修饰中(图3c)。
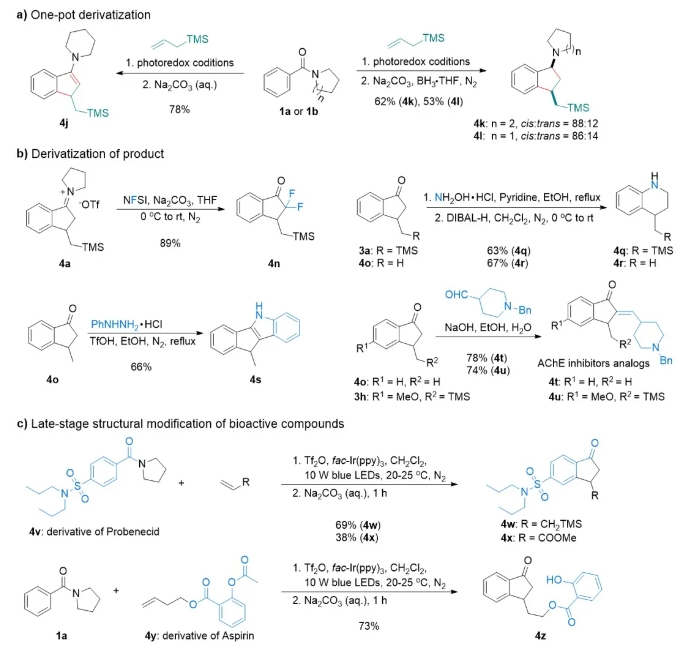
图3 产物衍生化
为了验证反应机理,作者进行了自由基捕捉实验(图4a)、氢氘转移实验(图4b)、自由基串联实验(图4c)和动力学同位素实验(图4d),充分验证了各个反应中间体的存在,为反应机理的提出提供了坚实的基础。
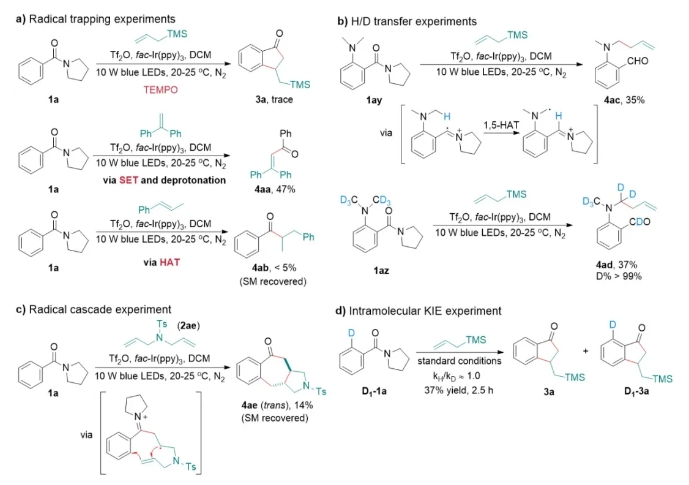
图4 机理实验
在以上机理实验、产物结果和前期文献的基础上,作者提出了如下反应机理(图5)。首先,芳酰胺与三氟甲磺酸酐(Tf2O)作用,原位生成亚胺盐A,A与激发态光催化剂(*IrIII)发生单电子转移(SET)被还原成亚胺盐自由基B,光催化剂则被氧化成IrIV;随后B与烯烃加成,生成自由基中间体C,接着发生分子内加成生成中间体D,D与氧化性的IrIV单电子转移形成正离子中间体E,同时光催化剂被还原成IrIII进入下一个催化循环;然后E脱质子得到亚胺盐产物4。最后,在碱作用下,4异构化成烯胺F,并于酸性条件下水解得到1-茚酮产物3。
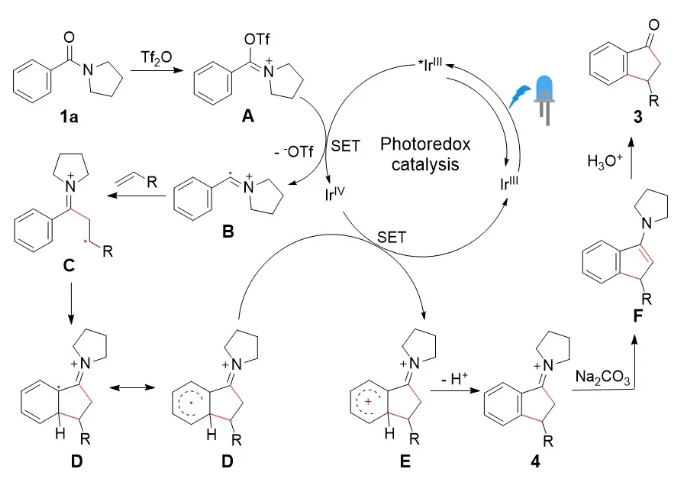
图5 可能的机理
在该工作中,作者以亚胺盐为关键中间体,对反应过程进行控制,实现了芳酰胺与烯烃的自由基型[3+2]环化反应。该方法操作简单、官能团耐受性好、底物范围广,一系列芳酰胺与烯烃在光催化下环化成生成重要的1-茚酮骨架。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn