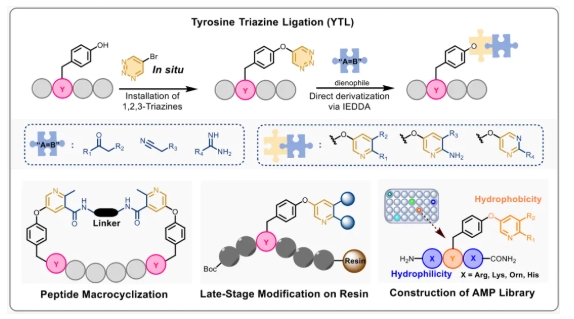
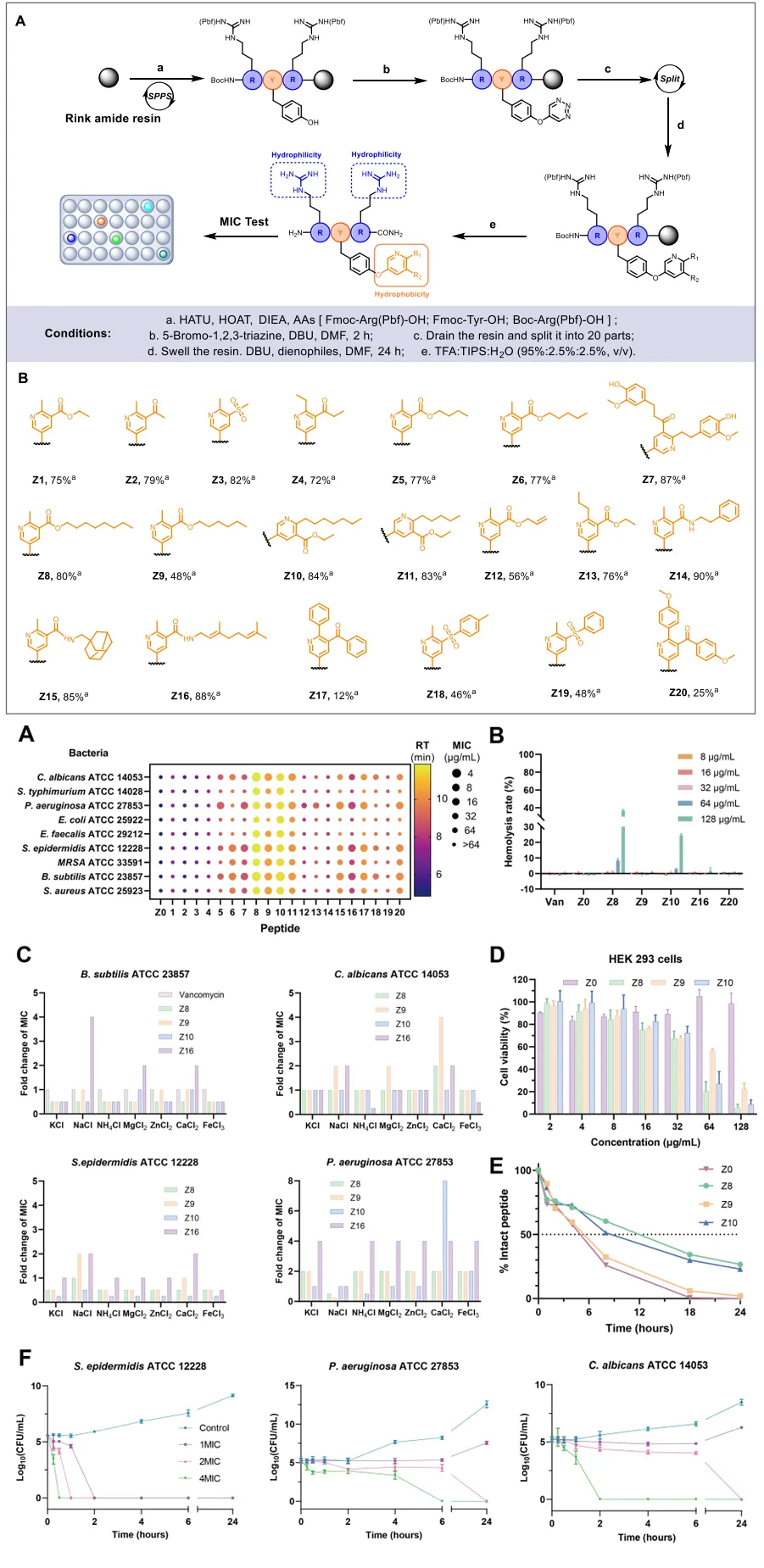
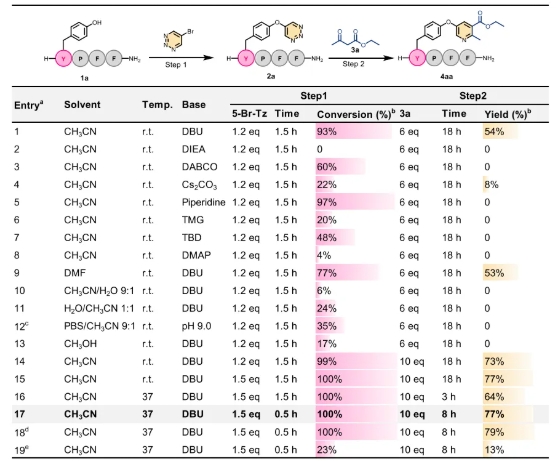
作者首先以内吗啡肽-1(1a)作为模型底物肽,选择乙酰乙酸乙酯(3a)作为模型亲二烯体,通过调控反应条件,获得了最佳组合模块化精准修饰条件,实现了79%的优异收率(Entry 18)。
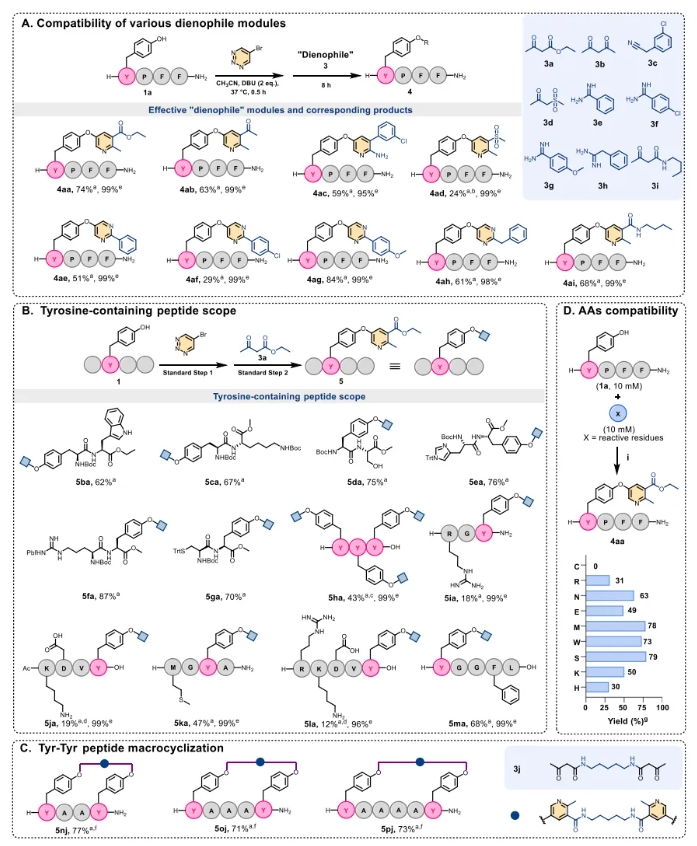
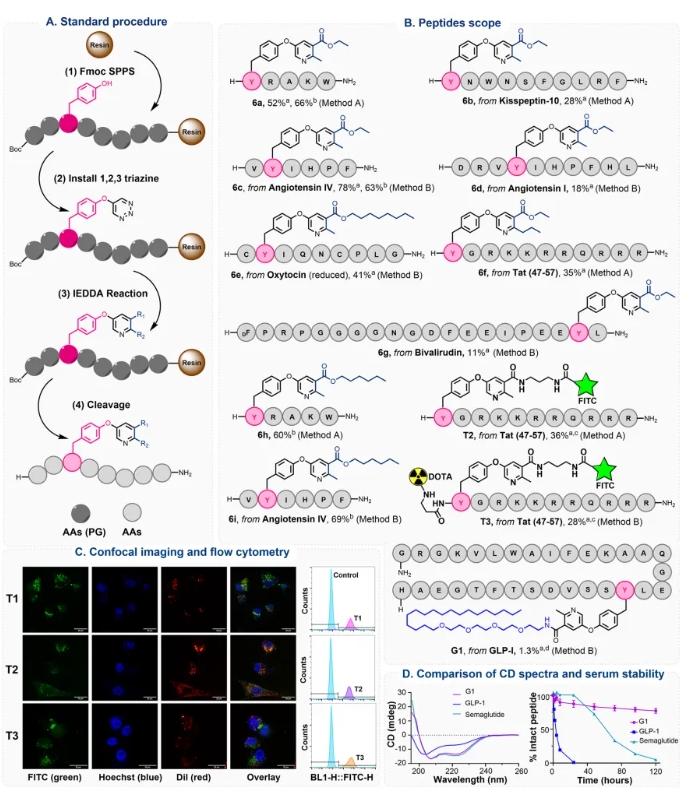
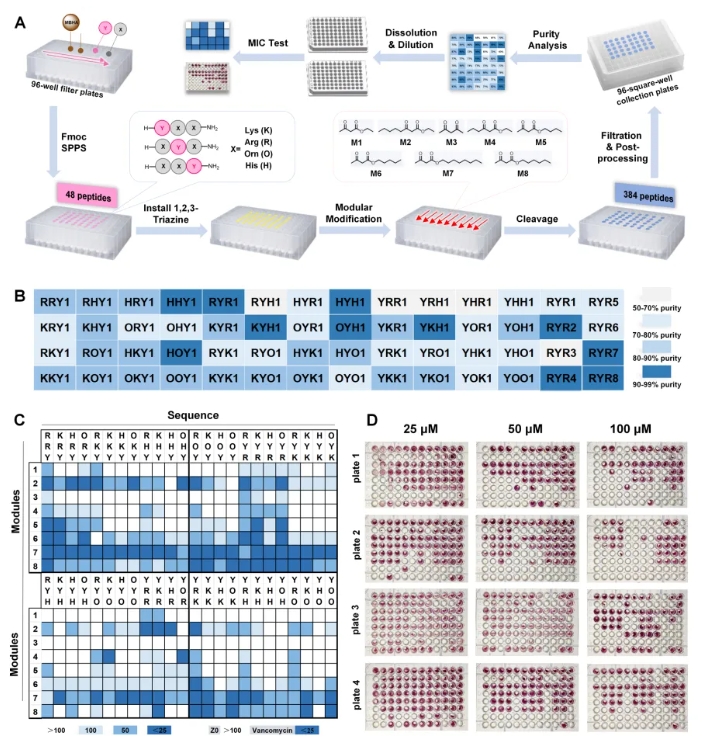
其次,为了评估该策略的兼容性,从各种富电子亲二烯分子模块出发,研究了其与一系列具有代表性的底物肽的相容性。结果证明该策略允许灵活引入多种模块化修饰。且对多种氨基酸具有适用性(赖氨酸、精氨酸等碱性氨基酸会降低产率(50–60%))。此外,该策略还兼容多肽环化。为了验证YTL策略在多肽药物固相组合修饰中的应用潜力,该团队在固相多肽合成条件下,实现了系列生物活性多肽的组合精准修饰。特别是,作者以穿膜肽TAT作为模式肽,通过YTL策略实现了N端DOTA和酪氨酸侧链FITC的双修饰,构建了荧光素/核素双模成像探针T3,通过激光共聚焦和流式细胞术实验,证明了其应用价值。其次,利用YTL策略实现了对GLP-1分子的精准修饰。 更重要的是,为了验证YTL策略在高通量多肽药物优化筛选中的应用,作者利用96孔过滤板和收集板构建了384个两亲性超短抗菌肽库,然后通过细菌染色分析进行快速筛选,序列为RYR的肽具有良好活性。受上述筛选结果的启发,进一步对RYR肽进行模块化后修饰。采用混分策略,使用M1-M8等商用模块以及合成的连接体(例如3n、3o和3p),成功合成了20个两亲性短肽(Z1−Z20),MIC结果显示Z8有较好抗菌活性。 最后,对这些短肽进行了系统的生物学评估,以鉴定具有进一步开发潜力的AMP。选择了11种代表性菌株——5种革兰氏阴性菌、5种革兰氏阳性菌和1种真菌——对其抗菌活性进行全面评估。通过最低抑菌浓度(MIC)、盐稳定性、溶血活性、细胞毒性等生物学评估,证实了Z8可在30分钟内快速杀灭99%的金黄色葡萄球菌,对HEK293细胞具有高选择性,在90%血清中半衰期达12小时,具有良好稳定性,显著优于未修饰肽。 综上,王锐院士团队创新性地开发了酪氨酸-1,2,3-三嗪连接策略,为高通量肽合成、筛选和优化提供了一个多功能、高效的平台,为多肽药物的开发提供了新的机遇。 相关工作近期发表在 Journal of the American Chemical Society 上,中国医学科学院北京协和医学院药物研究所/兰州大学王锐院士,兰州大学孙旺盛青年教授,以及协和药物所胡宽研究员为文章共同通讯作者,文章共同第一作者是协和青年学者博士后左权博士,以及兰州大学硕士研究生宋昕旖和协和药物所硕士生闫洁。 文献详情:
Triazination/IEDDA Cascade Modular Strategy Installing Pyridines/Pyrimidines onto Tyrosine Enables Peptide Screening and OptimizationQuan Zuo,§ Xinyi Song,§ Jie Yan,§ Guangjun Bao, Yiping Li, Jieting Shen, Zeyuan He, Kuan Hu,* Wangsheng Sun,* and Rui Wang*https://doi.org/10.1021/jacs.4c17615