

正文
在过去十年中,自由基交叉偶联在逆合成分析中的应用经历了复兴。这是由于具有挑战性的C-C键的简单、收敛断开导致卤化物、酸、胺、醇和烯烃等官能团广泛存在(图1A)。在实践中,所有这些广泛使用的自由基前体都需要某种外源氧化还原活化模式。无论选择氧化或还原活化,通常都需要化学计量的化学添加剂、促进光诱导电子转移的催化剂或电化学。自20世纪30年代末以来,人们就开始使用烷基二氮烯,但主要局限于2e–-去官能化方法,如经典的Wolff-Kishner还原和相关反应(图1B)。1993年,Taber报道了使用磺酰肼原位衍生二氮烯,实现了酮1到八氢茚满2的自由基环化。基于这一先例,Phil S. Baran教授设想从这些中间体中衍生的未经氧化还原引发的自由基是否可以用于金属催化的交叉偶联事件。本文报道了一种非常通用的平台,用于由原位衍生的烷基二氮烯驱动的氧化还原中性自由基交叉偶联,以形成各种 C-C键。 欢迎下载化学加APP到手机桌面,合成化学产业资源聚合服务平台。
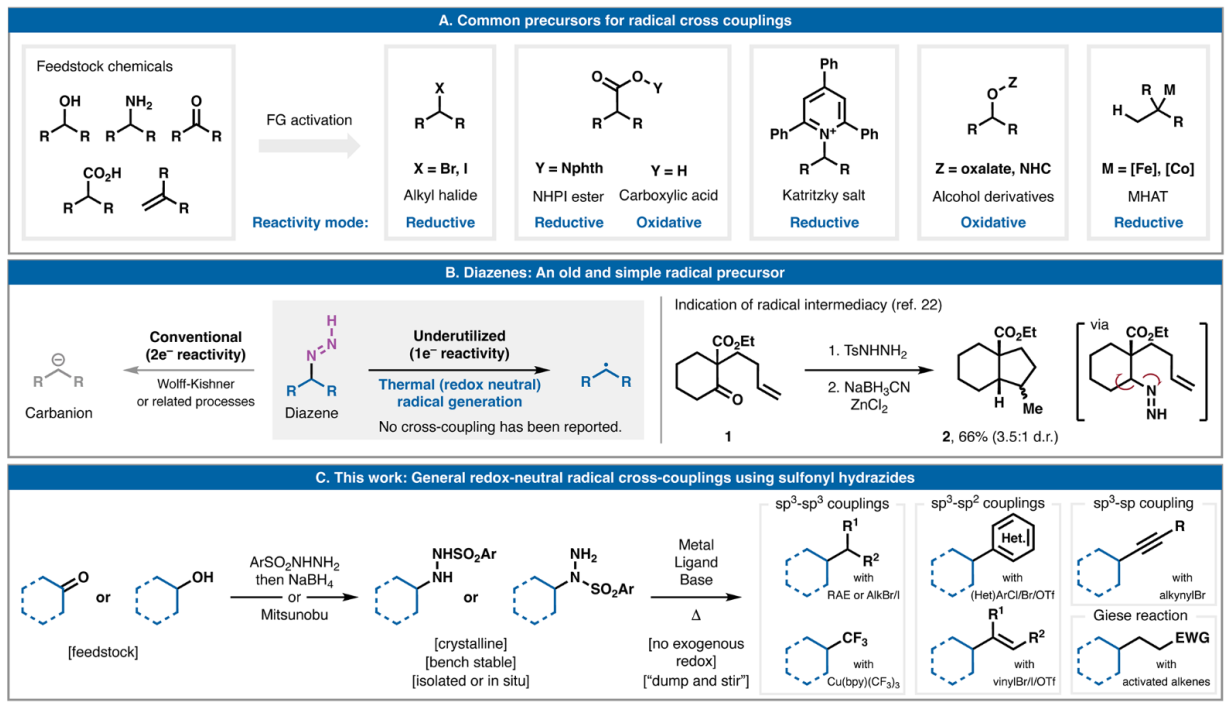
图1. 研究背景及反应发展
(图片来源:Science)
图2说明了磺酰肼作为氧化还原中性偶联物在七种有价值的C-C键形成事件中的多功能性。首先展示了最简单的自由基偶联,即Giese型不饱和物质加成(图2A)。对于此反应,dtbbpy 与Ni(dme)Cl2以及Et3N(3.0当量)协同使用,以28-65%的产率提供五种代表性加合物(3-7)。在没有Ni/L系统的情况下,该反应的产率显著降低。在Ni(dme)Cl2、2,6-双(吡唑-1-基)吡啶(bpp)和Et3N (3.0当量)存在下,在60 °C的DMF中使用接近化学计量比的偶联剂(1.5当量磺酰肼和1.0当量烷基卤化物或RAE),以良好的产率生成一系列二级-二级(10-12、15和16)和二级-一级加合物(9、13和14)。从操作角度来看,该反应可能是形成饱和C-C键(尤其是具有挑战性的2°-2°键)的最简单、最便宜的方法。这种偶联方法的一个显著特点是,不需要外源氧化还原化学反应。
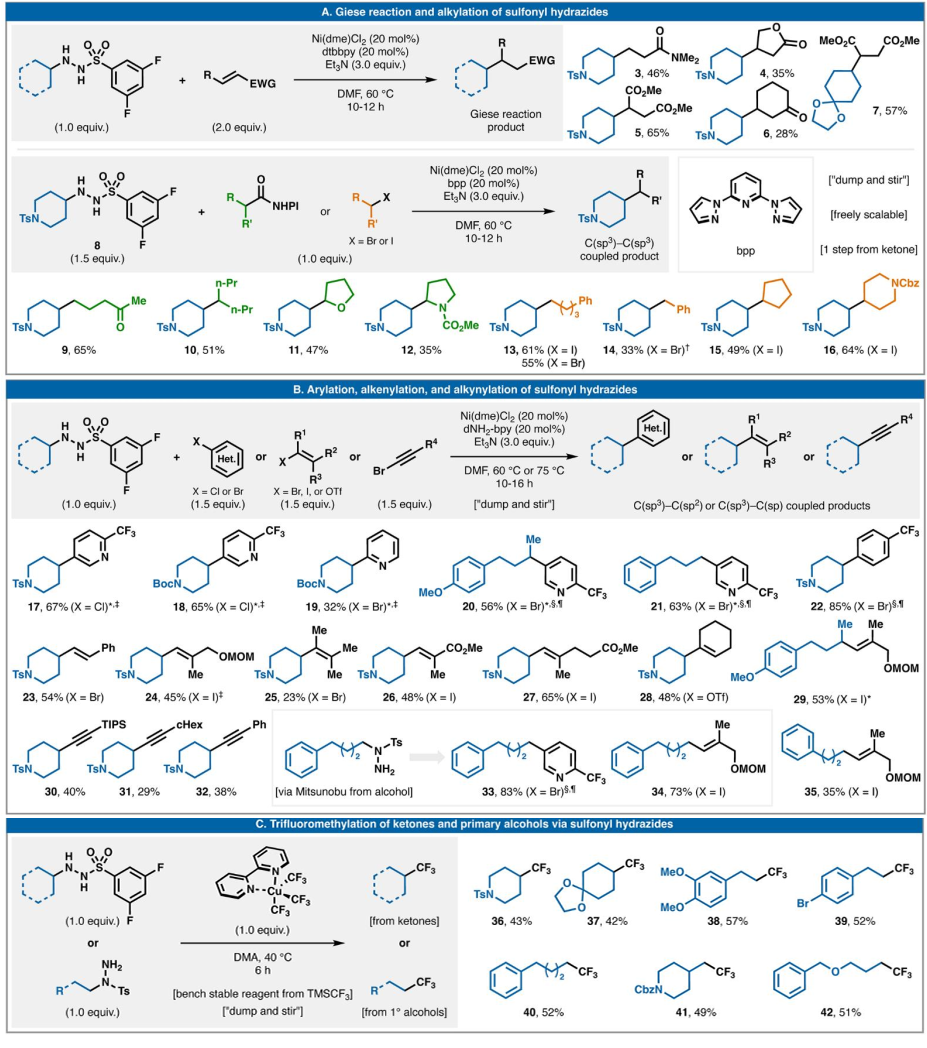
图2. 磺酰肼的七种氧化还原中性反应
(图片来源:Science)
转向C(sp3)-C(sp2)和C(sp3)-C(sp)键,已确定一系列可行的偶联配体(图2B)。烯基供体(溴化物、碘化物和三氟甲磺酸酯)、芳基卤化物(氯化物和溴化物)和炔基溴化物均能轻松与磺酰肼偶联(分别为23-29 和34;17-22和33;30-32和35),使用与上述类似的条件,dNH2-bpy配体通常可产生更高的产率。与实现此类转化的大多数还原模式不同,C(sp2)-卤化物底物的质子脱卤化和/或同二聚化受到极大抑制,从而简化了产物分离。C(sp2)-氯化物和三氟甲磺酸酯的使用,以及不使用自燃试剂(Negishi和Kumada 型)、钯或氧化还原聚焦反应装置(光电化学)降低了这些自由基交叉偶联广泛应用的实际障碍。
上述反应都依赖于Ni-催化来促进有效的C-C键形成。然而,磺酰肼的使用并不局限于Ni,如图2C所示,使用Grushin的商业Cu基试剂Cu(bpy)(CF3)3对这些物种(36-42)可进行直接三氟甲基化。与使用相同试剂对烷基卤化物或醇进行相关的三氟甲基化不同,不需要外源氧化还原活化。
一般而言,3,5-二氟苯磺酰肼对二级环状自由基表现出最佳反应性,但在许多情况下,如一级衍生自由基,可以使用简单的对甲苯磺酰取代的酰肼(33-35和38-42)。在芳基化的情况下,简单的对甲苯磺酰肼表现良好(17-22)。一般而言,酰肼产生的副产物在水相处理后很容易去除。这些反应非常适合并行筛选工作流程,因为它们是均相的,并且可以在非常小的规模上进行。由于它们的均相性,它们也可以轻松扩大规模。迄今为止的探索表明,大多数2°-环状磺酰肼是实验室稳定的物质,尤其是对甲苯磺酰肼。
从操作角度来看,可能希望直接从腙开始获得偶联产物,而无需分离相应的磺酰肼,类似于广泛使用的Barluenga偶联。在该反应中,磺酰腙简单地与C(sp2)-硼酸结合,通过重氮中间体提供有用的C(sp2)-C(sp3)键。可以将简单的硅烷(PhSiMe2H)原位添加到标准反应条件中,从而使用更方便的(杂)芳基卤化物实现与还原性Barluenga偶联等效的反应,如图3所示。就实验方案而言,操作上很简单,因为磺酰腙的形成是定量的,并且分离是可选的。如果使用未经纯化的腙,蒸发后存在的残留量MeOH不会对随后的偶联产生重大影响。准备好腙(分离或蒸发甲醇后使用)后,添加剩余物料(ArX、Ni(dme)Cl2、dNH2-bpy),然后在N2或Ar下添加DMF(预搅拌直至均匀),然后添加碱和硅烷。将反应加热至75 °C过夜(16-18小时),然后进行标准水性后处理。就芳基亲电试剂范围而言,趋势与已知的Ni氧化加成速率所预期的趋势一致。使用电子富集度高的配体(dNH2-bpy)和高温有助于进一步扩大这一范围。因此,富电子的芳基溴化物是可行的,但缺电子的芳基溴化物效果更好。缺电子的芳基氯化物是合适的偶联剂,芳基三氟甲磺酸酯(18)也是如此。该类化合物可兼容多种功能团,包括对进一步功能化有价值的手柄:Bpin、多卤代芳烃、游离戊二酰亚胺NH、游离氨基吡啶、芳基氟化物、SMe、四唑、苄基CHF2基团、腈、酯、酰胺、邻位取代基以及具有挑战性的杂环化合物,如嘧啶、吡嗪、吲唑和氮杂吲哚。环大小从4到6的环酮很容易反应。相邻杂原子是可以容忍的,并且对于带有预先存在的立体中心的酮(68和69),观察到良好至高的非对映体比(d.r.)。复杂的桥接酮也能以高非对映选择性提供有用数量的产品。最后,醛(77–79)也可以用于反应。
与图2B中所示的磺酰肼直接芳基化不同,使用腙进行原位还原时观察到的副产物更多,这些副产物源于质子脱卤化和与还原亚磺酸盐反应产生的产物。因此,图3中的芳基化方法更适合于药物化学中的快速筛选活动,因为在这种活动中分离产率不太重要。
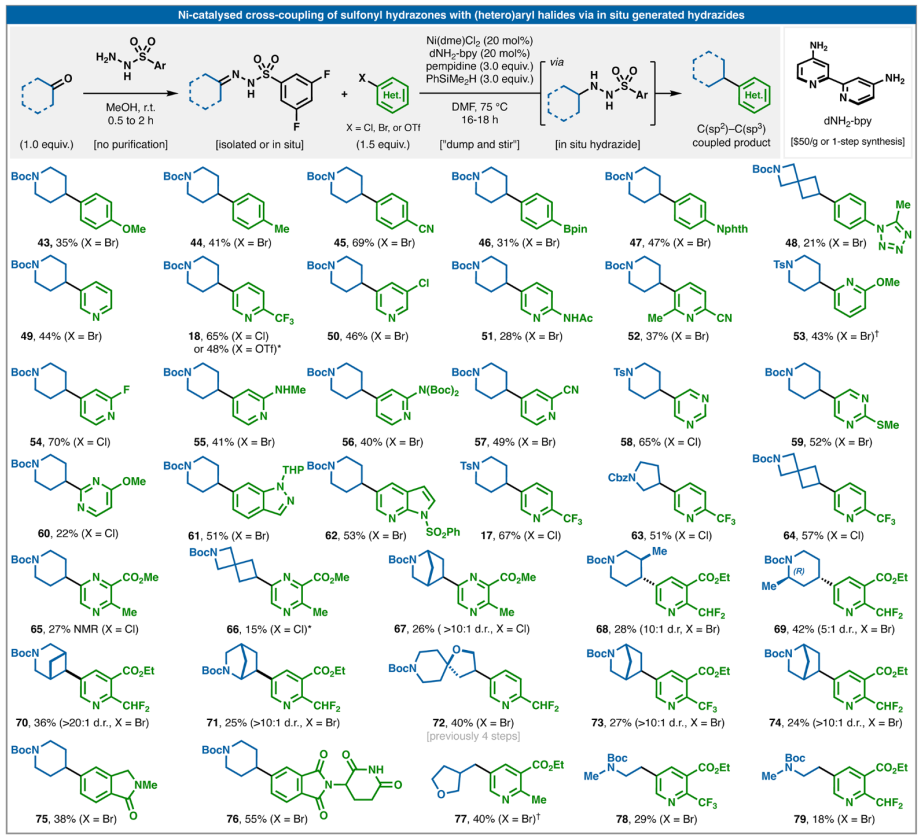
图3. 磺酰肼和芳基卤的一锅法偶联
(图片来源:Science)
烷基磺酰肼的氧化还原中性自由基交叉偶联可以大大简化获取多种有用结构单元的流程。如,羟乙基化吡啶80(图4A)是市售的,但价格过高。逆合成方面,可以设想多种选择,使用各种羟乙基替代物,如环氧乙烷、β-羟基酸/RAE、Katritzky盐、硼酸供体、锡烷和氯乙醇。这些结构单元中的大多数要么不合适,要么不稳定,要么难以获取,要么使用不方便。与之形成鲜明对比的是,商业肼88(0.2美元/克)和氯吡啶81(4-5美元/克)可采用单步工艺在室温下搅拌30分钟,然后加热至75 °C并持续6小时合成,产率为68%。自由基交叉偶联通常具有较高的化学选择性,可进一步用于温和的后期修饰,如替格瑞洛的直接官能化(图 4B)。无需任何保护基化学反应,89可与TsNHNH2进行Mitsunobu反应以形成磺酰肼,然后立即(在水处理后)进行自由基交叉偶联,以33%的产率经两步得到芳基化加合物90。很难想象有更直接、更简单的方法来实现这种转化。
通过分别用芳基溴93和RAE 91处理磺酰肼8以良好的产率进行了克级底物17和92的制备。在自由基交叉偶联中消除外源性氧化还原的明显优势不仅在于反应简单,还在于有利于扩大规模,如图 4C所示,1,4-反式取代的环己烷96和100可以分别使用磺酰肼供体94a与芳烃 95和99轻松通过“倾倒-搅拌”均相反应获得。
尽管本文报道的Ni催化剂负载通常为20 mol%,但低至1 mol%的催化剂负载是可行的。在8和93的克级偶联中,采用了10 mol%的负载(以80%的产率生成17),这进一步表明降低 Ni 负载是可能的。
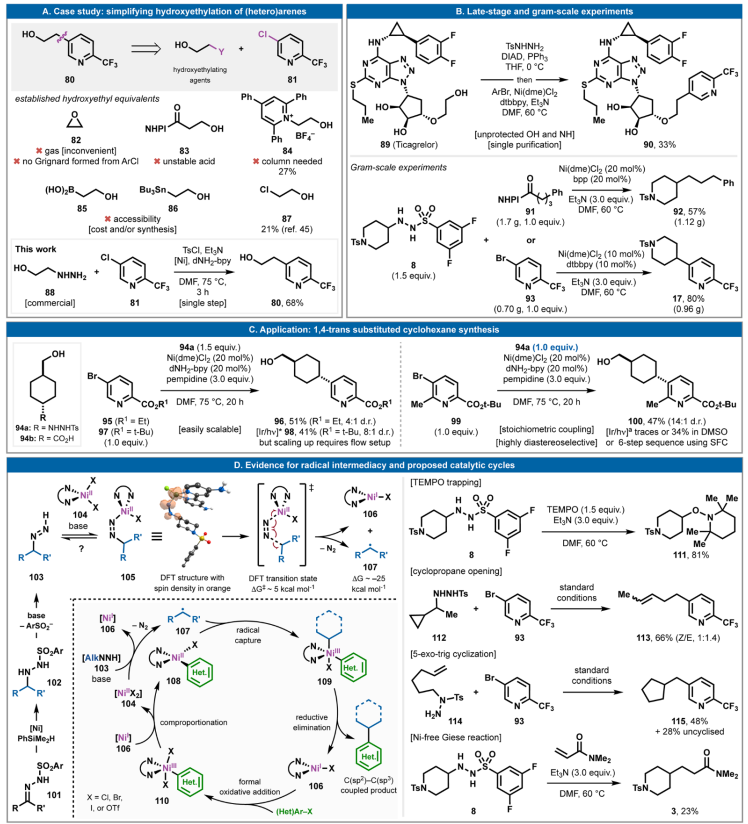
图4. 后期应用及机理研究
(图片来源:Science)
本文报道的七种反应类别可以单独研究,以发掘其机制(图4D)。温和的碱会从起始酰肼102中释放出二嗪物种103,随后,由Ni-介导的碳自由基从102生成。该假设得到了DFT分析的支持,揭示了二嗪以Z构型与高自旋Ni(II) 复合物104结合的途径。碱对质子的提取几乎是热中性的,得到中间体105。DFT分析发现,释放二氮并形成还原Ni(I)物种106和烷基自由基107仅需要适中的势垒(ΔG‡ ~5 kcal mol−1),并且热力学下降约25 kcal mol−1。随后,通过将低价Ni(I)形式氧化加成到(Het)Ar-X键(从106到110)并进行配位反应,在文献中已充分证实了方平面Ni(II)复合物108的形成。研究表明,108捕获自由基会产生高价 Ni复合物,如109。109的还原消除会产生C(sp2)-C(sp3)偶联产物,并返回低价物种106,进而重新开始循环。TEMPO 即使在没有Ni催化剂的情况下也能捕获由酰肼产生的自由基(8到111),表明存在自由基背景途径。可以看到一种有效的自由基途径,其中环丙烷开环/112与 93偶联以提供线性加合物113,5-exo-trig环化/114与93偶联以提供环戊基底物 115。
总结
磺酰肼不仅可以作为多功能的自由基前体,还可以作为它们自己的电子供体,在排出N2的驱动下,促进金属介导的催化循环,从而消除对外部氧化还原刺激的需求。磺酰肼通常是稳定的结晶物质,不需要通过色谱法纯化,可以以粗品形式使用。这些基团的极性不是很强,在硅胶上表现良好。催化作用是用Ni来演示的,但可能适用于许多其他有机金属体系。由于易于制备的磺酰肼将氧化还原化学与自由基交叉偶联分开,因此反应设置大大简化。这些C-C键形成反应很可能会在几乎所有化学合成分支中得到应用。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn