

正文
本世纪之初,J. A. Labinger 和 J. E. Bercaw 在《Nature》杂志上预言:C-H 活化策略终究会让我们更高效、更清洁地开发地球上的烷烃资源(Labinger, J. A., Bercaw, J. E. Nature2002, 417, 507)。无独有偶,Robert G. Bergman教授2007年在《Nature》杂志上撰写的“C-H Activation” 一文中开门见山地指出:C-H活化的这些反应能带来化学工业的革命 (Bergman, R. G. Nature 2007, 446, 391)。然而,几十年过去了,这些预言依然无法成真。尽管围绕C-H活化的研究如火如荼,然而真正兼顾高选择性并适用于工业化放大生产的方法却仍然空白。
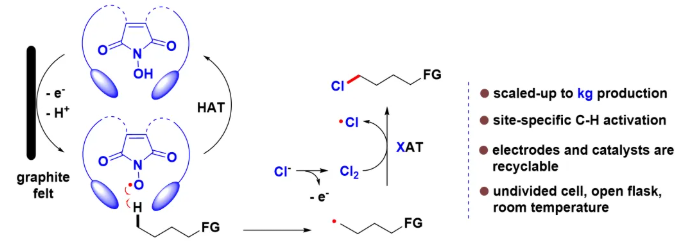
针对这一长期以来悬而未决的挑战性难题,南京中医药大学柳忠全教授团队一直致力于运用有机自由基化学策略来解决惰性C-H键的选择性活化研究。经过近20年的努力,该团队结合电化学和有机小分子协同催化,发展了一系列方法,实现了烷烃不同位点的C-H键的选择性氯代。这些方法不仅具有高度的位点选择性,而且均能轻易地放大到公斤级生产。3oC-H的选择性氯代详见Green Chem.2024, 26, 507-512。受到前人及该研究的启发,我们提出了如下设想(图1)。有着适宜空腔尺寸的BINOL型N-OH催化剂在阳极发生单电子氧化并脱质子后得到相应的N-O自由基,位阻效应使得只有适宜化学环境的C-H键才能进入空腔,与N-O自由基发生HAT,进而产生相应的C-中心自由基且再生N-OH催化剂,随后烷基自由基与同在阳极表面产生的卤源发生卤原子转移(XAT),即可实现(sp3)C-H键的选择性卤化。此外,采用电化学方式有望解决末端(sp3)C-H键选择性活化中两个关键的科学问题:1)具有特定空腔尺寸的BINOL型N-OH催化剂有可能通过分子间的弱相互作用力,稳定在阳极表面原位产生的1o(sp3)C-中心自由基,使其有足够的时间与同在阳极表面原位产生的卤源发生XAT,从而解决1o C-中心自由基的稳定性问题;2) 通过电极电流推动的电子转移,无需使用额外的氧化剂或还原剂,只需解决电极的可重复使用问题,则有望实现大规模生产。
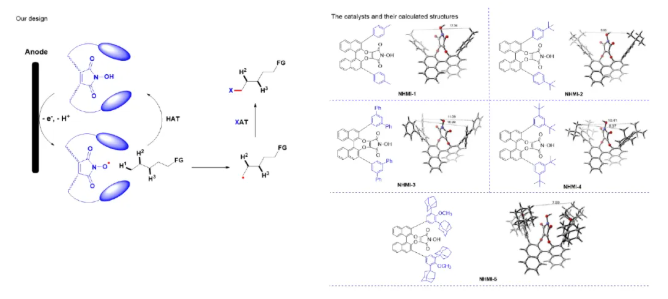
图1. 实验设计以及催化剂合成
为此,作者设计合成了一系列催化剂,经结构优化、条件筛选,我们实现了一系列烷烃的末端C-H氯代。底物涵盖直链烷烃(如正己烷)、环烷烃及含硝基、氰基等官能团分子,产率48%-75%。并且顺利地应用于多种生物活性分子(如丙磺舒、萘普生)的后期氯代,位阻最小位点优先反应(选择性>95:5)(图2)。
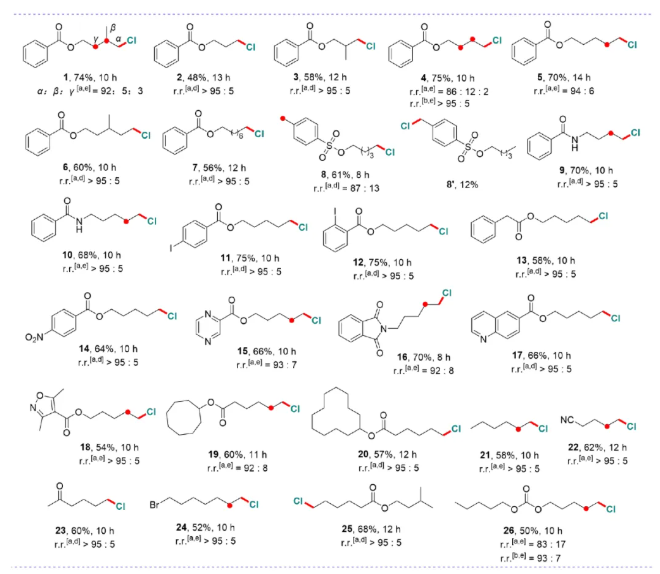
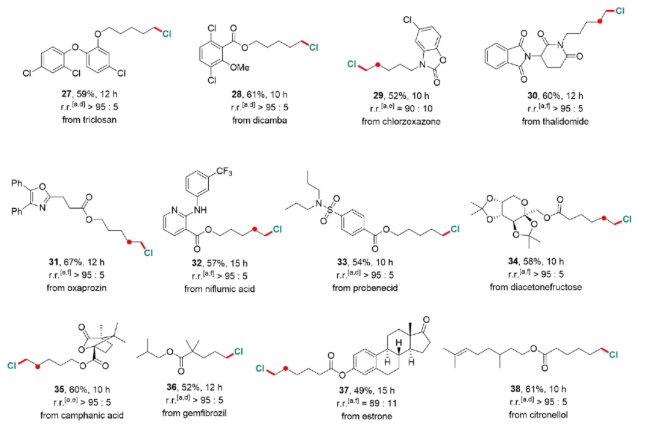
图2. 底物拓展
为了考察该方法的工业化应用前景,分别选用正己烷、1-溴正庚烷和苯甲酸正戊酯进行了公斤级放大实验。结果显示,只需0.1 mol%的催化剂,即便放大到公斤级生产,该体系仍能保持较高的产率和优良的选择性。此外,运用该方法合成药物吉非罗齐的新路线,不仅大幅降低成本,而且更绿色高效。随后连续流电化学合成的应用,进一步证明了该体系的工业化潜力(图3)。
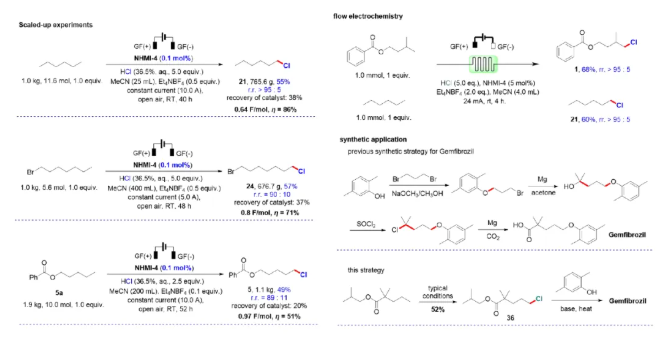
图3. 合成应用
作者开展了一系列机理研究、控制实验及动力学研究(图4)。通过自由基探针实验证实了氯气分子的生成,并说明了氯气的生成速率高于氯自由基与烯烃的加成环化速率。通过特征中间体捕获实验,提供了烷基末端碳中心自由基产生的关键证据。结合实时动力学监测,验证了区域异构体副产物在反应条件下的化学惰性,排除了主产物经副产物降解重组的可能性。氘代动力学同位素效应(KIE)测定结果表明,C(sp3)-H键断裂过程不是反应的决速步骤(KIE = 1)。该结果与均相体系截然不同,电化学体系中快速的C-H断裂,可能正是该体系高位点选择性的决定因素之一。
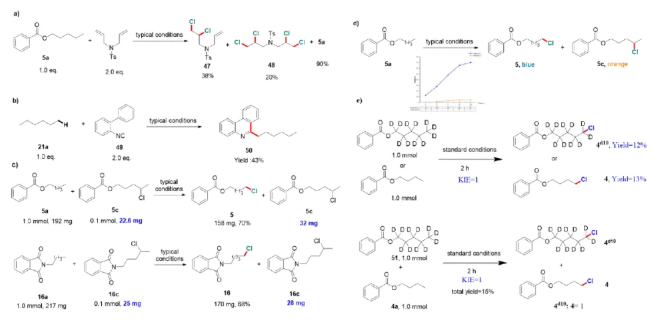
图4. 机理研究
总结与展望
总结

声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn