

氧化吲哚是天然产物和具有药用价值小分子中常见的骨架之一(图 1),因此备受化学家们的关注。
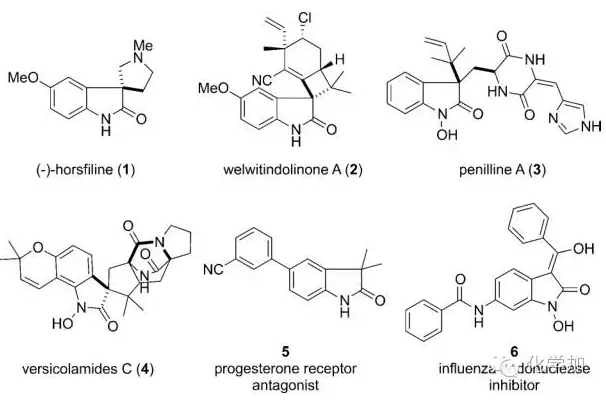
图 1 含有氧化吲哚骨架的天然产物和药物分子
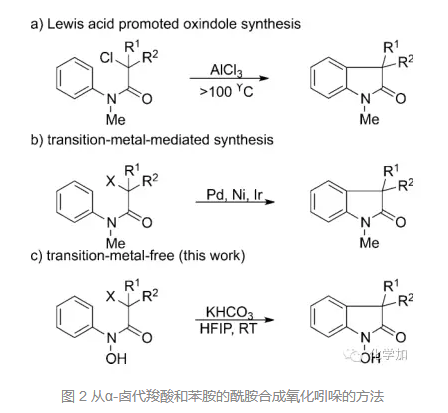
传统的合成氧化吲哚的方法条件比较苛刻,如图2所示:α-卤代羧酸和苯胺的酰胺在AlCl3条件下,大于100 ℃的高温下反应;或者需要额外的氧化剂或者比较昂贵的金属催化剂,都不符合绿色化学的要求。因此,发展更加高效,条件更加温和的氧化吲哚合成方法是有机化学家需要解决的一个问题。而本文就是发展了无过渡金属、无氧化剂的合成氧化吲哚的方法。
氮杂氧化的烯丙基阳离子(Azaoxyallylic cations)是一类非常重要活性中间体,在许多环化反应和合成中都有应用。该中间体如果被苯环捕获,就可以用来构建氧化吲哚骨架。
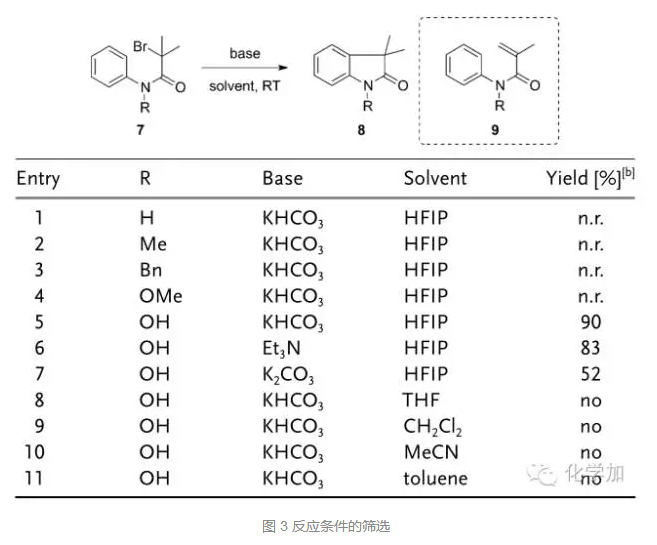
首先,作者对反应底物和条件进行了筛选,发现当酰胺氮上的取代基为OH时,KHCO3作碱,六氟异丙醇HFIP作溶剂,可以90%的高产率得到氧化吲哚骨架8,当氮上为其它取代基或者选用其它碱时,要么不反应,要么产率降低。
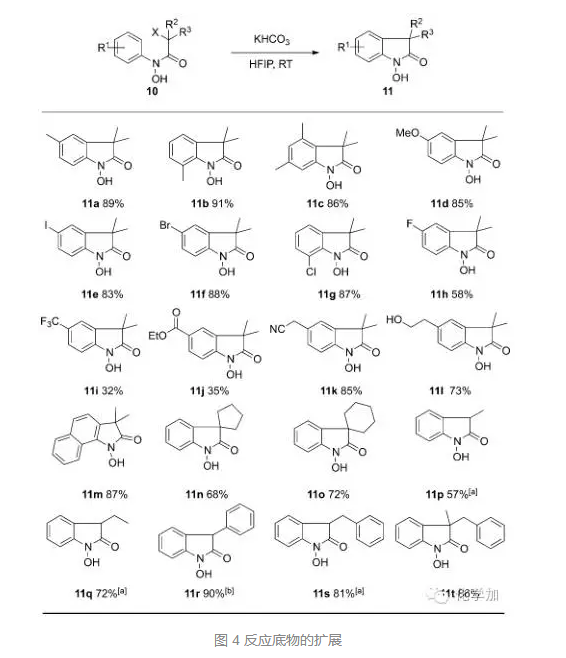
接着,作者对底物进行了扩展,当α-卤代为溴代时,室温反应5小时,都能取得理想的结果,苯环上取代基为卤素、氰基、酯基、羟基等都可以兼容,当苯环上取代基为三氟甲基或者酯基时,产率降低。当α-卤代酸α-位带有双烷基取代时,反应5小时,当为单取代时,需要12小时,当α-卤代酸为氯代时,反应时间也需要延长至12小时。
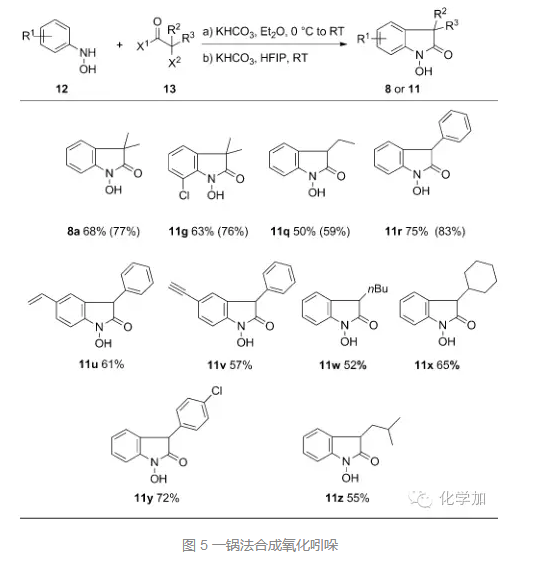
作者还尝试了从羟基苯胺和酰氯或者酰溴出发,一锅法先形成酰胺接着形成氧化吲哚,也取得了优秀的结果。先把底物和碱混合在乙醚中反应,旋蒸掉乙醚,不用处理接着加入KHCO3和HFIP,再反应5小时,就可以一锅法高效合成氧化吲哚。操作简便,产率优良,非常高效。
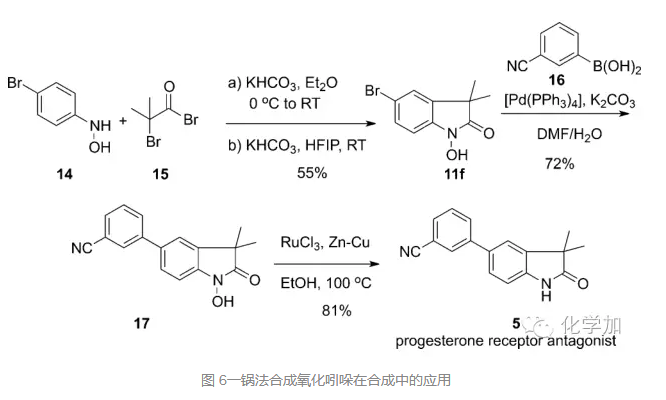
接着,作者也把该方法用于了孕激素受体拮抗剂的合成中,从羟基苯胺14和溴代酰溴15出发,一锅法合成氧化吲哚11f,接着和芳基硼酸化合物16发生Suzuki偶联反应得到化合物17,除去氮上羟基保护基,就可以高效地完成目标分子5。
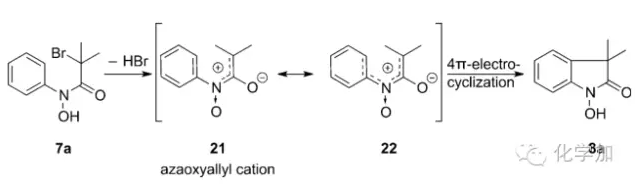
作者也根据实验结果提出了反应可能的机理:苯胺的酰胺底物7a失去溴化氢后形成氮杂氧化烯丙基阳离子中间体21,电子离域形成更稳定的中间体22,4Π电环化关环得到目标产物8a。中间体22的形成也就可以说明为什么苯环上带有给电子基比吸电子基如三氟甲基、酯基的底物产率高了,而六氟异丙醇溶剂则可以和22中的氧负形成氢键有利于反应的进行。
总结
廖学斌课题组报道了仅仅利用廉价的碳酸氢钾作碱,六氟异丙醇作溶剂,在室温下高效合成氧化吲哚结构的反应,由于碳酸氢钾的碱性非常弱,官能团兼容性非常高。同时,该反应底物廉价易得,还可以通过一锅法实现,他们也将该方法应用到孕激素受体拮抗剂的合成中。由于该反应条件温和,操作简单,在制药工业中将会有广泛的应用前景。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn