


单萜类吲哚生物碱由于其多样性的结构和广泛的生物活性而备受有机化学家和生物学家关注,如图1所示,就是四个代表性的吲哚生物碱。其结构不同之处在于(-)-Goniomitine和其它三个分子相比,C21位缩醛胺结构的不同以及C7位残留的2-羟基乙基取代基。
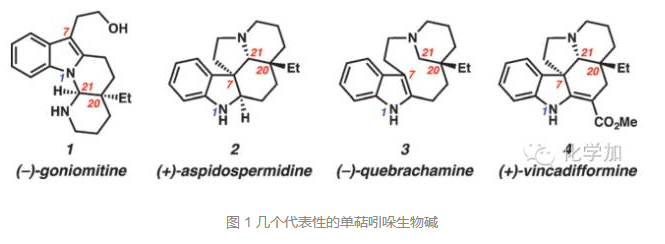
这些化合物可能的生源转化途径是:(+)-vincadifformine 先氧化再水解接着脱去酯基得到四环中间体,碎裂化反应得到吲哚2-位2C单位连接的带有环状亚胺的色醇化合物。如图2B所示,当吲哚3-位为氢时,可以经由傅克反应形成碳碳键,而当吲哚3-位不是氢时,吲哚氮进攻亚胺形成碳氮键。基于生源合成假设,要合成这些天然产物,关键是合成亚胺中间体5, 5可以由化合物8发生形式上的反马氏氢胺化反应得到,而8可以由吲哚酮化合物9在3-位发生交叉偶联反应,在羰基α-位不对称烷基化反应合成。
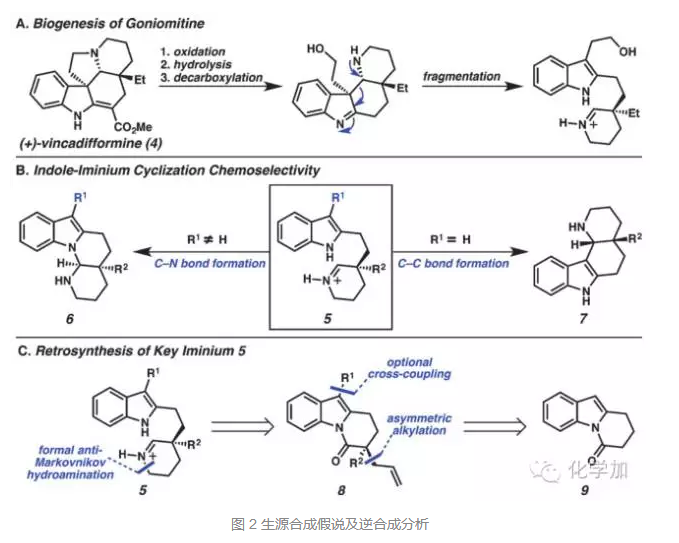
钯催化的羰基α-位不对称烷基化反应是Stoltz课题组一直在研究的内容,也是他们课题组的拿手好戏。快速合成化合物13以后,就是通过条件筛选,对于羰基α-位不对称烷基化反应的尝试,作者发现,当吲哚3-位为溴时,在5 mol%的钯催化剂Pd2(pmdba)3和L1配体作用下,叔丁基甲基醚TBME作溶剂,可以83%的收率和96%的ee值得到相应的产物14。
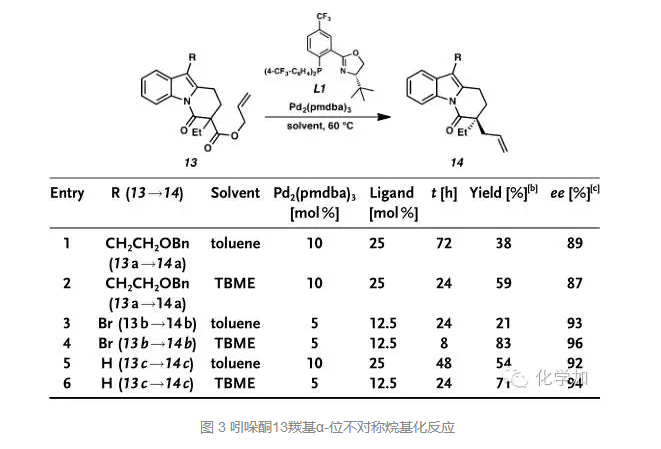
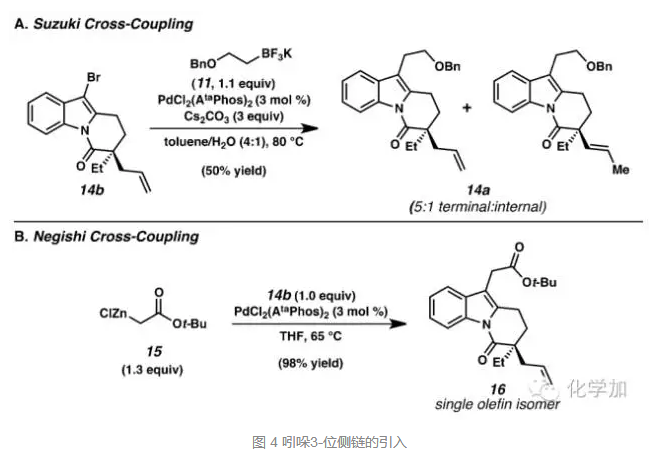
拿到化合物14以后,就是尝试通过过渡金属催化的交叉偶联反应在吲哚的3-位引入烷基侧链,当在Suzuki反应条件下时,只以50%的收率得到了目标产物14a和其中双键移位的产物,选用Negishi交叉偶联,14b和锌试剂15发生反应,能以98%的收率得到目标产物16。
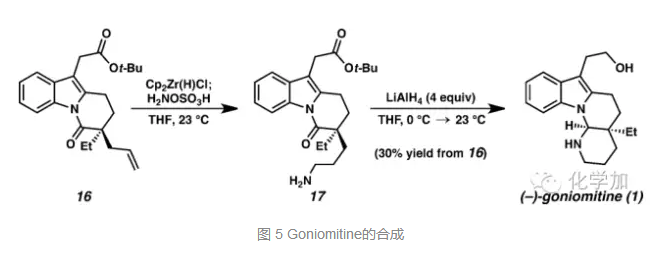
从化合物16出发,先在锆催化剂作用下发生反马氏的氢胺化反应得到17,接着氢化铝锂还原酯基到一级羟基同时还原胺化得到目标分子(-)-Goniomitine。
而从重要中间体14c出发,经由文献中报道的方法,分别经6步和4步就可以完成(+)Aspidospermidine和 (-)-Quebrachamine的形式不对称全合成。
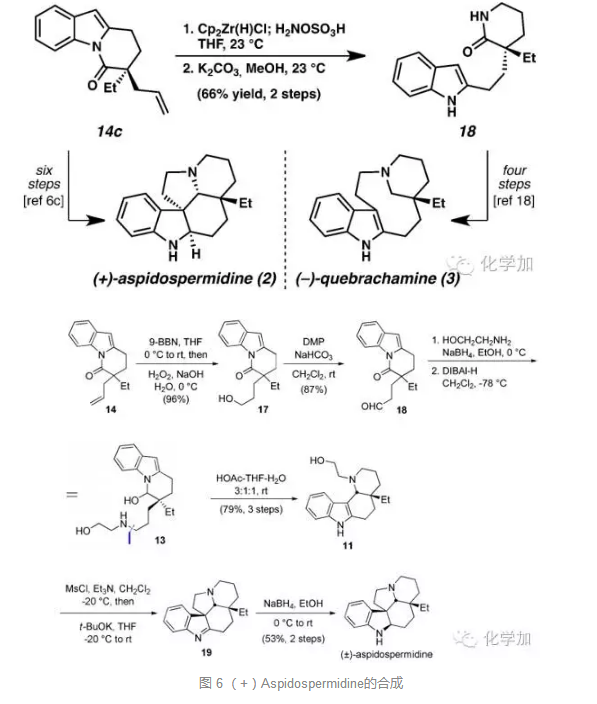
如图6所示,从化合物14出发,经硼氢化氧化、DMP氧化得到醛化合物18,还原胺化得到化合物13,酸性条件下经半胺醛开环/醛胺缩合成亚胺/傅克反应得到四环化合物11,再经由取代、傅克反应成环,最后还原亚胺得到天然产物Aspidospermidine。
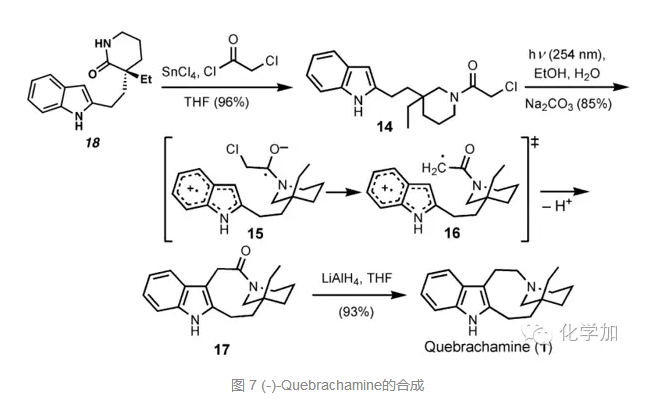
从化合物18出发,如图7所示,先和氯乙酰氯反应形成酰胺化合物14,光照条件下经自由基反应关环成化合物17,氢化铝锂还原酰胺到胺得到目标分子(-)-Quebrachamine。
总结
B.M.Stoltz课题组利用自己发展的钯催化烯丙基烷基化反应高效构建了吲哚酮中的季碳,并以此为关键步骤简洁高效地完成了单萜吲哚生物碱(-)-Goniomitine的全合成, 同时完成了另外两个生物碱(+ )-Aspidospermidine和 (-)-Quebrachamine的形式不对称合成,都在10步以内,这为其它单萜吲哚生物碱的合成具有重要的借鉴意义。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn