

Peganumine A是2014年分离得到的一个二聚四氢-β-咔啉生物碱。其具有非常新颖、较为复杂的八环结构,其中核心结构为3,9-二氮四环[6.5.2.01,9. 03,8]十五-2-酮结构单元。它同时还展现出对MCF-7,PC-3,HepG2细胞很好的细胞毒活性,并对HL-60有选择性影响(IC50 = 5.8 μM)。但其极低的分离产率为进一步的生物活性研究带来了困难。从其生源合成来看,Peganumine A极有可能是由色胺衍生的两个C1取代的β-咔啉A和B通过螺环化及后续的内酰胺化得到(如图一)。尽管这种生源转化不无可能,但是在实验室中实现这种[3+2]杂螺环化过程却有一定的困难。
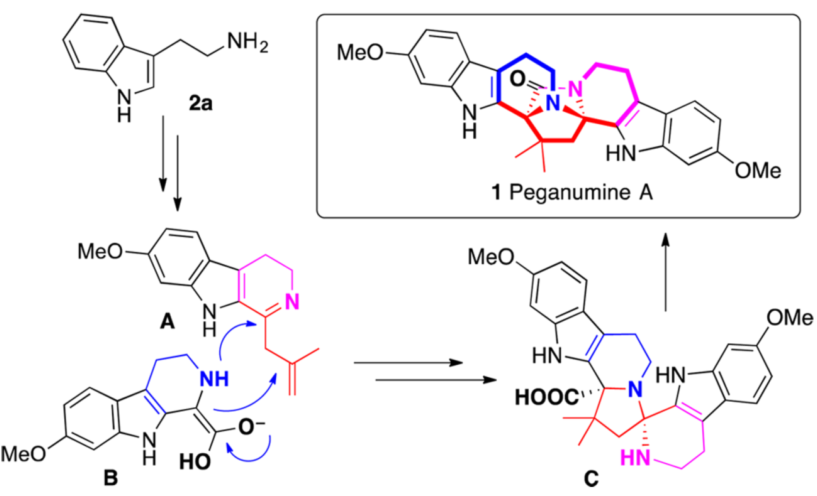
图一 Peganumine A 及其可能的生源合成
就Peganumine A的化学合成而言,核心工作是对四环结构D的合成。因为该结构的构筑将实现两个四氢-β-咔啉的连接,从而搭建起2,7-二氮双环[2.2.1]庚-3-酮核心单元。同时,Peganumine A中的两个立体季碳中心也在此结构上。因而作者提出了图二所示反合成分析。D中醛缩胺结构可以由E中仲胺对N-酰基亚胺盐加成得到。而E又与烯胺F互为平衡。进一步反合成分析可知,F可以由带有亲核位点的胺G和α-酮酰胺H缩合得到。这样的反合成后,作者认为可以通过“一锅”的串联反应操作由G和H直接合成D。在此过程中,Ca处通过Pictet-Spengler反应建立的立体化学,将会完全传导至Cb处,进而建立起Peganumine A中的两个季碳立体中心。
因此,通过催化不对称Pictet-Spengler反应将会使潜手性合成砌块G和H转化为光学纯的目标化合物D。化合物H可以由δ-氧代-α-酮内酰胺I通过跨环环化而成。最后化合物I可以由线性ω-氨基-δ-氧代-α-酮酸J通过传统的策略制备(a断裂方式)。但是作者在此处也提出了由ω-异腈基-γ-氧代醛K通过分子内Passerini反应或Ugi反应制备I的策略(b断裂方式)。这样的逆推策略较为少见,因而它也为探索异腈在合成化学中的应用提供了新的机遇。
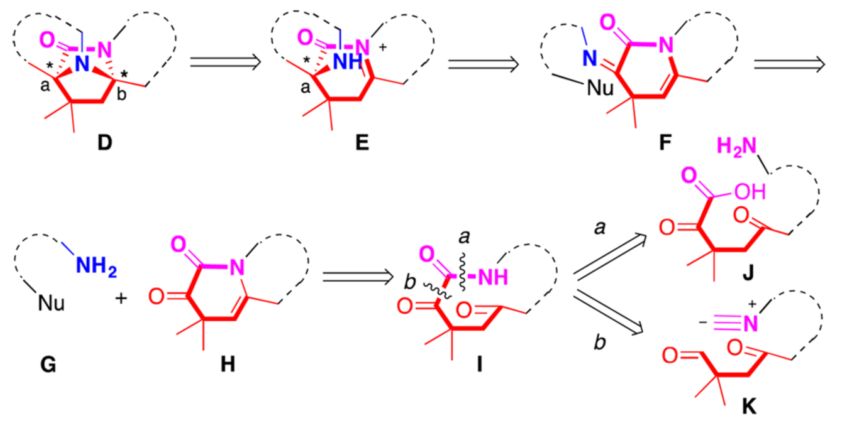
图二 peganumine A核心结构的反合成分析
作者具体的合成过程如下:首先是不同色胺衍生物的制备(如图三)。作者先从化合物3出发,将其转化成三氟甲酸混酐后,在苯硫酚的作用下制备得到苯硫酚酯4。再将产物4进行臭氧化得到醛5。同时,作者也选择了色胺作为模板反应。他们先将色胺在甲酸乙脂作用下甲酰化,然后用Boc保护吲哚环上的活性氮。随后使用原位制备的四甲基哌啶锂实现吲哚环2-位的锂化。此类烯基锂化物与三丁基锡氯交换得到锡化物7a。
至此,作者已经制备得到了Liebeskind-Srogl交叉偶联的前体化合物,但是在经典的Liebeskind-Srogl交叉偶联条件下7a和5却并未发生偶联。于是通过系统的条件筛选,作者最后发现使用Pd2dba3,CuDPP,AsPh3条件就可顺利得到理想的偶联产物8a。
 图三 C2酰基化的色胺衍生物的合成
图三 C2酰基化的色胺衍生物的合成
得到8a后,在POCl3作用下先对其脱水制备得到b断裂策略所设计的异腈9a。随后9a在三氟乙酸促进下发生Passerini 3-中心-2-组分的串联反应直接得到四环中间体10a。再利用Corey-Kim氧化就能将10a有效的氧化得到α-酮酰胺13a(如图四)。在顺利的实现了模板反应后,作者又从6-甲氧基色胺2b出发,利用相同的合成过程实现了α-酮酰胺13b的合成(如图三和图四)。
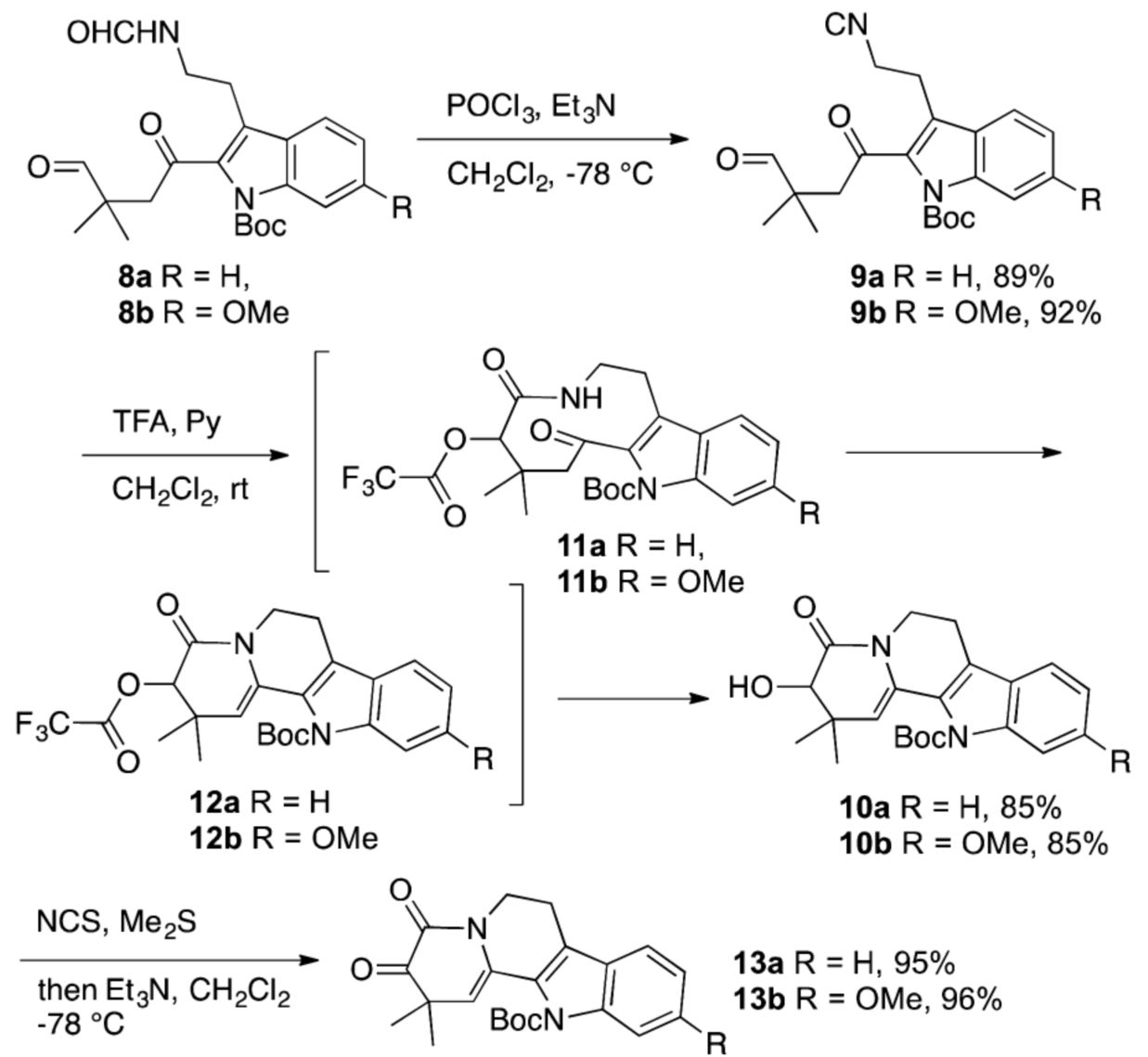
图四 通过Passerini 3-中心-2-组分反应合成四环α-酮酰胺13
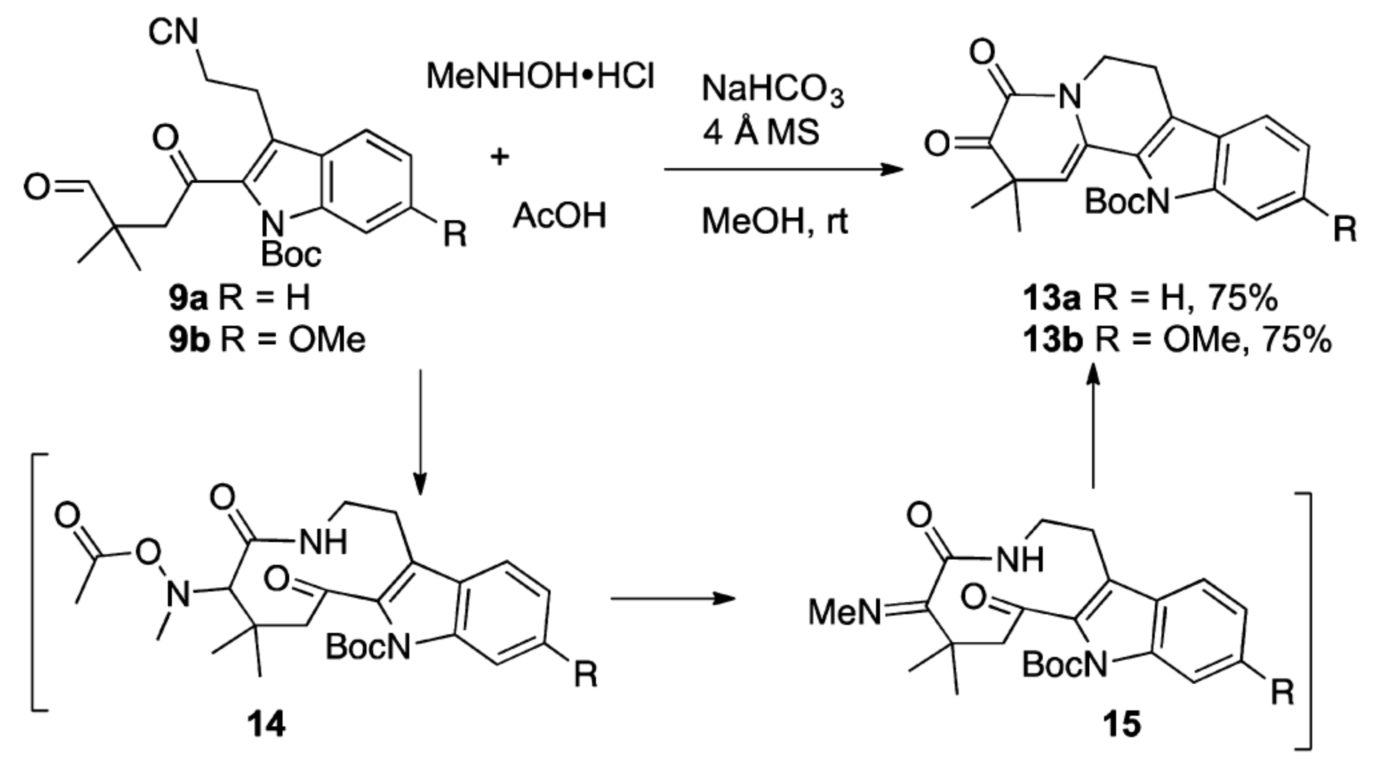 图五 从异腈9“一锅”制备四环α-酮酰胺13
图五 从异腈9“一锅”制备四环α-酮酰胺13
在成功利用Passerini 3-中心-2组分反应制备化合物13基础上,作者又利用Uig 4-中心-3-组分的策略,通过一个氧化还原过程从异腈9出发,更为高效的合成了化合物13(如图五)。接下来作者尝试了色胺2b和四环α-酮酰胺13的缩合,TFA催化的Pictet-Spengler及串联的环化、脱保护反应。通过实验,作者分别顺利的得到Peganumine A及(±)-9’- demethoxy-Peganumine A(如图六)。
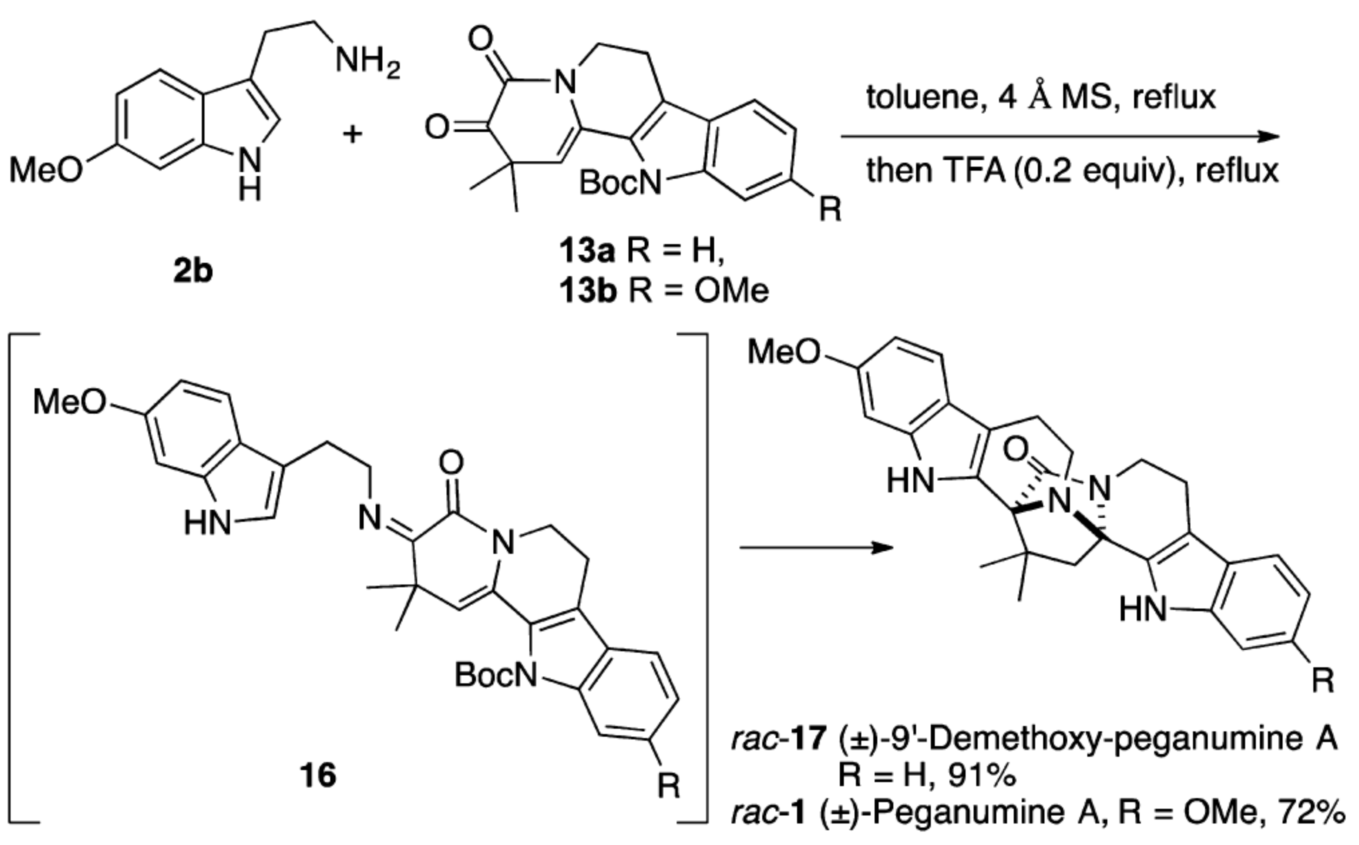 图六 (±)-Peganumine A 及其类似物的合成
图六 (±)-Peganumine A 及其类似物的合成
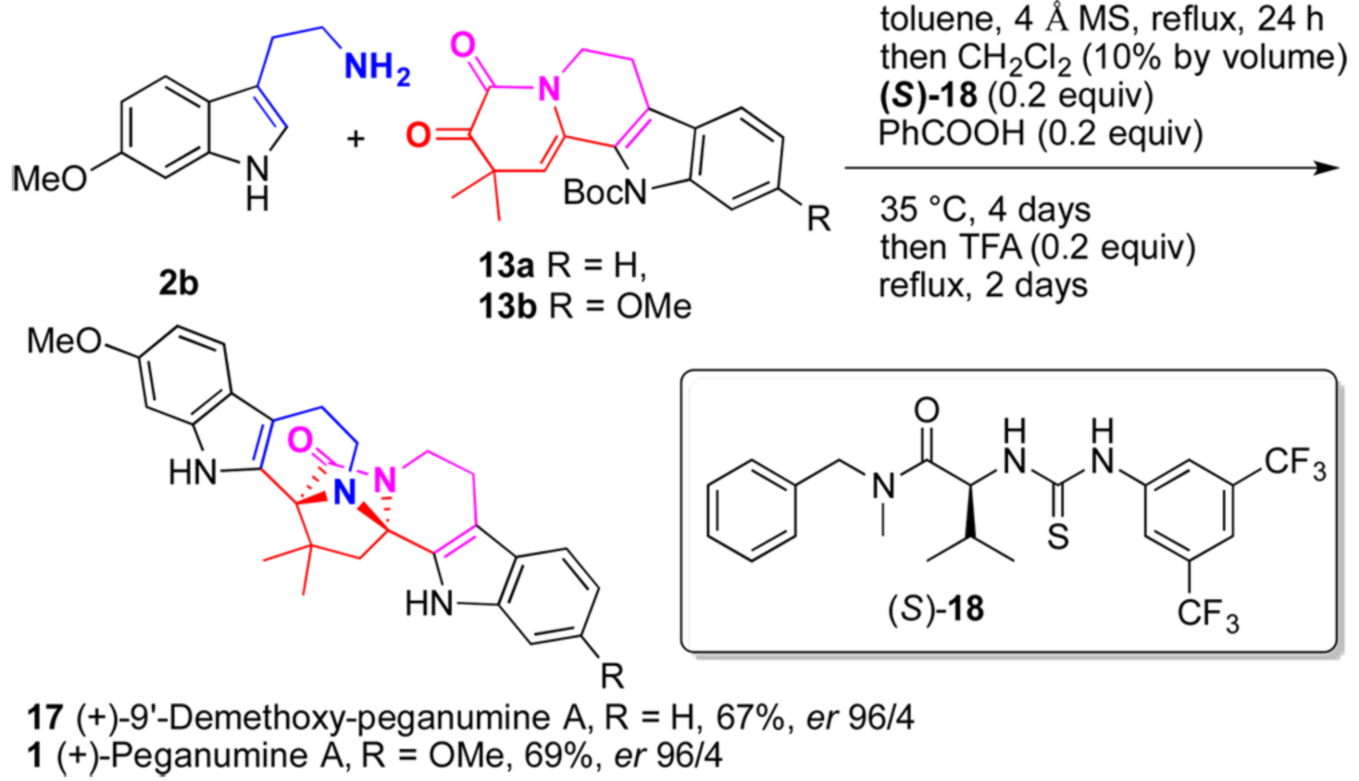
图七 硫脲催化下对映选择性合成(+)-Peganumine A
通过以上合成过程作者已经顺利的实现了其起初设计的绝大多数策略,所欠缺的是手性中心的构筑。在上述工作的基础上,利用手性酸实现不对称的合成应是水到渠成。但是当作者使用手性磷酸TRIP去催化2b和13a的反应时却只得到产率与ee值极低的9’-demethoxy-Peganumine A。随后,作者计划使用Jacobsen’s手性硫脲进行尝试。尽管该类手性硫脲还没有被用于不对称的Pictet-Spengler反应,但是作者还是选择了该催化剂进行尝试。经过了系统的条件筛选后,作者最终顺利的实现了Jacobsen’s 手性硫脲(S)-18和苯甲酸催化下2b与13的偶联及不对称的Pictet-Spengler反应。接着“一锅法”在三氟乙酸催化下发生串联的跨环环化和脱保护过程,最终实现了对(+)-9’-demethoxy-Peganumine A 和(+)-Peganumine A的全合成。
该串联过程以较好的产率及高对映选择性得到了(+)-9’-demethoxy-Peganumine A 和(+)-Peganumine A(如图七)。最后,作者也尝试了克级规模的制备,也以相当的产率及对映选择性得到了相应的目标化合物。
总结
祝介平课题组设计了一条高效、简洁的合成路线,实现了对(+)-Peganumine A的不对称全合成。该合成过程线性最长步骤为7步,总产率达到33%,ee值高达92%。整个合成过程两个亮点为:利用Uig 4-中心-3组分氧化偶联高效制备四环α-酮酰胺中间体;手性硫脲与苯甲酸共同催化下实现潜手性底物的偶联及不对称Pictet-Spengler反应,同时“一锅法”条件下串联的三氟乙酸催化的跨环环化及脱保护完成Peganumine A的合成。克级规模的制备也为该化合物及类似物后续的构效关系研究提供了充足的样品。该合成过程中作者熟练的应用多组分反应及串联反应,为高效、简洁的进行天然产物全合成提供了很好的范例。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn