

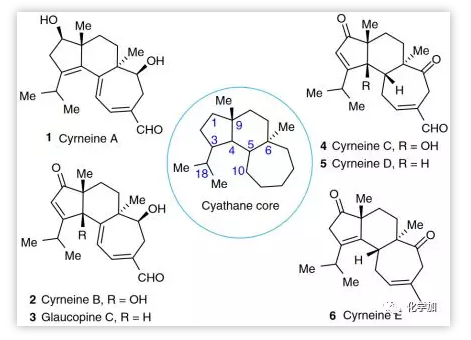
逆合成分析(Figure 2所示):作者设想5-6-7三环核心骨架A可以作为发散性合成的高级中间体。合成Cyrneine A(1)和中间体B的关键挑战是在A中C14位羰基的β面选择性还原。Glaucopine C(3)和Cyrineine B(2)由化合物C经C4位1,3-质子迁移和γ-氧化生成,中间体A可经5-6-6三环D扩环得到,C6位季碳手性中心可经三环酮E中Brich还原甲基化反应构建,关键三环体系F的构建可以由醛G的分子内傅克反应实现,其将由多取代未活化乙烯基三氟甲磺酸酯H的Suzuki-Miyaura交叉偶联合成,H可简化为五元环酮I,其可由2,2-二取代的1,3-环戊二酮发生不对称还原制备。
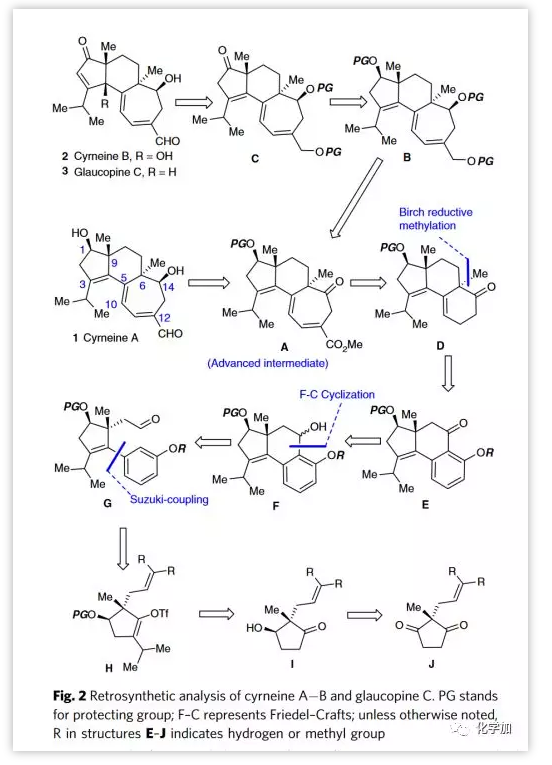
合成cyrneine A的路线从环戊烯基三氟甲磺酸酯15a的不对称合成开始(Figure 3)。简单易得的2-甲基1,3-环戊二酮7与烯丙基溴8或9进行烯丙基化并以较高收率分别得到2,2-二取代的环戊二酮10和11。利用面包酵母酶不对称还原二酮11,反应能以高达99% ee值,25:1的dr比得到非对映异构体12。接着在Mitsunobu条件下顺利将12中α-羟基的构型翻转,得到目标β-羟基中间体13。其中β-羟基经TBS保护,随后用iPrI进行碱介导的异丙基化以两步80%收率形成酮14。随后用LiHMDS和PhNTf2处理14得到烯醇三氟甲磺酸酯15a。
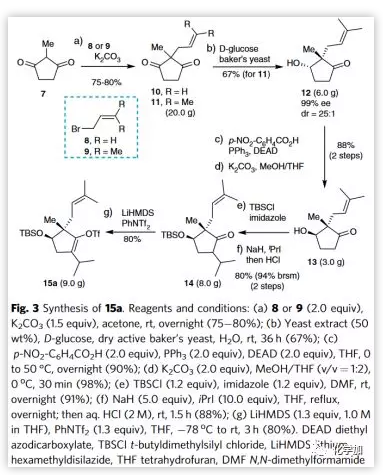
空间拥挤的非活化烯醇化底物的Suzuki-Miyaura偶联反应相对较少,作者经一系列条件筛选对三氟甲磺酸酯15a与16a的偶联反应进行了初步探索(Table 1),结果发现大部分反应效率较低并仅以低收率得到偶联产物17a(entries 1−6)。令人高兴的是,作者发现环钯18对连有大位阻TBS保护基的底物15a显示出高催化活性,反应在室温下能以定量产率获得偶联产物17a。重要的是,该反应可以同样收率扩大到数克级规模。
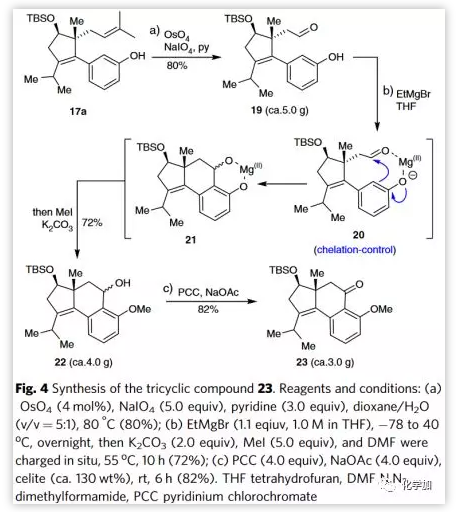
得到大量的17a后,作者继续探索了5-6-6三环体系23的构建(Figure 4)。17a中双键经氧化裂解生成醛19。用EtMgBr处理19生成酚镁盐。Mg(II)离子可以充当路易斯酸与醛配位,通过螯合控制形成中间体20。因此,傅克反应仅在酚羟基的邻位进行,得到三环产物21。在酚羟基原位选择性甲基化得到单一区域异构体三环醇22,收率为64-72%。三环醇22经PCC氧化顺利地得到相应的酮23。
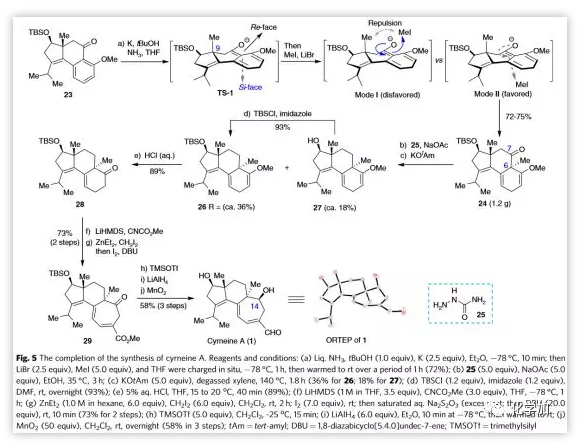
接下来,作者继续向前探索以合成cyrneine A(1)。作者试图经Brich还原的甲基化反应在化合物23的C6位引入甲基(Figure 5)。经过仔细地筛选和条件优化后,作者发现根据Narisada和Gibbard早期报道的方法可以成功插入角甲基,并能克级规模地得到单一非对映异构体产物24,收率为72-75%。其优异的立体选择性大概归因于C9位甲基的空间位阻促使TS-1阴离子对MeI的亲核攻击从位阻较小的si-面进行(如mode I与mode II所示)。考察大量条件后,作者发现24与氨基脲25反应得到缩氨基脲,随后在二甲苯中用KOtAm处理即能得到产物26和脱甲硅基27,27再硅基化可进一步转化为26。26中乙烯基醚水解产生酮28,由于其在空气中容易氧化,因此其不经纯化就进行了扩环反应。酮28经酰化,随后一锅法锌-卡宾扩环,碘促进的消除反应,共两步反应即可生成29,收率为73%。最后,七元环29经脱TBS保护,还原酮和酯以及选择性氧化烯丙基伯醇以三步58%的收率实现cyrneine A(1)的全合成。值得注意的是,C14酮的还原高度立体选择性地得到β-OH产物。
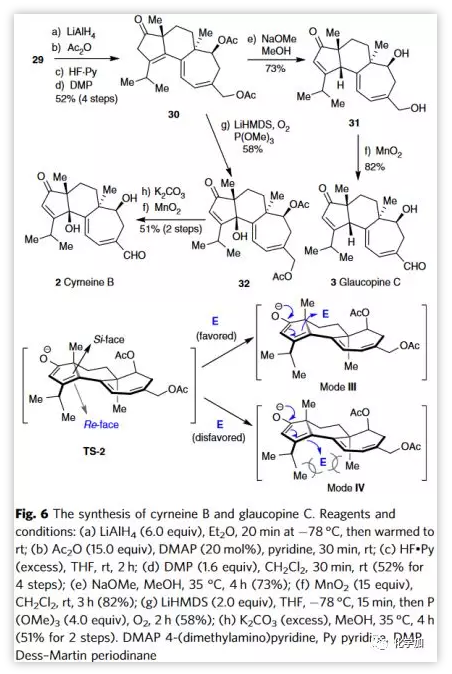
成功合成cyrneine A后,作者继续完成了cyrneine B(2)和Glaucopine C(3)的全合成(Figure 6)。基于逆合成设计,中间体29经四步常规转化生成β,γ-烯酮30。经优化反应顺序和条件,作者发现在NaOMe的作用下,30经1,3-质子转移并同时脱乙酰基保护能顺利得到热力学优选的烯酮31,且C4位β-H为单一立体异构体。其优异的立体选择性可能原因为TS-2的re-面和si-面之间空间位阻的差异。因此,烯醇化物阴离子更倾向于从较不饱和的si-面接近亲电子试剂而不是位阻较大的re面(即,mode III和IV)。随后,烯丙基伯醇经选择性氧化生成GlaucopineC(3)。30可经碱介导的质子转移和γ-C-H氧化串联反应引入C4位β-羟基。通过条件筛选,作者发现在O2氛围下,将温度降至-78 ℃, LiHMDS作碱处理30可以58%的收率得到32。最后,脱去乙酰基,随后选择性氧化烯丙醇形成cyrneine B(2)。
总结:韩福社课题组发展了一条高效的合成路线,通过其可步骤经济的合成Cyrneine A(共 20步)并首次实现了Cyrneine B(共24步)和Glaucopine C(共23步)的全合成。该合成的特点为多取代未活化乙烯基三氟甲磺酸酯的高效Suzuki偶联,Mg(II)介导的Friedel-Crafts环化,Birch还原甲基化和锌卡宾介导的扩环等反应的应用。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn