

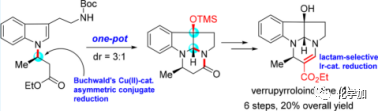
海洋生物如藻类、海绵和珊瑚等一直是人类发现具有药理活性化合物以及寻找新型药物的丰富来源。然而,从海洋中分离提取天然产物极具挑战性,并且获得的量极少,极大地阻碍了相关药物的开发研究。在这种情况下,化学全合成便成为获取海洋天然产物的重要工具。 Verrupyrroloindoline(1)是由严鹏程、Gustafson及其同事于2016年从中国南海软珊瑚Sinularia verruca中分离得到的一种吡咯并二氢吲哚类生物碱(Figure 1)。该化合物7S*,10S*,11S*的相对构型是通过NOESY确定的,旋光为{[α]D25= -22(c=0.06,CHCl3)},但其绝对构型尚未确定。其结构特征在于含有吡咯并二氢吲哚单元和烯胺基部分的2a,5a-二氮杂环戊烷[jk]芴母核,是一种罕见的天然生物碱类,后续Müller及其同事也报道了具有相似骨架的生物碱[crocagins A(2), B(3)]。
Verrupyrroloindoline(1)逆合成分析如下(Scheme 1):
通过选择性还原β-乙氧基内酰胺4产生特征性的烯氨基酯部分,其前体5可以通过吡咯并二氢吲哚6的分子内酰胺化来构建,而6可由手性色胺衍生物7通过“一锅法”串联吲哚环氧化/环氧开环环化策略获得。吲哚衍生物7中的手性侧链可以通过N-Boc色胺9与β-碘代烯酸酯10偶联,然后进行Buchwald开发的Cu(II)催化的不对称共轭还原引入。

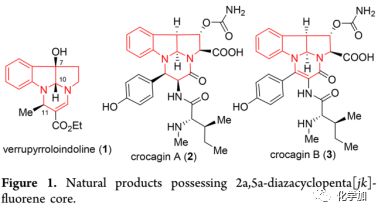
手性侧链的引入以及吡咯并二氢吲哚的构建(Scheme 2):
首先,将N-Boc保护的色胺9与β-碘烯醇化物10进行Buchwald偶联以89%的产率得到化合物8,若将该反应温度升至80 ℃并反应16小时,产率可提高至98%。按照Buchwald报道的催化不对称氢化铜还原操作将8进行共轭还原以90%的产率(90%,ee)得到7。然后利用二甲基过氧化酮(DMDO)引发的氧化环化策略构建吡咯并-[2,3-b]吲哚环,即在丙酮中用DMDO处理7以90%的产率得到两种不可分离的非对映异构体6和11,由于C-N酰胺键旋转受限,未能通过核磁确定二者的比率。
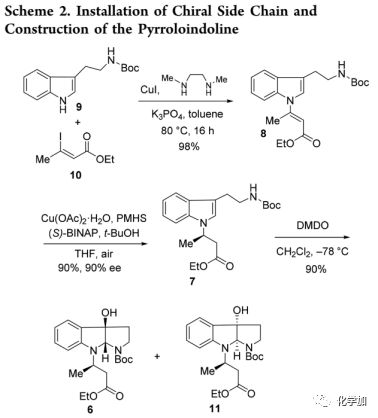
接下来,由于未能成功用TFA实现脱Boc,所以设想了一种替代方法:N-Boc裂解,嘧啶环形成和羟基的TMS保护(Scheme 3)。首先尝试加大DIPEA用量(145当量)利用TMSOTf/DIPEA进行反应的实验以失败告终;当将DIPEA的量减少至3.0当量时,以80%的产率得到四种异构体12-15(45:20:7:28)。为了促进环化过程,作者尝试了更强的碱,用TMSOTf/2,6-lutidine处理6和11的非对映异构体混合物以60%的产率得到两种可分离的非对映异构体12和14(dr = 2.4:1)。通过X射线衍射确定主要异构体12的绝对构型和立体化学为7R,10S,11R。结果表明在(S)-BINAP存在下,利用Buchwald的催化不对称氢化铜还原处理8可产生R-构型[(R)-7]。同时还揭示了verrupyrroloindoline(1)中14-Me,H10,7-OTMS之间的顺联关系。中间体14中14-Me,H10/7-OTMS的相对构型通过NOESY确证,并可以推导出次要异构体14的绝对构型(7S,10R,11R)。
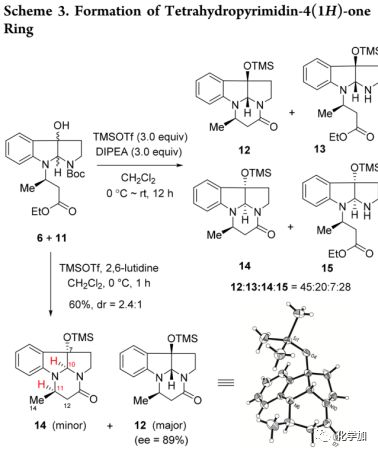
为了提高合成效率,作者设想了 “一锅法”的合成方法,包括氧化环化,N-Boc裂解,再次环化和TMS保护(Scheme 4)。将化合物7用DMDO在-78 ℃下处理30分钟,然后真空浓缩,并在0 ℃下向所得混合物中加入TMSOTf/2,6-lutidine反应1 h,以58%的收率得到12和14的混合物(dr, 3:1)。然后通过LDA去质子化形成烯醇化物与氯甲酸乙酯反应引入C12位乙氧羰基得到16(80%),作为单一非对映异构体,通过NOESY效应判定11,12-反式结构。

在得到16后,作者尝试将分子中1,3-二羰基转化为烯胺酯结构(Scheme 5),这样在酯基存在下可以降低对反应性较低的内酰胺的还原。据文献报道,利用[IrCl(CO)(PPh3)2]/TMDS或[Mo(CO)6]/TMDS体系可以将脂肪族叔酰胺直接还原成烯胺。因此,作者尝试利用Ir-催化的还原反应将β-乙氧羧基内酰胺16进行还原得到烯胺酯,但利用[IrCl(CO)(PPh3)2(1 mol%), 四甲基二硅氮烷(TMDS,2.0 equiv), toluene, rt]时底物几乎未反应,只得到痕量的还原产物17;随后将催化剂的量增加至20 mol%时,产率显着提高至45%,但转化率为60%;进一步将TMDS的当量增加到4.0 equiv后以75%的收率得到17。
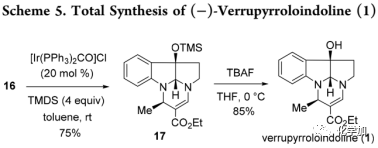
最后,脱去TMS保护基得到verrupyrroloindoline(1)(cheme 5),其光谱数据与报道的天然产物的数据相匹配。然而,1的旋光度值显示出比天然产物报道的数据更高的值{[α]D25=-631 (c=1.0, CHCl3) vs [α]D25= -22 (c=0.06, CHCl3) },该差异可能是由于分离的天然样品中存在的杂质所导致,而用于测量比旋光度样品量很小(0.6mg)或部分外消旋化。实际上,verrupyrroloindoline可能是一种对酸不稳定的天然产物,脱保护步骤用NH4Cl水溶液淬灭反应时会产生了一些未知的产物。但是,通过12的X射线衍射结果可以明确地确定verrupyrroloindoline(1)的绝对构型为7R,10R,11R。
小结:黄培强课题组利用简洁高效的合成路线(6步20%总产率)完成了(-)-verrupyrroloindoline的首次不对称全合成。其合成亮点在于:(1)利用Buchwald Cu(II)催化的不对称共轭还原构建第一个手性碳;(2)通过DMDO引发的“一锅法”四步串联反应构建2a,5a-二氮杂环戊烷[jk]芴核;(3)利用Ir催化的直接化学选择性还原β-乙氧羰基叔内酰胺得到烯胺酯。通过这种对映选择性全合成,判定天然产物(-)-verrupyrroloindoline(1
黄培强教授主页:http://chem.xmu.edu.cn/teacher.asp?id=278
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn