

Gelsemium属植物在传统的亚洲医学中已被广泛用于治疗皮肤溃疡、皮炎等各种疾病。目前,科研人员已从Gelsemium植物中分离出一系列结构多样的生物碱,其中一些生物碱具有良好的生物活性,包括镇痛、抗炎和免疫调节以及强效抗肿瘤活性。在已知的五种类别的Gelsemium生物碱中,有三个亚家族具有共同的螺-吲哚啉酮骨架,即gelsemine型、humantenine型和gelsedine型生物碱(图1)。Gelsemium生物碱展示出的生物活性及其密集的多环结构已受到合成界的广泛关注。值得注意的是,尽管已有多种gelsemine的合成方法,但gelsedine型生物碱所受关注较少,迄今为止只有少数半合成和全合成的报道。
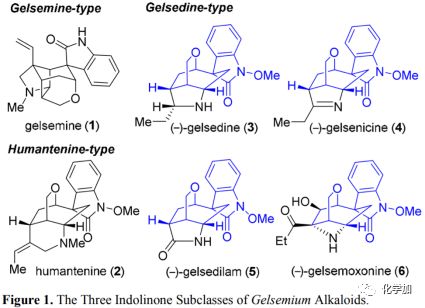
图1 三种吲哚酮类Gelsemium生物碱亚家族
从结构上看,gelsedine型生物碱具有共同的氧杂双环[3.2.2]壬烷核心和螺-N-甲氧基吲哚酮部分,以及嵌入紧凑骨架中的多种官能化杂环(如吡咯烷,吡咯啉,吡咯烷酮或氮杂环丁烷环)(3-6; 图1)。逆合成分析如图2所示:作者设想该天然产物的合成多样性可以由四环硝基化合物8或9经后期杂环化过程实现。具体而言,gelsemoxonine(6)可以由环氧化物7经过仿生环化衍生而来。同时,吡咯烷和吡咯啉有望通过乙酮8的分子内缩合和还原得到。同样,5中的吡咯烷酮核心骨架可以通过酯9中的硝基和烯烃的还原,以及随后的内酰胺化构建。化合物8或9可能来自中间体10中酮α位上的酰化,和随后的一系列官能团转化。10的氧杂双环[3.2.2]壬烷骨架可以由简化的氧杂二环[3.3.1]壬烷11经氧鎓离子诱导的频哪醇重排构建。11中吲哚酮部分的季碳手性中心可以经三环12的串联氧化/羟醛环化形成,其可由简单底物13和14经Michael加成得到。
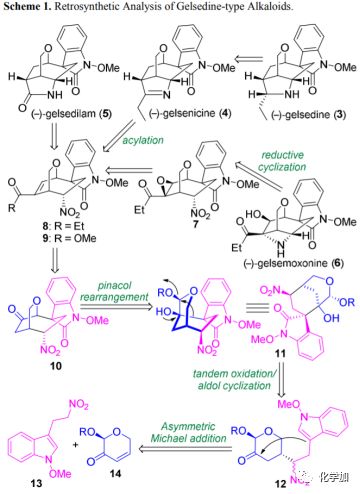
图2 逆合成分析
基于上述分析,作者首先探究了不对称Michael加成反应(图3)。作者以烯酮15(由L-阿拉伯糖经四步反应制备,dr值>98:2)作为Michael受体,以此获得有用的立体控制。经过大量试验筛选,作者发现无机碱能极大地促进吲哚片段13和二氢吡喃酮15的不对称Michael加成,在优化的条件下,以95%的收率制备目标产物16,其为1:1的非对映异构体混合物。随后,作者尝试通过连续的串联氧化和羟醛环化引入螺-N-甲氧基吲哚酮的季碳手性中心。作者认为关键的环化反应可能经历两个不同构型的过渡态(21a和21b)。过渡态21b中硝基和苯环之间具有较大的空间位阻,因而过渡态21a是更有利的,这将使得环化产物的构型与天然产物一致。此外,硝基和羟基之间稳定的氢键相互作用也有利于形成中间体21a。令人高兴的是,在N-氯琥珀酰亚胺和水的条件下,2-氯吲哚经水解形成羟吲哚,其同时经历羟醛环化专一地产生单一异构体氧杂二环[3.3.1]-壬烷17,产率为90%。值得注意的是,利用硅胶和三乙胺进行淬灭是硝基异构化后形成热力学更稳定的异构体17的关键。制备大量的17之后,作者继续探索了关键的pinacol重排反应,经过广泛的条件优化,最终发现17在氯化铝和甲苯/Et2O(10:1,v/v)的混合物中加热回流能以30 mmol规模一次性得到酮20(8.6 g),产率为86%。氯化铝/醚络合物使得该重排反应尤其高效,可能是由于其温和的路易斯酸性,单独使用氯化铝会导致17完全分解。

图3 关键中间体17和20的构建
以高效的方式快速构建了共同的四环骨架后,作者随即进行了(-)-gelsidilam的全合成(图4)。因此,20在KHMDS和Mander试剂(甲基氰基甲酸酯)作用下,在酮基的α-位引入羧甲氧基,产率为73%。接着,在三氟甲磺酸酐和Hünig碱的条件下将烯醇混合物23转化为相应的烯醇三氟甲磺酸酯24。随后利用Pd(PPh3)4和Et3SiH还原脱去三氟甲磺酸酯基团得到α,β-不饱和甲酯25。最后,酯25经硼氢化镍介导的烯烃和硝基还原,得到非环化中间体,其与硅胶在40 ℃下加热即可得到对映体富集的(-)-gelsidilam(5)。该合成路线以13和15为起始原料,只经7步就能以24%的收率得到(-)-gelsidilam(5)。
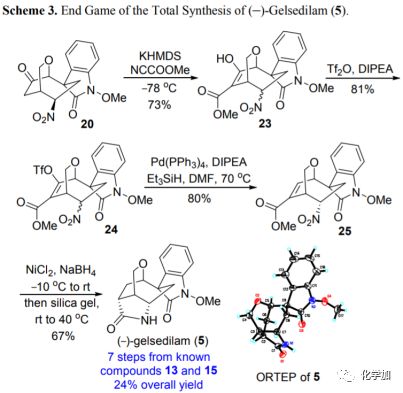
图4 (-)-gelsidilam的全合成
随后,作者以不同的后期杂环化反应实现(–)-gelsenicine(4)和(–)-gelsedine(3)的全合成(图5)。首先利用KHMDS和新蒸馏的丙酰氰处理20,然后1M HCl淬灭得到单一异构体的1,3-二酮26,产率为43~55%。接着作者利用合成gelsidilam过程中的两步得到目标α,β-不饱和乙基酮28,产率47%。随后低温下NiCl2和NaBH4选择性还原烯烃和硝基而不干扰酮羰基,从而得到(-)-gelsenicine(4)。之后按照先前的报道,在氢气氛围中利用Adam’s催化剂催化氢化4,顺利得到(-)-gelsedine(3)。

图5 发散性合成gelsedine生物碱
最后,作者将此发散合成策略拓展到(–)-gelsemoxonine(6)的全合成上。从关键中间体28开始,m-CPBA促使28进行立体选择性环氧化产生环氧化物29,产率为56%。随后用锌粉和乙酸还原硝基,然后进行仿生环化,得到(-)-gelsemoxonine(6),两步产率为78%。
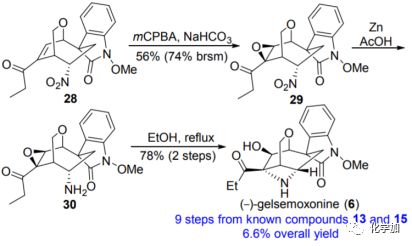
图6 (-)-gelsemoxonine的全合成
结语:马大为研究员课题组开发了一种发散式合成gelsedine型生物碱的策略,从已知片段13和15开始,分别以7-9步实现了(-)-gelsedilam,(-)-gelsedine,(-)-gelsenicine 和(-)-gelsemoxonine的全合成,整个过程中没有使用任何保护基。该合成路线的主要特点包括:不对称Michael加成和串联的氧化/羟醛环化反应引入螺-N-甲氧基吲哚酮的季碳手性中心,新颖的氧鎓离子诱导频哪醇重排构建共同的氧杂二环[3.2.2]壬烷核心,以及后期的杂环化反应。上述工作是目前合成gelsedine型生物碱的最短路线!
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn