

(图片来源:Nat. Commun.)
Shizukaol A (1)和E (2)(Fig. 1)是从Chloranthus japonicus中分离得到的二聚茚烷型倍半萜类化合物,该系列共有110多个化合物,一般都含有共同的七环骨架和10个以上连续的手性中心。其中,Shizukaol E (2)显示出潜在的对HIV-1和HCV复制的抑制活性,加之分子结构的特殊性,该类化合物引起了合成化学家们的极大兴趣。2017年,四川大学刘波课题组以串联的呋喃构建/烯烃异构化/Diels-Alder反应为关键步骤完成了二聚Shizukaol D (3)和Sarcandrolide J (4)的首次全合成。Shizukaol A (1) 的连接六元环通过逆Diels-Alder方式裂解为两种产物:二烯5和Chloranthalactone A (6)(Fig. 2),由此可以推测出二聚茚烷型家族化合物的生源合成假说,即通过5和6的酶促外型-Diels-Alder反应构建共同的连接六元环。基于以上假设,香港中文大学黄乃正院士团队彭小水教授课题组以外型-Diels-Alder反应为关键步骤构建了Shizukaol A (1)类化合物的七环骨架(Fig. 2),并在Nat. Commun.上报道了Shizukaols A (1)和E (2)的不对称全合成。

(图片来源:Nat. Commun.)
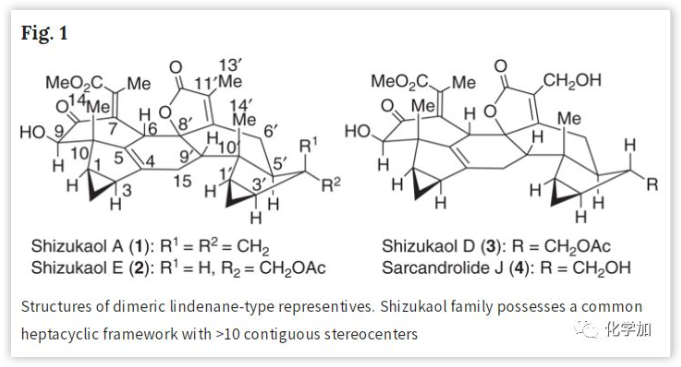
Shizukaols A (1)和E (2)的逆合成分析(Fig. 3):
基于前期通过外型-Diels-Alder反应构建金粟兰科家族化合物七环骨架的启发,作者考虑设计在生源上更接近5和6的前体以进一步转化。另外,Shizukaols A (1)和E (2)的结构揭示了连接的六元环和羟基酮酯片段是许多二聚茚烷型分子的共同结构特征。考虑到5的潜在不稳定性以及[4+2]环加成产物转化为Shizukaols A (1)的路线较长,作者认为在合成后期转化得到Shizukaols A (1)和E (2)的七环母核更为实用。此外,9中环氧片段不仅可以转化为Shizukaols A (1)和E (2)中的羟基酮酯片段,还可以防止相关链烯基部分的进一步[4+2]环加成。因此,基于以上考虑和生源假说,作者认为构建与Shizukaols A (1)和E (2)相关骨架的关键步骤是通过相关的过渡态将前体10和仿生环氧化物9转化为外型-Diels-Alder反应产物11,然后将环氧片段仿生转化为Shizukaol家族中常见的羟基酮酯,最终获得Shizukaols A (1)和E (2)。
(图片来源:Nat. Commun.)
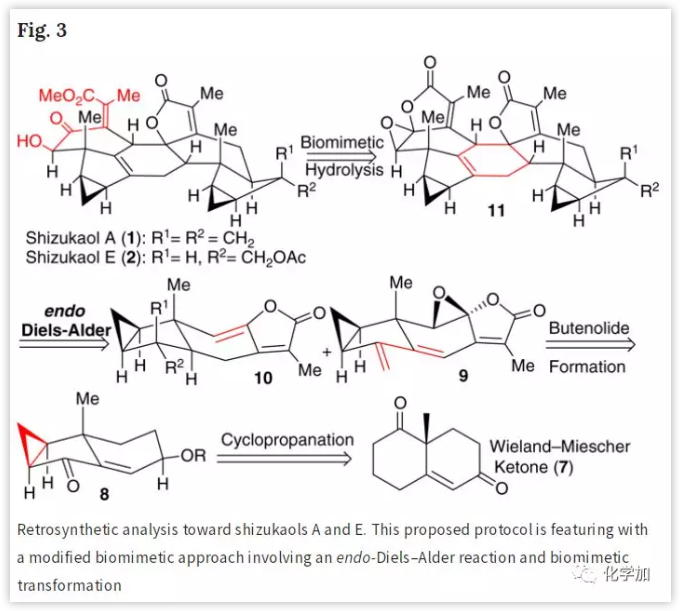
Shizukaols A和E的全合成:
首先,作者从已知的化合物12出发(Fig. 4),通过9-BBN处理得到比例为8:1 (α/β)的非对映异构体混合物,再脱保护得到醇13,其中α-羟甲基作为主要产物。为了鉴定其立体化学,将13衍生化得到化合物13a,其单晶X射线衍射分析显示13a中的α-羟甲基与其在Shizukaol E (2)中的取向一致。随后,经TBS保护后,与Bredereck试剂反应生成的二酮15,接着分别与市售的15a和15b进行Yamaguchi酯化得到易分离的16及其区域异构体16a的混合物。然后,用NaH处理16经分子内HWE反应得到所需的化合物17。
(图片来源:Nat. Commun.)
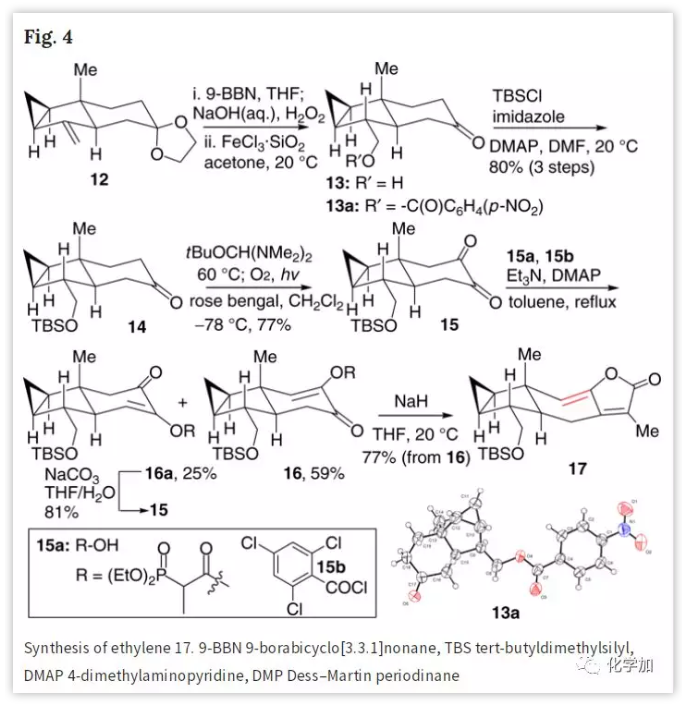
在得到烯烃化合物17后,作者将注意力转移到合成二烯23(Fig. 5)。烯酮18经双羟化、TBS区域选择性保护位阻小的仲醇得到酮19,与新制备的炔醇锂盐19a在温和条件下高度Z-选择性烯化,然后通过自发TBS迁移和内酯化生成丁烯酸内酯20,其结构和立体化学通过单晶X射线衍射分析予以确证。作者预测β-环氧化物更有利于后续转化(Fig. 3),但所有环氧化条件均未能直接从烯烃21形成β-环氧化物,也未能将α-环氧化物转化为β-环氧化物。因此,作者计划在合成后期改变其相关的立体化学,用m-CPBA对21进行环氧化得到α-环氧化物22,经Martin试剂脱水得到三烯23,23非常不稳定并易二聚;最后,作者发现化合物23的甲苯或二甲苯稀溶液相对稳定,在-20 ℃下储存没有明显的二聚或聚合。
(图片来源:Nat. Commun.)
接下来,作者研究了缺电子双烯体23与富电子亲双烯体17之间外型-Diels-Alder反应的可能性(Fig. 6)。在160 ℃下,化合物17和23进行外型-Diels-Alder反应得到单一异构体24。其中,将23的高稀释溶液非常缓慢地加入到17的回流稀溶液中可以避免二聚体副产物的产生。然后,24脱保护得到关键的醇化合物25,其结构通过单晶X射线衍射确证。醇25水解产生相应的二醇后,将其伯醇选择性乙酰化得到单乙酸酯26,再经Dess-Martin氧化,最终发现只有Zn(BH4)2才有一定的 β面选择性,最终得到C9-β-OH-shizukaol E (2),其NMR数据与文献报道的一致。相关的Diels-Alder反应与Zn(BH4)2还原时的β面的选择性也通过与宁波诺丁汉大学的唐本灿教授合作,从计算的角度进一步理解并支持了其反应历程。
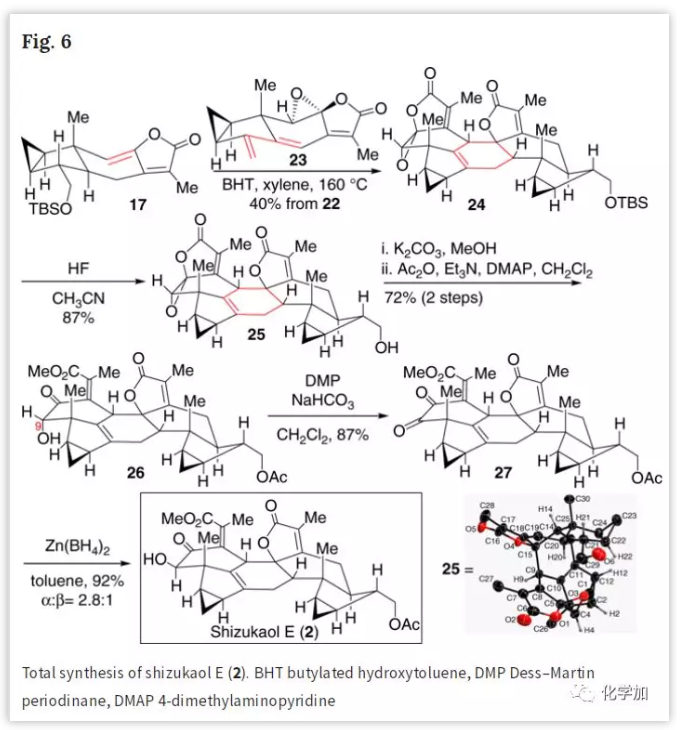
(图片来源:Nat. Commun.)
在完成Shizukaol E (2)的全合成后,作者将注意力转向Shizukaol A (1)的全合成(Fig. 7)。化合物12脱保护得到的酮经与14至15相似的转化得到二酮28。按照与上述类似的方法,28经区域选择性Yamaguchi酯化、分子内HWE烯化得到Chloranthalactone A (6)作为Diels-Alder反应的亲双烯体。在加热条件下,6和23反应得到所需的外型-Diels-Alder环加成产物29,经仿生水解、Dess-Martin氧化、Zn(BH4)2还原后,最终得到Shizukaol A (1)和醇30(α/β=4.6:1),其MS、IR和NMR数据与报道的完全一致。
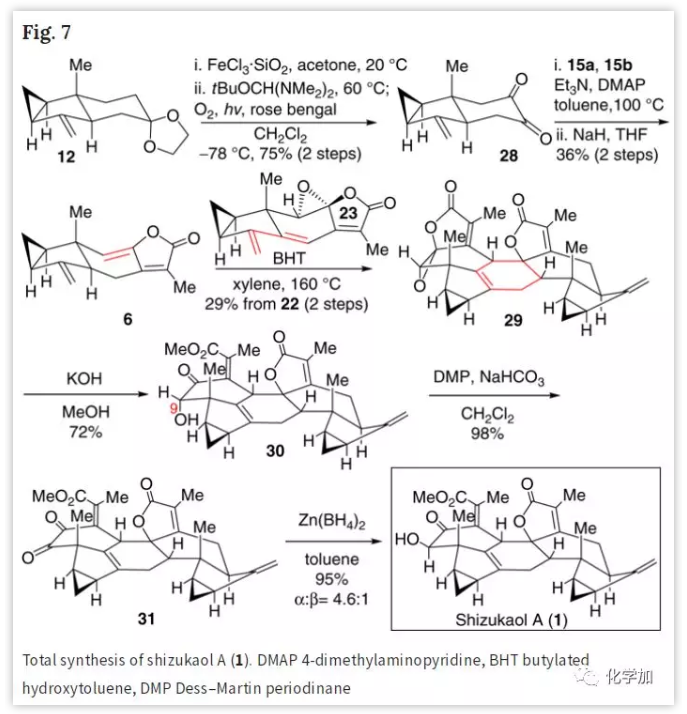
(图片来源:Nat. Commun.)
总结:香港中文大学黄乃正院士团队彭小水教授课题组通过模拟改良的生源途径,从商品化原料Wieland-Miescher酮(7)出发分别经过24步和28步反应完成了Shizukaols A (1)(总产率0.1%)和E (2)(总产率0.15%)的首次全合成。受Shizukaol家族的生源合成假说和热分解结果的启发,作者提出并验证了一种改进的涉及外型-Diels-Alder反应的仿生转化,该方法可用于合成金粟兰科中的其他成员以及其他潜在的先导化合物。
撰稿:爽爽的朝阳 校稿:诗路化语
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn