

连接两个芳环以制备联芳基的反应是制药工业中使用最广泛的方法之一。吡啶和二氮杂苯的偶联产生杂联芳烃,是商业药物以及许多治疗候选物中发现的特权药效团。这些杂环通常在药物-受体结合中起关键作用并赋予其他重要性质。最常想到的芳基-芳基偶联可以使用金属催化的交叉偶联反应来完成;这些过程具有出色的化学选择性,精确的区域选择性和足够的稳健性,可用于药物发现和制造。然而,相同的合成方法不适用于杂芳基杂芳基之间的偶联,特别是对于复杂的底物。因此,解决这种关键问题的方法将为杂联芳烃类药物的合成提供新的机会。
金属催化的交叉偶联反应至少需要三个步骤,并且在偶联步骤中存在一些挑战,例如催化剂中毒和原料分解等(图1B)。此外,药物分子和中间体通常具有多个反应位点和高比例的极性官能团,例如碱性的胺,其干扰催化过程并导致相当多的成分失效。另一个严重的问题是由于缺乏制备交叉偶联前体的方法。尽管简单的杂芳基卤化物是可商购的或可以直接制备,但在药物开发过程中遇到的吡啶和二氮杂苯衍生物的直接和选择性卤化仍然是未解决的挑战。类似地,合成亲核偶联配偶体如杂芳基硼酸,锡烷和有机锌或镁化合物也具有挑战性,并且它们通常由相应的杂芳基卤化物制备。杂芳烃的交叉脱氢偶联已显示出一些前景,但目前仅限于特定的吡啶组合,不适用于复杂结构。
首先,作者选用2-苯基吡啶作为模型底物进行条件筛选。在低温下与Tf2O结合,形成中间体吡啶三氟甲磺酸盐;加入可裂解的膦1(由二苯基膦和丙烯酸甲酯大规模制备)可以在2-苯基吡啶的对位发生反应,形成脱芳构化的中间体Int-1。两当量的DBU首先消除三氟甲磺酸阴离子以形成膦离子Int-II,然后消除丙烯酸甲酯以良好收率地得到杂芳基膦2a。选择吡啶作为阶段B中的第二偶联配体和杂芳基膦2a发生亲核加成得到完全的区域选择性的双杂芳基鏻盐3a。对于阶段C,作者发现在80 ℃下2当量的HCl的乙醇溶液中以极好的产率(88%)得到杂联芳烃4a(图1C)。在该方案中,没有观察到杂芳基-苯基或苯基-苯基偶联的产物。
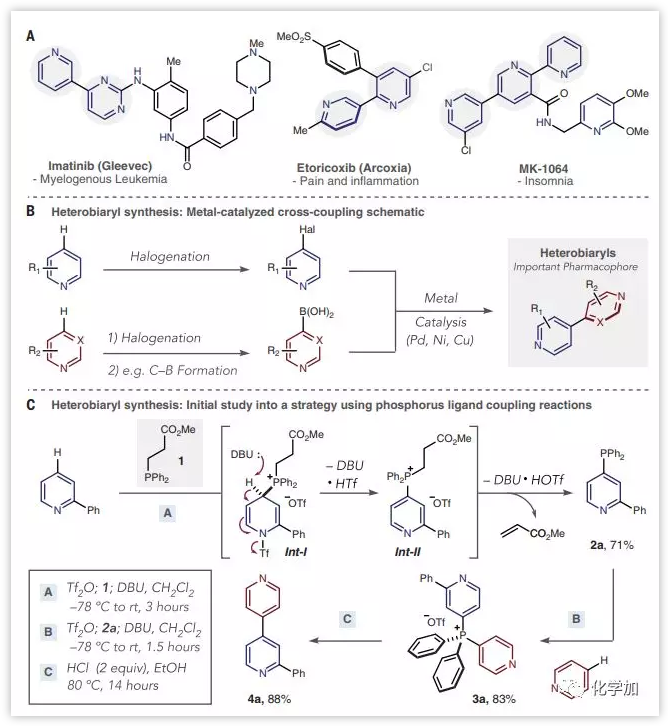
图1:金属催化的交叉偶联反应合成杂联芳烃(来源:Science)
为了阐明该反应的机理,作者进行了一系列实验和计算研究。将盐3a置于氘代盐酸的d4-甲醇溶液中,通过1H NMR和31P NMR发现每当量酸的吡啶质子共振连续移位,表明两种吡啶都被质子化。但是,在反应条件下的31P NMR研究中未检测到P(V)中间体,所以猜测配体偶联是逐步进行的。计算研究确实预测了P(V)中间体Int-III分子内配体偶联以逐步方式进行,并且在Int-III连续质子化时存在显著的势能降低效应(ΔG‡),表明了偶联是由于过渡态动力学差异而非热力学差异产生的。随着膦的亲电性增加,速率数据显示杂联芳烃会更快的形成,表明速率决定步骤在[Int-III·2H]2+之前。其次,在较低温度下,酸性醇溶液下杂联芳烃的收率是很差的;然而,当乙醇盐用作亲核试剂时,在室温下几分钟内就可以合成杂联芳基,但是观察到痕量的碳偶合以及大量的由原子膦化产生的产物,进一步验证了配体偶联的低势能(图2)。
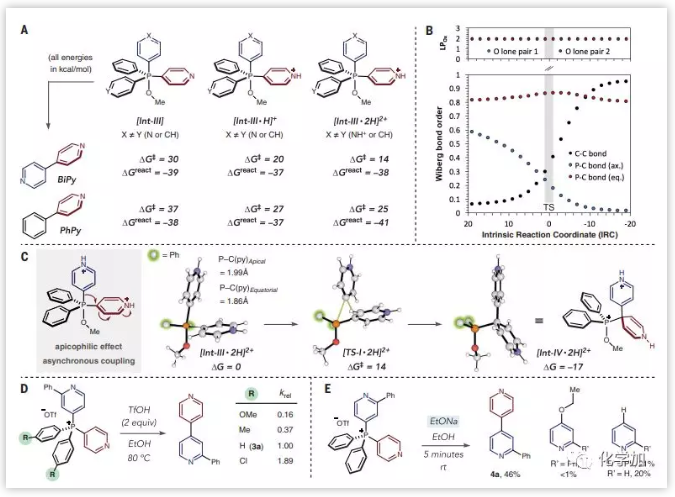
图2:交叉偶联反应的机理研究(来源:Science)
基于上述的实验及机理研究,作者提出了配体偶联是通过形成连续的C-P键,选择性地取代每个杂环偶联配体中的C-H键以产生膦盐;然后通过P(V)中间体触发膦配体偶合,在酸性醇溶液中两个配体之间的C-C键形成。与金属催化的偶联反应所有步骤一次进行不同,该反应分阶段逐步进行,这可以让人思考如何控制这种反应,更令人兴奋的是,还可以探索如何构建其他类型的C-C键。
之后,作者对底物范围进行了研究。各种杂原子芳烃都能以良好到优异的收率得到杂联芳烃。在绝大多数情况下,该反应都发生在吡啶的4-位,除非存在4-取代基,其将选择性转换为2-位。使用该策略可以获得各种4,4'-联吡啶(4b-4f)。容纳诸如酯,三氟甲基和甲氧基等官能团,以及通常在金属催化反应中具有活性的卤化物。还合成了复杂的杂联芳烃,如氟化2,4'-喹啉-吡啶4g,以及含嘧啶和吡嗪的杂联芳烃4j和4k,相较于吡啶底物收率较低。在该反应中,当将2-取代的吡啶偶联到3-取代的吡啶上时,必须是2-取代的吡啶转化为相应的膦,否则不能反应。其次,具有2-三氟甲基的吡啶,4-烷基或芳基取代基,和2,6-二取代的吡啶底物不能反应。具有多于两个吸电子基团或给电子基团的吡啶和二氮杂苯导致产率较低或不形成膦盐(图3)。
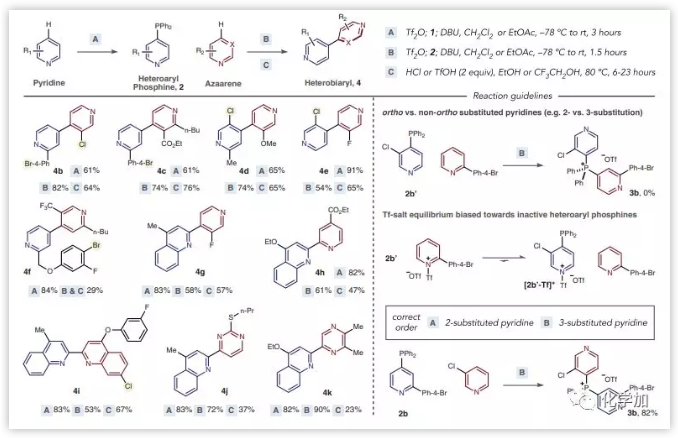
图3:底物拓展(来源:Science)
作者接下来研究了在复杂中间体及药物分子中的应用。对于相应的卤化物前体不可商购或制备的杂原子芳基,使用该模式可以形成具有精确区域选择性的杂联芳烃(4l-4o)。并且在该方法中容许存在另外的饱和或不饱和氮杂环。例如,氯苯那敏和氯雷他定就是该方法的有效底物,可以以良好的收率得到杂联芳烃4p和4q,产率分别高达84%和87%。Vismodegib也能以中等产率转化为2,4'-喹啉吡啶4r。广泛应用的杀真菌剂苯氧喹啉也适用于该反应模式,以58%的产率得到4s。含有多个反应位点的药物依托考昔和伊马替尼也可以适用于该反应,以80%和41%的产率得到杂联芳烃4t和4u(图4)。
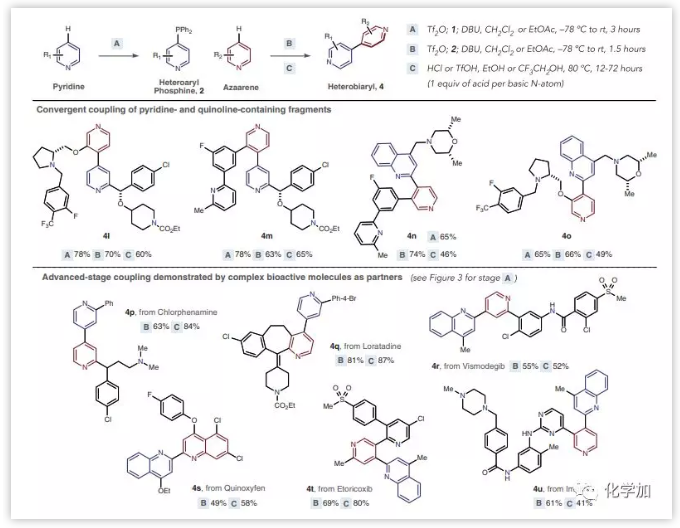
图4:复杂分子的交叉偶联反应(来源:Science)
结语:科罗拉多州立大学的化学家Robert S. Paton及Andrew McNally开发了膦催化的无过渡金属参与的杂原子芳烃的交叉偶联反应。克服了金属催化方法中极性官能团的兼容性问题,并且避免了预先制备杂芳基卤化物和硼酸。该方法使用容易制备的膦催化剂分步进行,产品具有优异的区域选择性。除了合成吡啶结构的杂联芳烃外,还适用于复杂药物分子的杂联芳基化,在药物化学中具有重要意义。
撰稿人:残丶月丿
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn