

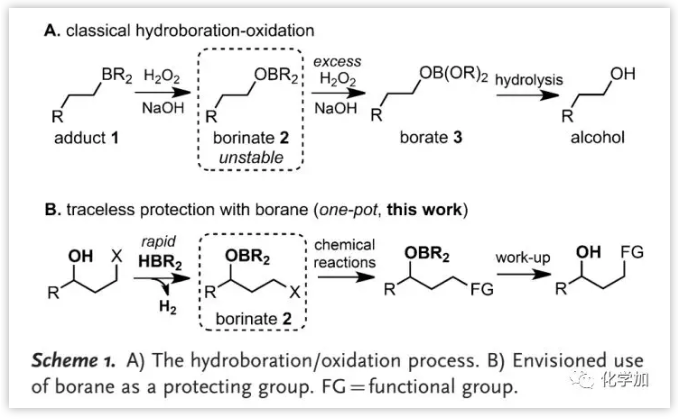
烯烃的加氢及后续氧化是广泛应用的有机合成方法。通过氧化衍生的硼酸盐2通常不稳定,难以分离(Scheme 1A)。由于硼烷与醇的反应快速而不干扰其它官能团,中国科学院上海有机化学研究所洪然课题组设想利用硼酸盐2中硼烷基团的不稳定性,将其作为保护基用于合成中,(Scheme 1B),其挑战在于硼酸盐2与化学转化的相容性。
(图片来源:Angew. Chem. Int. Ed.)
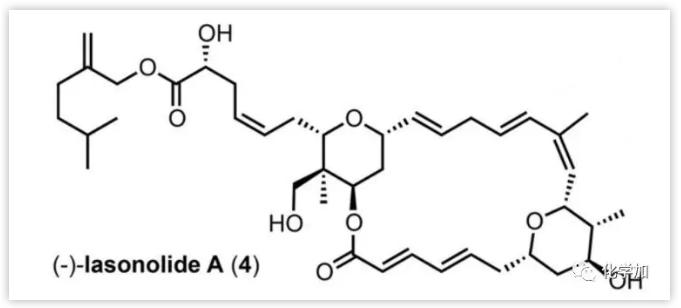
Lasonolide A (4),是由McConnell及其同事从加勒比海海绵Frocepia sp.中分离并鉴定的聚酮类海洋天然产物(Scheme 2 A),具有良好的抗胰腺癌作用。其生物学特征及其独特的化学结构引起了有机合成化学家们的兴趣,近日,洪然研究员课题组在Angew. Chem. Int. Ed.报道了Lasonolide A的汇聚式不对称合成。
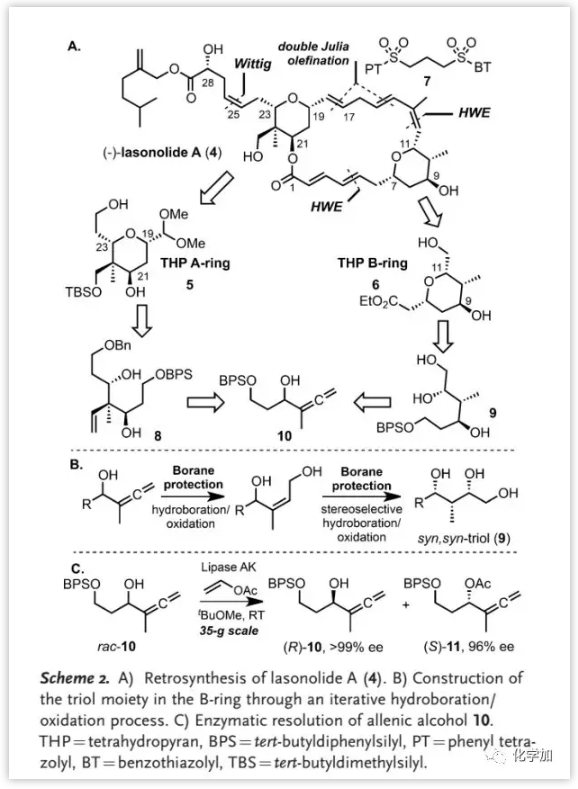
Lasonolide A的合成策略(Scheme 2):
Lasonolide A (4)的合成涉及两个关键的四氢吡喃片段(5和6)与二砜7通过双重Julia烯化以及大环内酯化实现连接,剩余的双键通过Wittig-型反应引入。四氢吡喃A环和B环通过基于迭代硼氢化/烯丙基化和硼氢化/氧化的对映选择性方法引入。其中,外消旋α-丙二醇经酶动力学拆分得到的两种对映体分别转化为两个单独的片段10和11用于合成高级中间体8和9。
(图片来源:Angew. Chem. Int. Ed.)
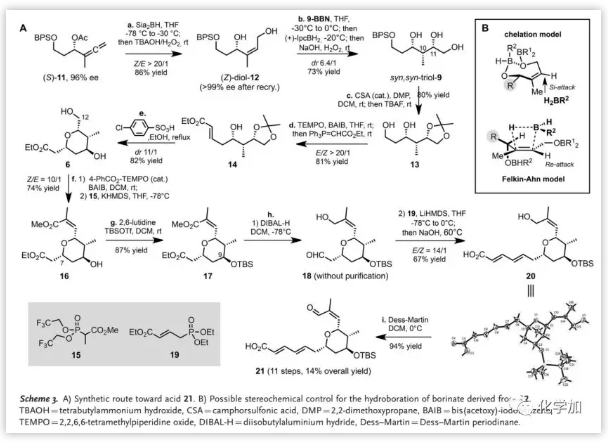
具体的合成路线:
在B环C11位引入羟基的关键在于三取代烯烃的立体选择性硼氢化(Scheme 3)。α-乙酰基丙二烯衍生物(S)-11不利于硼氢化,易发生1,4-消除产生二烯副产物。作者发现用TBAOH/H2O2溶液可以将(S)-11转化为Z-烯烃二醇12(ee>99%)。为了在C11位引入仲醇,作者首先尝试硼氢化/氧化却得到了复杂混合物。这可能是由于硼上的大位阻基团,使得烷基硼与二醇底物螯合得到刚性构象阻碍了立体选择性硼氢化。因此,作者首先将9-BBN与12的伯羟基反应,然后加入过量的IpcBH2以促进硼氢化/氧化,可以73%的收率和良好的非对映选择性(dr 6.4/1)得到顺式,顺式-三醇9。
(图片来源:Angew. Chem. Int. Ed.)
在得到三醇9后,经缩酮保护、TBAF脱硅保护、氧化成醛后进行Wittig反应得到共轭酯14,然后通过脱保护和氧杂-Michael环化(6-exo)级联过程产生顺式-四氢吡喃6,再通过“一锅法”氧化/烯化在C12位进行碳链延长。氧化后与化合物15烯化得到三取代的cis-共轭酯16,经TBS保护和DIBAL-H还原得到的醛18,不经纯化直接进行HWE反应、水解后得到酸20,其三个C=C双键的立体化学通过X射线衍射分析确证,再经Dess-Martin氧化形成Z-烯酮酸21。
接着,作者通过Michael加成完成了对于A环的构建(Scheme 4)。作者将丙二烯(R)-10与醛22在Sia2BH作用下进行加成得到反式,反式-二醇23,再丙酮叉保护二醇得到化合物24,其经“一锅法”进行氧化、Henry反应和消除得到硝基烯烃25。然后,用PTSA处理化合物25发生脱保护、氧杂-Michael加成、Nef反应和缩醛化级联反应并以高产率以及高区域和立体选择性得到26,为获得多中心四氢吡喃(A环)提供了有效的解决方案。接下来,将26进行臭氧裂解、还原和保护后得到硅醚27后,考虑脱苄基以引入侧链。作者设计了脱苄基化的无过渡金属条件,当用9-BBN保护C21-OH时,锂-萘体系有效;当C21-OH裸露时,发生TBS迁移导致产率降低,并通过X射线衍射确证了迁移产物5a的结构,也证实了A环中C19-C23的立体化学。将5中伯醇选择性氧化后与28进行Wittig烯化得到Z-29(Z/E>20/1),然后经保护基操作产生的醛30与二砜7进行Julia烯化得到相应的砜31(E/Z>20/1),引入C17/C18双键。
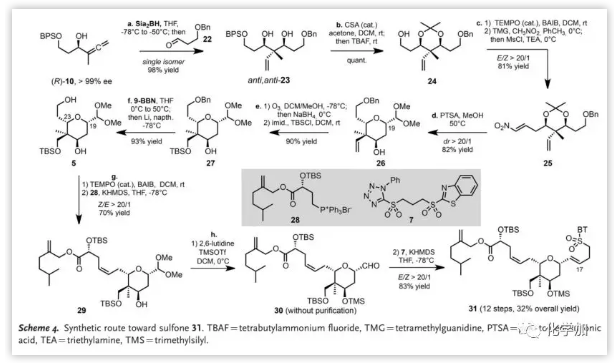
(图片来源:Angew. Chem. Int. Ed.)
在直接用游离二烯酸21进行Julia烯化(Scheme 5)失败后,作者选择对羧基进行保护。初步机理研究表明,酸酐21与9-BBN络合后,在11B NMR谱中显示出两个新信号(21a和21b)(32.8和19.7 ppm),并且在室温下稳定。在-75 ℃下,向上述络合物中加入砜31和LiHMDS进行Julia烯化,酸处理后得到酸 32的E-异构体。最后,通过Yamaguchi大环内酯化和脱保护以58%的收率得到(-)-lasonolide A(4,35.8 mg),其光谱数据与原始数据以及其他合成研究中报道的数据一致。
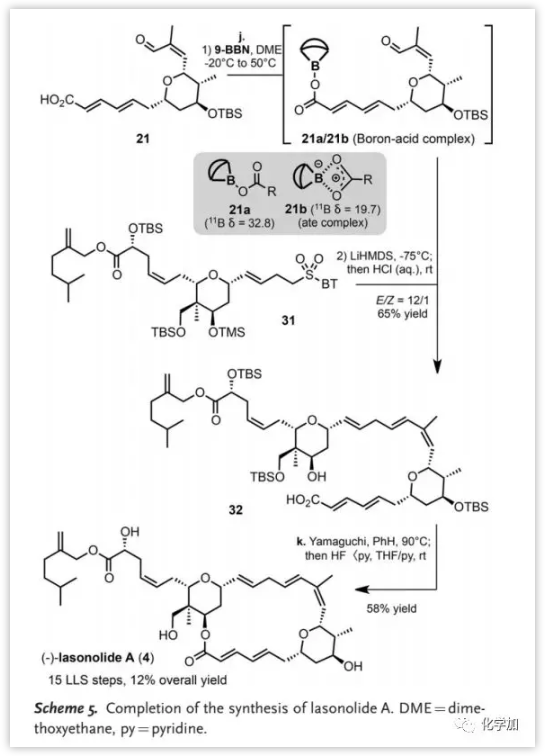
(图片来源:Angew. Chem. Int. Ed.)
小结:洪然研究员课题组采用砌块化策略,以最长线性步骤15步和12%的总收率(以rac-10计)完成了lasonolide A的汇聚式不对称全合成。其合成亮点包括:开发了一种对映体聚合方法用于获取两对含多个手性中心的四氢吡喃片段;利用迭代硼氢化/氧化将丙二烯转化为B环的手性中心;通过级联过程构建A环,并为衍生化提供了结构基础。此外,亚稳硼酸盐和硼烷配合物作为隐形保护基促进了丙二烯和烯烃的关键立体选择性硼氢化、脱苄基化和Julia烯化,减少了保护基操作。通过建立四氢吡喃立体异构体的策略,还可以组装更多的大环内酯类似物,在药物研发中具有重要意义。
撰稿人:爽爽的朝阳
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn