

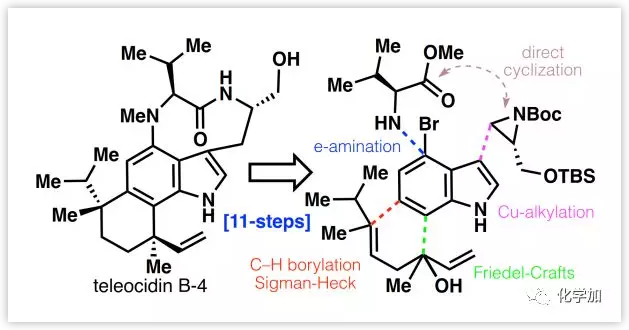
Teleocidins B-1,2,3和4(1-4,Figure 1),是由Sakai课题组于1960年从细菌菌株(Streptomyces mecliocidius)中分离并报道的一类吲哚生物碱,具有活化蛋白激酶-C(PKC)的活性,其结构通过单晶X-射线衍射确证。Indolactam V(5)作为1-4的生物合成前体本身就是一个合成目标,其萜部分源于后期在C22位进行香草基化,然后进行Friedel-Crafts环化构建C19-芳基键。由于远端氨基酸大环的存在和双季碳中心位于萜烯片段的两侧,使得手性接力方法不可行,增加了立体控制的困难。目前,已有报道通过17-28步完成3和4的合成,但其中3个手性中心缺乏立体控制。近日,美国Scripps研究所Phil S. Baran课题组通过简洁的11步反应完成了1-4的全合成,其合成策略涉及电化学芳基胺化、Cu-介导的色氨醇构建、C-H硼酸化和通过Sigman-Heck反应立体选择性构建季碳中心等。
(图片来源:J. Am. Chem. Soc.)
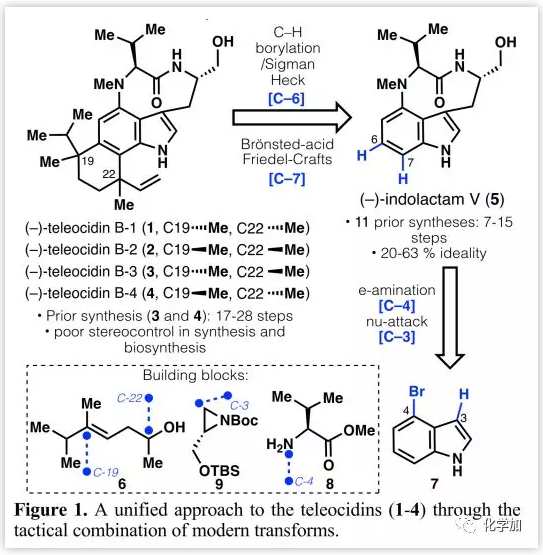
Teleocidins B的逆合成分析(Figure 1):
作者期望简化合成步骤并通过indolactam(5)合成1-4。因此,作者选择将两个季碳中心从C-19/C-6和C-22/C-7处断开,后续通过C-H官能团化连接。其中,通过与烯烃6的Sigman-Heck反应,在不同的配体控制下构建C-19/C-6键的手性,而C-22/C-7键可以通过筛选不同Brönsted酸催化的Friedel-Crafts反应构建,其顺序与以前合成方法所采用的顺序以及生源合成顺序明显相反。目前,合成吲哚生物碱5的方法已有11篇文献报道(7-15步,20-57%收率)。作者设想了一种简化的合成方法,即以4-溴吲哚(7)为原料,采用电化学辅助的Ni-催化胺化(与8在C-4处),Cu-介导的氮丙啶亲核开环(与9在C-3处)和碱诱导的大环化。
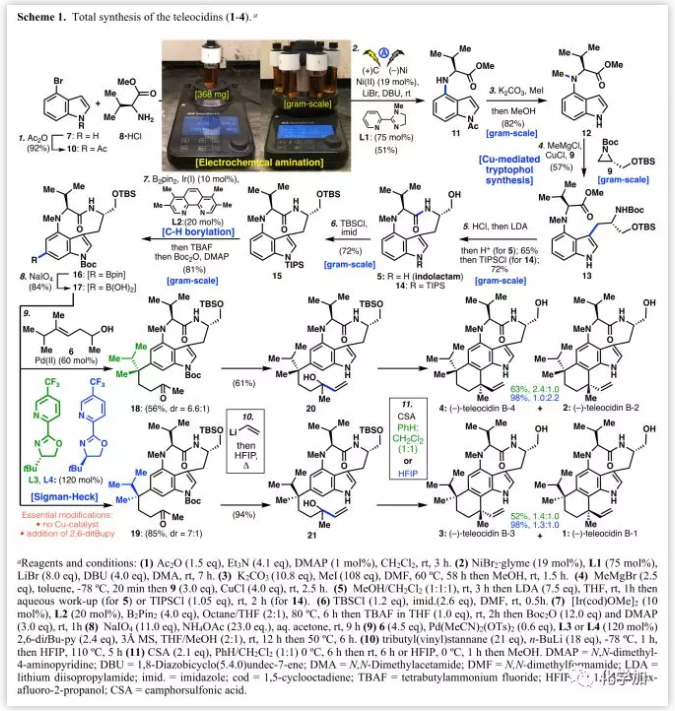
具体的合成路线(Scheme 1):
作者以市售的4-溴吲哚(7)为起始原料,经乙酰化后得到10,尝试利用Tokuyama和Billingsley等人开发的Ullmann条件在C-4处与缬氨酸进行C-N偶联,但未得到目标产物。随后,作者考察进行胺化的电化学方法,并以较低的收率得到加成产物11。通过条件筛选发现,L1为配体、DBU为碱时最佳,可以实现400毫克的制备,若使用平行合成仪可达到> 1 g/7 h。随后,用K2CO3/MeI进行N-甲基化并脱去乙酰基保护,以82%的收率得到12。Tokuyama和Chung等人的研究表明,将色氨酸侧链连接在吲哚的C3位需要大量的实验。在先前的研究中,为避免缬氨酸侧链的潜在差向异构化,可以直接用7进行氮丙啶开环。在Tokuyama的优化条件(无Lewis酸)下,以30%的收率得到色氨醇13,并生成了大量进攻甲酯侧链C3位而产生的酮副产物;CuCl(4.0 eq.)的添加对该关键转化的重现性和放大化是必不可少的(57%,克级规模;回收的原料再循环利用可将产率提高到67%)。
(图片来源:J. Am. Chem. Soc.)
为了完成indolactam(5)的合成,作者用干燥HCl脱除Boc和TBS保护基后,在LDA作用下实现大环内酰胺化。在N-甲基化后,13中甲酯附近空间位阻增大,使其水解并不理想。最后,用酸将大环内酰胺化反应淬灭后直接得到5(65%),经TIPS保护得到14(72%)。通过五步反应完成生物碱5(80%)的构建,这也是迄今为止最短和最理想的合成路线。在得到足够量的14后,将其伯醇进行TBS保护得到硼酸化前体15,然后在配体L2作用下进行区域选择性C-H硼酸化(81%,克级规模)得到16。最近文献报道,在Sigman-Heck氧化还原转化中,可以用配体进行立体控制的方式产生多种季铵中心。作者将其首次利用在复杂天然产物全合成中,分别用配体L3和L4将硼酸17在改进的Sigman条件下得到非对映酮18(6.6:1 dr, 56%)和19(7:1 dr, 85%)。该反应成功的关键在于:1)由于大量的质子去硼化反应,不需要再添加基于铜的共催化剂,2)16不能发生反应,说明游离硼酸是必需的,3)加入2,6-二叔丁基吡啶可以减少质子去硼化,4)利用混合溶剂体系(MeOH/THF=2:1)最佳。Teleocidin B家族化合物的最后两个碳原子通过乙烯基锂加成/脱Boc完成(18到20收率61%,19到21收率94%)的。最后,利用Brönsted酸(CSA)完成叔醇闭环得到所有四种teleocidin B天然产物(1-4)。经过广泛的条件筛选发现,通过简单改变溶剂可以实现对季碳中心的选择性。其中,20在苯/CH2Cl2(1:1)中可以63%的收率得到4和2混合物(2.4:1.0),而HFIP溶剂将该比率反转为1.0:2.2,收率98%;但对于21,其主要非对映异构体为3(3/1, 1.4:1.0)。
小结:Scripps研究所Phil S. Baran课题组通过简洁的11步反应完成了Teleocidins B-1~B-4的全合成,其中仅用7步构建出骨架C-C和C-N键。为了避免非必要转化步骤而进行的关键切断依赖于C-H官能团化策略和实现片段固有基团的最大化利用。其合成特征在于:Cu-介导的色氨醇合成、碱诱导的大环化、区域选择性C-H硼酸化,以及复杂分子构建中的电化学胺化和Sigman-Heck反应的首次应用等。
撰稿人:爽爽的朝阳
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn