

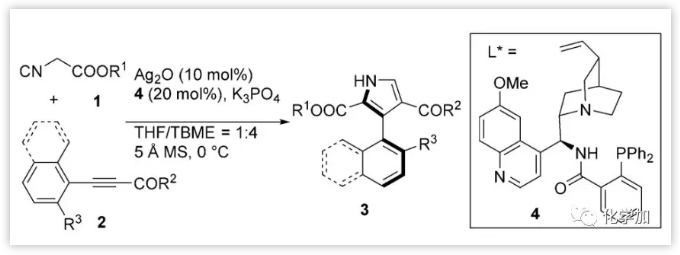
轴手性联芳基化合物存在于许多重要的天然产物和药物中,并且是许多配体和催化剂的核心骨架。虽然已经有许多轴手性六元芳基-芳基或芳基-杂芳基化合物的不对称合成报道,但带有五元杂环阻转异构体的催化不对称合成仍然很少。
吡咯是活性天然产物和药物中最突出的五元杂环之一。已经有许多含有各种取代基的吡咯的合成方法。例如,最近,Tan报道的Fe(OTf)3/手性磷酸催化的对映选择性Paal-Knorr反应(图1a)。2005年,Yamamoto和de Meijere报道了异氰酸酯1与活化的炔酸酯2的金属催化的杂环化,用于合成2,3,4-三取代的吡咯3(图1b)。随后该方法可以延伸至末端炔烃和α-取代的α-异氰酸酯的反应。 从机理上讲,金属化中间体A与炔酸酯2发生Michael加成得到中间体B,B环化得到中间体C。然后C发生去金属化和[1,5]-H迁移得到多取代的吡咯3。作者猜想,如果R2是带有邻位取代基的芳基,其可以阻碍新形成的芳基-吡咯键的自由旋转,得到的C3芳基取代的吡咯将是具有轴手性的。作者借鉴这一方法报道了在Ag2O和Dixon型氨基膦配体4存在下,1和炔基酮2以良好的产率和优异的对映选择性得到轴手性3-芳基吡咯3(图1c)。
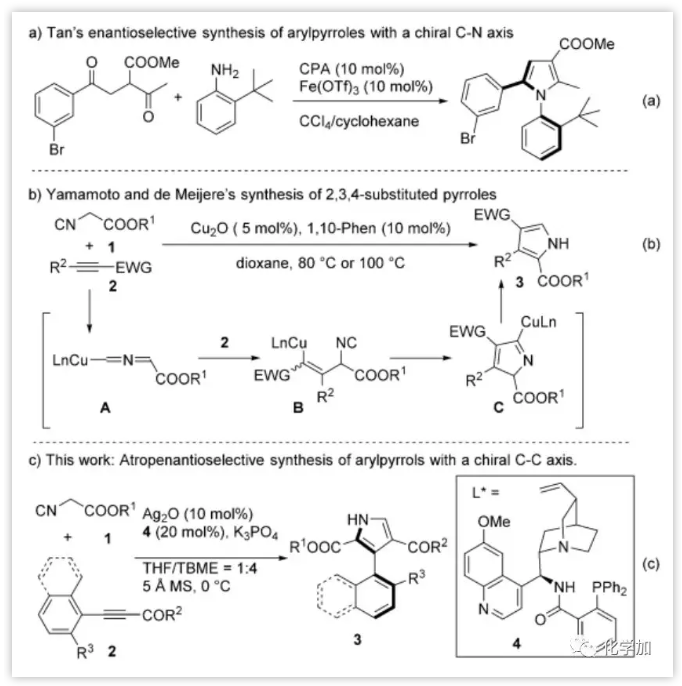
图1:芳基吡咯的合成(来源:Angew. Chem. Int. Ed.)
参考Dixons的反应条件,作者研究了异氰酸酯1a和3-(2-甲氧基萘基)-丙炔酸乙酯5a的反应(图2)。在室温下,Ag2O(10 mol%)和手性膦配体4(20 mol%)存在下,1a和5a以较低的转化率(< 20%)和低对映选择性得到所需的芳基吡咯6a。然而使用苯基酯5b作为反应配偶体,仅得到唯一的噁唑产物7b。这些结果表明共轭羰基微妙的电子效应对反应的化学选择性(1,4-加成或1,2-加成)非常敏感。虽然乍一看结果令人失望,但6a的结果促使作者继续这项研究。
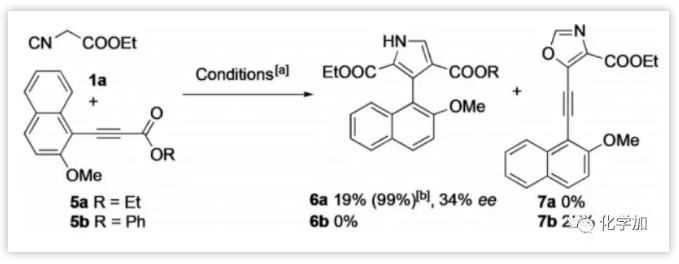
图2:α-异氰酸酯和β-萘基取代的丙炔酸酯的反应(来源:Angew. Chem. Int. Ed.)
作者接下来选用1a与α,β-炔酮2a(R3 = OMe,R2 = Ph)作为模版底物对反应条件进行了优化。发现1a和2a在氯仿中,Ag2O(10 mol%)和膦配体4(20 mol%)存在下反应顺利进行,以67%的收率和65%的ee值得到轴手性3-芳基吡咯3a(图3)。随后发现溶剂对反应结果有着显著的影响,在醚类溶剂中观察到较高的对映选择性(entry 5-8)。进一步研究后发现最佳条件为:1a(0.12 mmol)和2a(0.10 mmol),溶剂为(THF/TBME = 1/4,c = 0.1 M),在Ag2O(10 mol%),配体4(20 mol%),K3PO4(2.0当量)和5Å MS(100 mg)存在下,0 oC下反应48小时,以52%的产率和91%的ee值得到3-萘基吡咯3a。
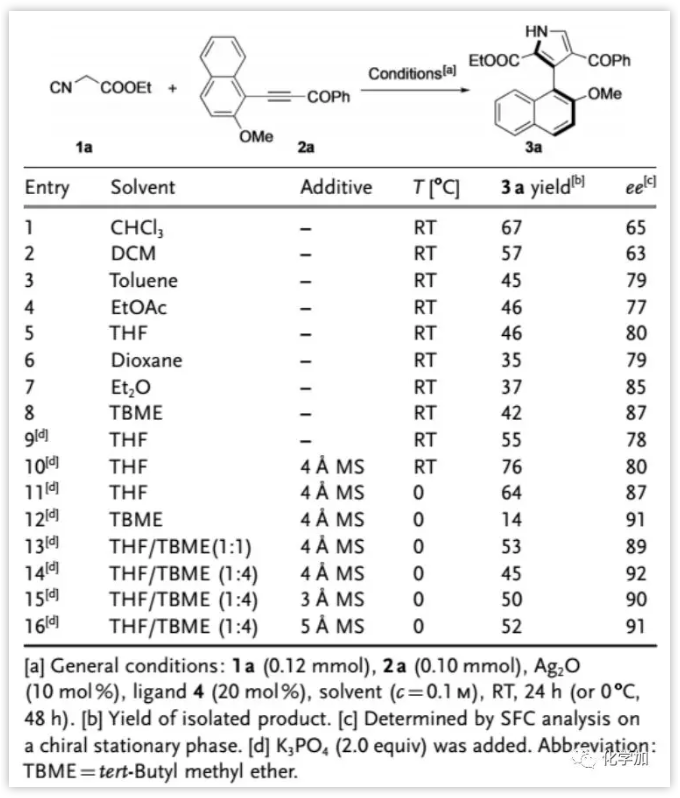
图3:条件优化(来源:Angew. Chem. Int. Ed.)
接下来作者对底物范围进行了研究(图4)。对于α,β-炔基酮2的羰基部分,苯环上的给电子和吸电子基都具有良好的耐受性,都能够以优异的ee值得到产物。对于富电子芳环,能够以较优异的产率得到3-芳基吡咯,例如3d,3h,3i。含有乙酰氧基或者含溴的芳环也是相容的。含有喹啉体系的炔酮也能参与反应,以中等收率和优异的ee值得到3m。对于不同的α-异氰酸酯,发现用大位阻的叔丁基获得了最好的结果(3r,95%收率,96%ee)。克级规模实验还证明了该反应的放大潜力。3n和3s的绝对构型通过X射线单晶衍射确定为(aR),其他产物的绝对构型通过类比得到。
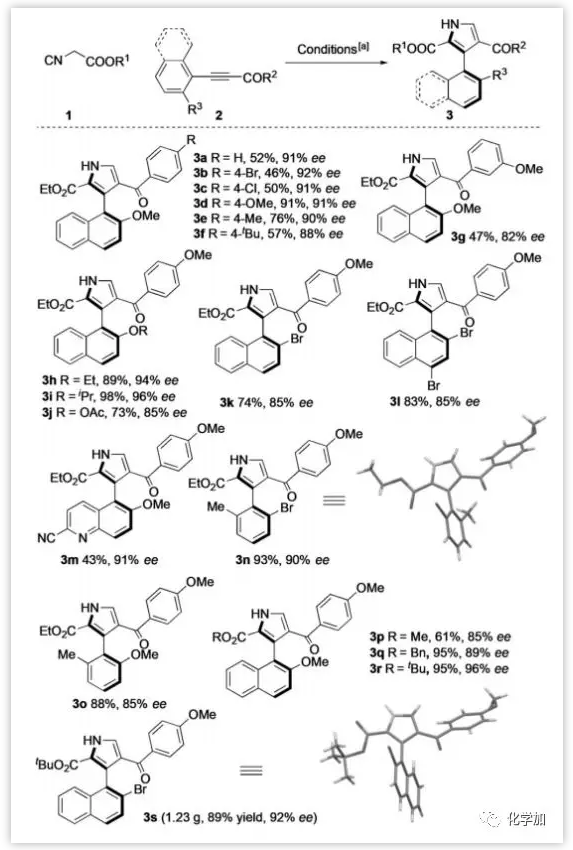
图4:底物拓展(来源:Angew. Chem. Int. Ed.)
作者提出了α-异氰酸酯的(Z)-烯醇化物立体化学模型(图5)。酰胺氮、磷、羰基氧和二价异氰化碳原子与银配位,限定了两种反应定位。质子化的奎宁和羰基氧之间的氢键可以进一步改善过渡态D的立体化学环境。为了使空间相互作用最小化,炔烃从背面接近烯醇化物,对映选择性地得到中间体E。然后分子内加成得到F,其在质子化后得到G,然后[1,5]-H迁移得到主要对映体轴手性3-芳基吡咯3。值得注意的是,当R2是富电子芳环时,该反应具有高度的化学选择性,因为没有观察到烯醇化物与酮的1,2-加成所产生的噁唑啉。
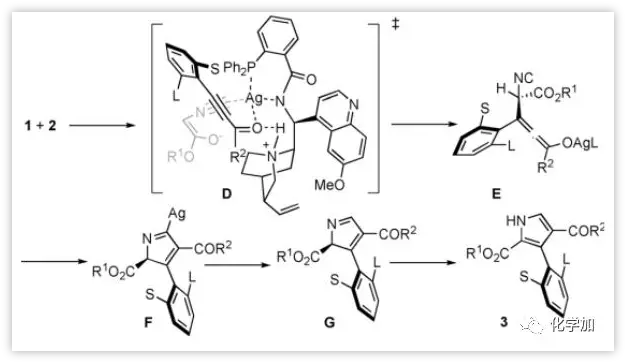
图5:可能的反应过程(来源:Angew. Chem. Int. Ed.)
作者接下来对轴手性芳基吡咯3s进行了衍生化实验(图6)。3s经过N-甲基化得到10,10皂化后与2-氨基乙醇酰胺化,以优异的产率得到酰胺11。11中的伯醇先O-甲磺酰化随后发生碱促进的环化以优异的总收率得到12。12与1-甲氧基-4-乙烯基苯发生Heck反应以95%的收率得到烯烃13。在所有这些转化中未检测到对映选择性的损失。并且这种烯烃咪唑配体已被证明在催化不对称合成中可作为有效的配体。
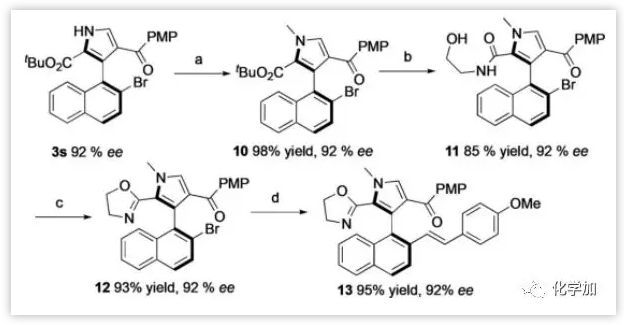
图6:3s的衍生化实验(来源:Angew. Chem. Int. Ed.)
总结:瑞士洛桑联邦理工学院祝介平教授报道了Ag/手性配体催化的异氰酸酯和α-芳基-α,β-炔基酮的不对称杂环化反应,该反应具有优异的对映选择性和高的化学选择性,首次报道了轴手性3-芳基吡咯的对映选择性合成。
撰稿人:残月
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn