

单分子亲核取代(SN1)和双分子亲核取代(SN2)都是成熟的教科书化学(Fig. 1A),然而关于三级亲电试剂的不对称亲核取代的报道却屈指可数。Sun课题组报道的是氧稳定化的正离子加成,而Jacobsen课题组发展了无杂原子稳定化的碳正离子不对称烯丙基化反应(Fig. 1B)。SN2反应与SN1反应相比,更多被应用于动力学拆分。Fu通过单电子转移引发的自由基SRN1反应成功实现了消旋的三级烷基氯和胺进的不对称交叉偶联(Fig. 1B)。
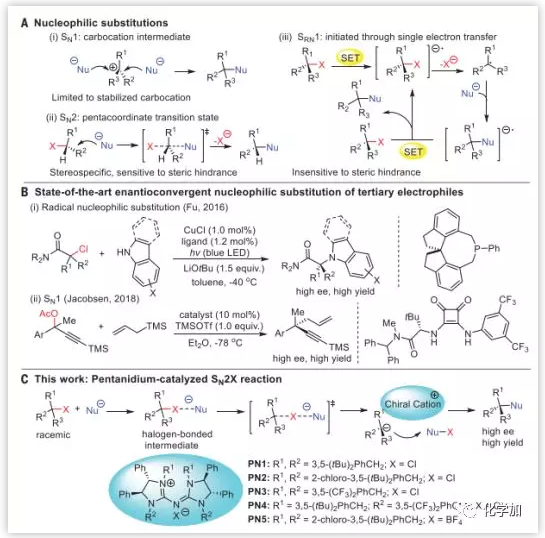
Fig. 1. 亲核取代反应(A)亲核取代SN1,SN2和SRN1(B)三级碳亲电试剂的对映亲核取代(C)本文工作:Pentanidium催化亲卤亲电对映性取代 图片来源: Science
与人们认识的SN2机理不同,另一种取代途径SN2X是亲核试剂(Nu)进攻离去基团,和卤原子X相互作用,产生碳负离子和新的亲电中间体(Nu–X),然后碳负离子取代Nu–X的X生成取代产物。SN2X反应往往发生在亲核试剂进攻Sp3碳中心受阻后,更倾向于进攻卤原子,因此可用于合成拥挤的三级和四级碳中心。
近日,来自南洋理工大学的Choon-Hong Tan课题组和新加坡设计大学的Richmond Lee课题组合作报道了在手性阳离子“盘扭五氮胍盐(Pentanidium)”催化剂控制下硫代羧酸盐(或叠氮化物)取代活化的三级溴代烷,生成具有高对映选择性的取代产物(DOI: 10.1126/science.aau7797)。通过实验和计算化学研究,证明了此反应是通过SN2X机理实现。
作者选择被活化的三级溴代烷1a作为模板底物,进行了条件筛选。测试了在5 %的“盘扭五氮胍盐(Pentanidium)”催化下一系列硫代羧酸盐的取代反应(Fig. 2A),发现当2b和PN4组合时反应效果最佳。然后作者筛选了不同底物类型(Fig. 2B),苯基、噻吩基和呋喃基硫代羧酸盐均有良好的反应性;一级和二级的烷基取代底物反应情况良好(3d到3h);烯丙基和炔丙基在此反应中也有较好兼容性(3i到3k,3l);对于苄基取代基,不论吸电子基团还是给电子基团都有较好的产率和ee值(3m到3q) ;对多种苄基和萘甲基底物也有较好反应性(5a到5h);但对于呋喃甲基和噻吩甲基的取代底物,虽然产率受影响不大,其ee值却有明显下降(5i 和 5j)。
然后作者研究了其他亲核试剂的反应性。有机叠氮化合物是有机合成中的重要砌块,然而合成手性三级有机叠氮化合物的方法屈指可数,且均是从高光学纯的三级卤代烷出发。作者发现使用前文的催化体系在-40 °C的低温条件下,在饱和碳酸钠和二异丙基醚混合溶液中,通过3~4天反应,3 mol %的PN5可将6a和两当量NaN3缓慢催化转化为三级叠氮有机化合物,产率为86%, ee值为94% (Fig. 2C) 。作者推测此该反应活性较低的主要原因可能是叠氮化钠在-40 °C下的溶解度问题。作者拓展了底物范围,发现烷基、苯乙基底物以及含有烯基和炔基的底物反应产率较高(7b到7c,7h到7j和7m),含有大位阻的取代基的底物产率和ee值稍受影响,会产生质子化副产物(7d到7g) 。将环丙烷和戊烯基取代底物作为自由基探针,发现产物均为常规产物,并无开环和关环产物(7e和7i),说明此反应不大可能是自由基机理反应。底物中的羟基不能兼容,但当使用TBS或乙酰基保护后,产率和ee值无明显变化。
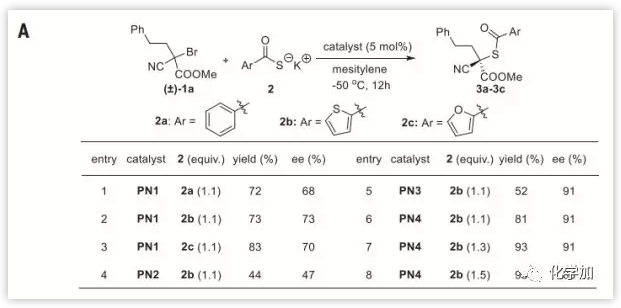
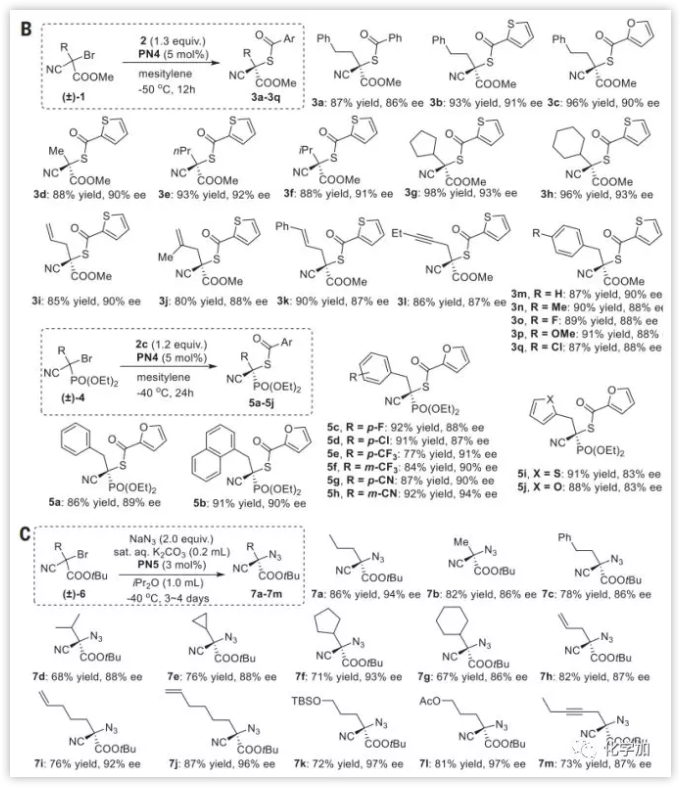
Fig. 2. (A)优化反应条件(B)硫代羧酸盐对映性取代三级溴代烷(C)叠氮化物对映性取代三级溴代烷 图片来源: Science
然后作者对反应机理进行了研究,基于(Fig.2C;7e和7i)的反应情况和自由基捕捉剂的捕捉试验,作者认为自由基机理可以排除(Fig. S1) 。然后分别给体系加入质子源试剂(MeOH, H2O和PhOH)和氢源试剂(1,4-环己二烯,芴, 氧杂蒽和Et3SiH),发现氢源试剂并不能影响反应,而质子源试剂可以促进反应向质子化产物1a-H方向进行。作者推测如果1a-H产生于碳负离子的质子化,那么则可以观察到此碳负离子的取代基效应。通过对不同取代基的研究得到了一条斜率为+2.57的线性相关曲线,说明吸电子基团对聚集在决速步骤的负离子有稳定化作用(Fig. 3B)。作者设计了碳负离子交换的实验来验证提出的碳负离子中间体,将混合的三级溴烷1l和1m-H在标准条件下反应,得到混合的产物3n (产率53%,ee值86%)和3o (产率45%, ee值77%) (Fig. 3C),说明部分来自1l的碳负离子从1m-H攫氢,生成相应的碳负离子,两种碳负离子均参与了不对称偶联反应并生成最终的产物3n和3o。
此时,作者有足够的证据认为该反应是SN2X机理。SN2X机理的关键特征是亲核试剂(Nu)进攻卤原子(X)形成新亲电中间体(Nu–X)。为了证明此过程,作者合成出假设的中间体8a,在PN4催化下与来自1a-H碳负离子1a-A进行反应(Fig. 3D),得到了1a(产率12%, ee值0%)和3a(产率66%, ee值82%;与Fig. 2B的3a对比);同样,利用类似反应也对叠氮反应进行了测试,得到了类似的结果,说明8a和BrN3都是存在的反应中间体。反应中偶联产物3a和7a均有较高的ee值,而得到的原料三级溴代烷无光学活性,说明本反应手性的引入并非在卤原子的攫取步骤。作者又将(用手性制备柱分离得到)两种不同手性的三级溴烷1i进行标准反应条件测试(Fig. 3E),发现从两种不同手性的原料得到相同的产物(+)-3k (ee值87%),且回收的原料1i为消旋状态,证明了8a和BrN3产生于SN2X机理,且为两可亲电试剂。碳溴键断裂步骤可逆(Fig.3F)也解释了手性原料的消旋化。作者也做了对叠氮反应类似的研究(Fig. S2)。
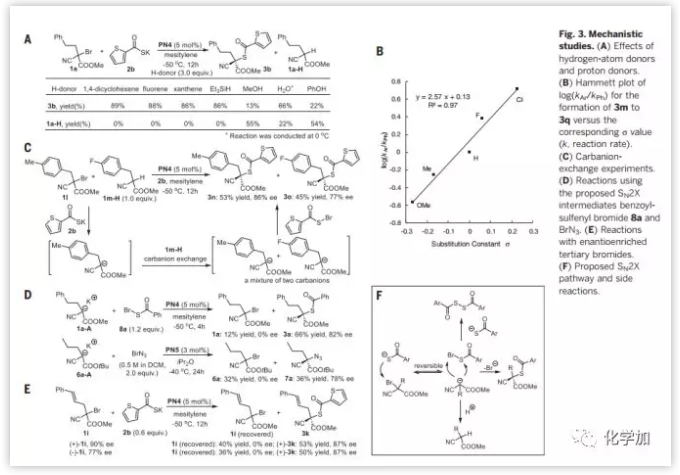
Fig. 3. 机理研究(A)氢源试剂和质子源试剂的影响(B)关于3m到3q的Hammett方程研究 (C)碳正离子交换实验(D) SN2X反应中间体8a和BrN3的研究(E)光学纯的三级溴代烷的反应情况(F)推测的SN2X反应机理和副反应 图片来源: Science
最后作者进行了计算化学研究。研究发现SN2机理需要通过真实加成反应,其过渡态TS-A能量较高。至于SN2X 机理,通过分子间卤键形成int-B中间体,Br拥有被吸电子的氰基和酯基增强的σ-hole。计算得到int-B的硫-溴键长度是3.04 Å,恰好符合卤键的长度,1b中的碳溴键被拉长到2.00 Å (Fig. 4),然后被切断,符合试验事实。
从int-B最容易实现的动力学步骤是硫代羧酸盐通过TS-B逐步攫Br,在自发生成S-Br键以及碳溴键断裂后,得到由卤键稳定的int-C。亚砜基溴从催化剂解离,留下催化剂和烯醇形成的离子对(cat-enolate)。前文解释过碳溴键的可逆断裂不具有对映选择性的,说明是生成手性产物的重要中间体int-D的方向性和催化剂对底物的束缚作用。随后通过TS-D,经过形成碳硫键,最后催化剂同产物解离,完成催化循环。图中活化能垒TS-B和TS-D 几乎等能,与亚砜基溴是个两可亲电试剂的实验结论一致。
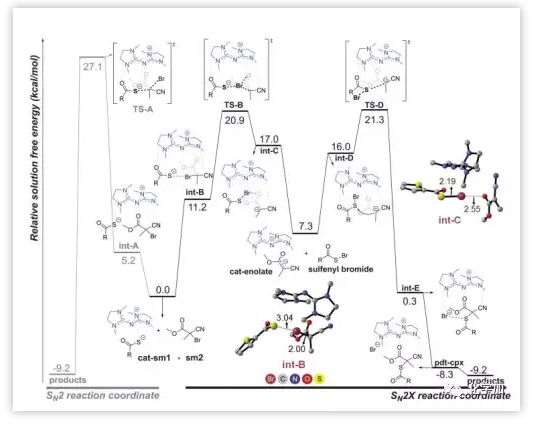
Fig. 4. DFT计算。通过DFT计算的SN2和SN2X机理的中间体和过渡态的自由能。球棒模型为几何优化的int-B和int-C的结构,且描述了关键原子间距 图片来源: Science
结论:卤键在超分子化学和晶体工程中已经得到长足发展,但在有机合成和催化中仍旧处于未开发状态。本文研究以卤键的作用为基础,实现了用常规手段难以实现的三级卤代烷的不对称亲核取代,是亲核取代反应发展史上的一块重要拼图,也为卤键在有机催化和催化中的应用打开了大门。
撰稿人:暗夜卡宾
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn