

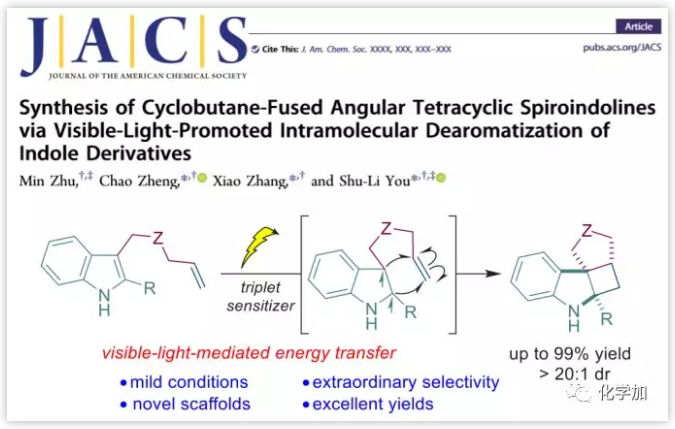
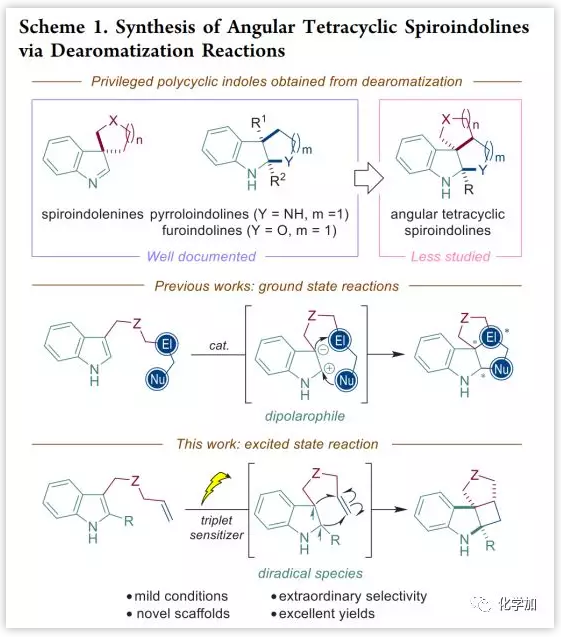
多环吲哚衍生物存在于多种生物碱和生物活性分子中,吲哚衍生物的去芳构化是快速构建这类分子骨架的最直接途径,如spiroindolenines、pyrroloindolines和furoindolines等(Scheme 1,顶部)。众所周知,在吲哚的C3位进行ipso-环化可以构建各种假吲哚螺环;在C3位进行Friedel-Crafts烷基化与外部亲电试剂可触发在C2位的环化得到稠合的二氢吲哚。然而,目前针对更前沿的目标结构如角四环螺环吲哚啉的催化方法尚不发达,已知的方法主要限于分子内环化(Scheme 1,中间)。另一方面,环丁烷广泛存在于天然产物、药物和农用化学品中。然而,由于其高张力的存在,使得构建环丁烷(特别是嵌入多环结构的环丁烷)充满挑战性。目前,通过光驱动的[2+2]环加成是构建环丁烷的主要方法,但是可见光促进的[2+2]环加成主要限于官能团化烯烃如α,β-不饱和酮和羧酸衍生物,并且涉及芳香分子的相关反应鲜有报道。近日,中国科学院上海有机所游书力团队开发了一种可见光促进的吲哚衍生物分子内[2+2]环加成方法,可以极好的收率和立体选择性得到环丁烷稠合的四环吲哚螺环(Scheme 1,底部)。
(图片来源:J. Am. Chem. Soc.)
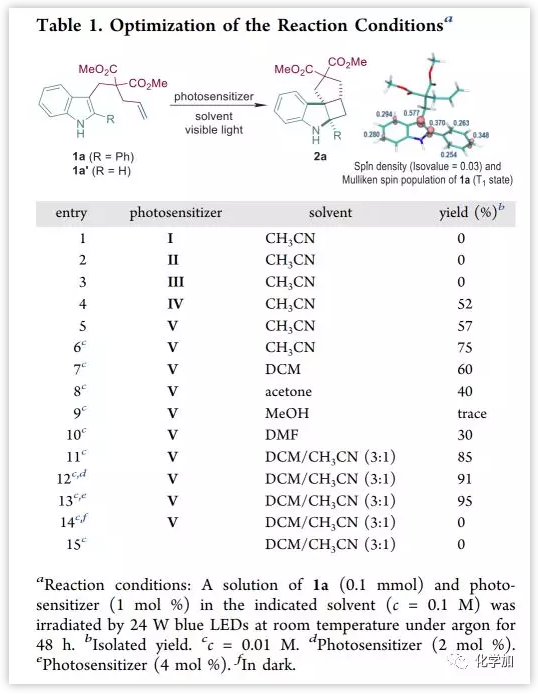
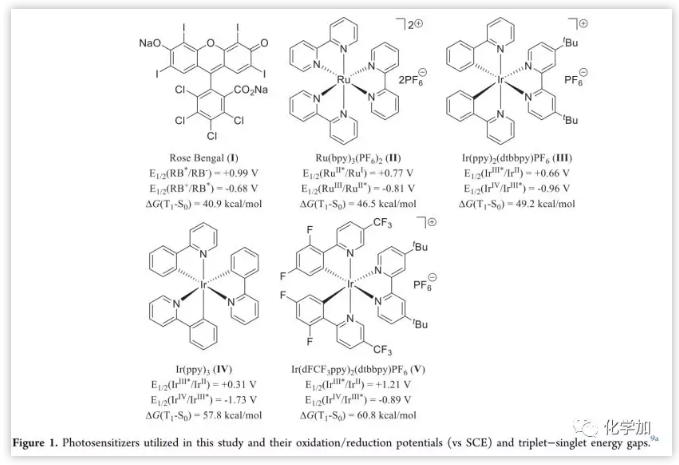
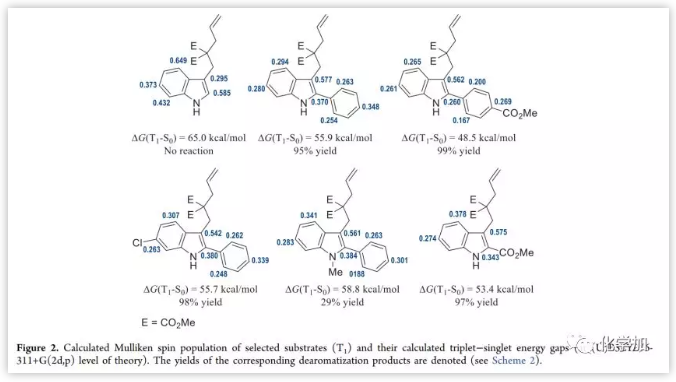
首先,作者以含吲哚环的末端烯烃1a'作为底物进行了研究(Table 1),但在可见光和常见光敏剂(Figure 1)催化下,均未发生预期的[2+2]环加成反应。实际上,1a′的T1与基态(S0)之间的能垒[ΔG(T1-S0)]为65.0 kcal/mol,超过了I-V的三重激发态能量(40.9-60.8 kcal/mol)。计算表明,通过在C2位引入苯基来延长吲哚环的C2=C3双键的共轭体系,可以将ΔG(T1−S0)降至55.9 kcal/mol,并且在底物中进一步引入吸电子基团可以使ΔG(T1−S0)更小。自旋密度种群分析证实了T1状态下两个自旋排列电子的稳定效应是由上述底物变化引起的(Figure 2)。
(图片来源:J. Am. Chem. Soc.)
(图片来源:J. Am. Chem. Soc.)
(图片来源:J. Am. Chem. Soc.)
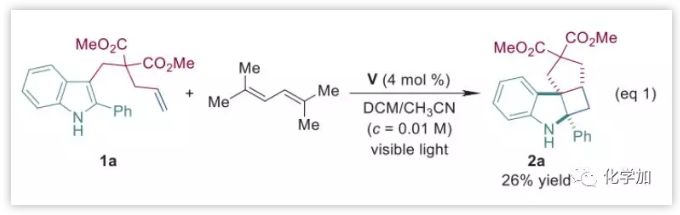
因此,作者将1a确定为改进的模型底物,并在24 W蓝光LED和光敏剂IV或V的照射下,顺利进行了[2+2]环加成以适中产率(52-57%)得到预期产物2a。随后,作者考察了反应参数包括浓度、溶剂和光敏剂的负载量,并发现在V(4 mol %)存在下,于DCM/CH3CN (3:1)的混合溶剂中以高稀释浓度(0.01 M)条件进行反应时,产率最佳(95%)。对照实验表明,在没有可见光或光敏剂存在下未发生反应。
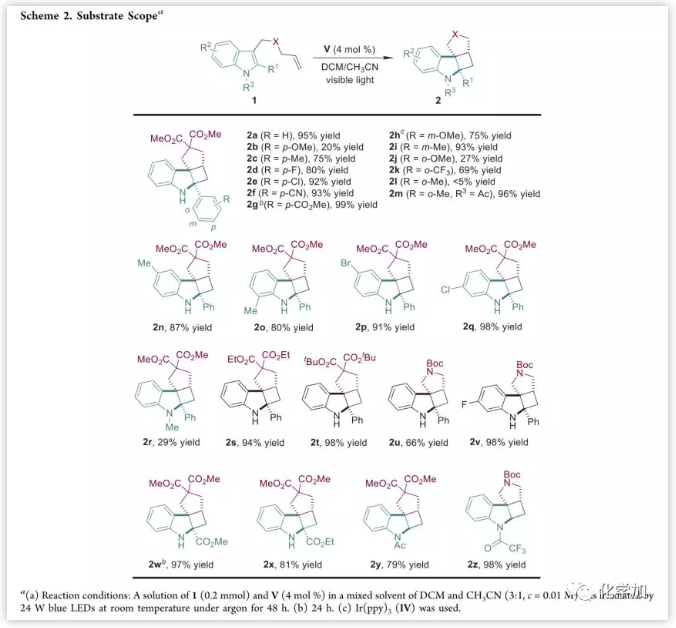
在优化条件下,作者探索了该反应的适用范围(Scheme 2)。在吲哚环上具有不同取代模式的底物都可以进行反应,并且引入吸电子基团对反应结果有益。在2-Ph的对位含有吸电子基团的底物可以良好的收率(80-99%)得到角四环螺二氢吲哚;在对位含有给电子基团时,反应效果较差(2b,20%);在间位含有-OMe和-Me时,反应效果较好(2h,75%; 2i,93%)。在2-Ph引入邻位取代基后,由于空间位阻影响导致反应效果较差(2j,27%; 2k,69%)。另外,在2-Ph吲哚的不同位置含有吸电子基团的底物比含有给电子基团的底物得到产物的产率更好。除丙二酸二甲酯外,还可以耐受其他连接基团如二乙基、丙二酸二叔丁酯和N-Boc。含有2-酯基的底物反应很好;引入N-吸电子保护基也可以提高反应性[2m, N-Ac, 2-(o-MeC6H4), 96% vs 2l, <5%],在没有2-取代基也一样(2y, N-Ac, 79%;2z, N-COCF3, 98%)。
(图片来源:J. Am. Chem. Soc.)
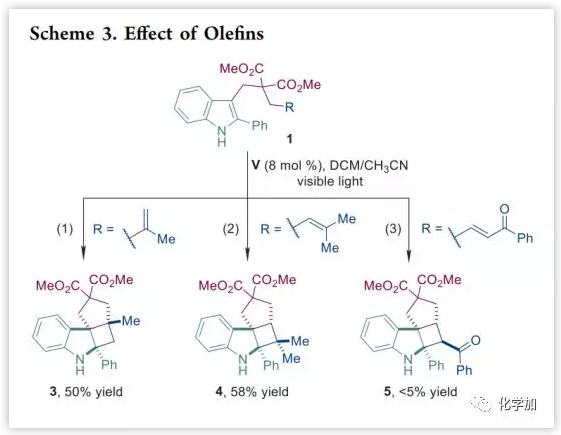
该方法还可以耐受含有取代烯烃的底物(Scheme 3),并且可以通过一步反应快速构建出具有三个连续季碳手性中心的高张力环丁烷稠合的角四环螺二氢吲哚(3,50%;4,58%)。此外,α,β-不饱和酮部分在这些条件下不是反应性配偶体(5,<5%)。
(图片来源:J. Am. Chem. Soc.)
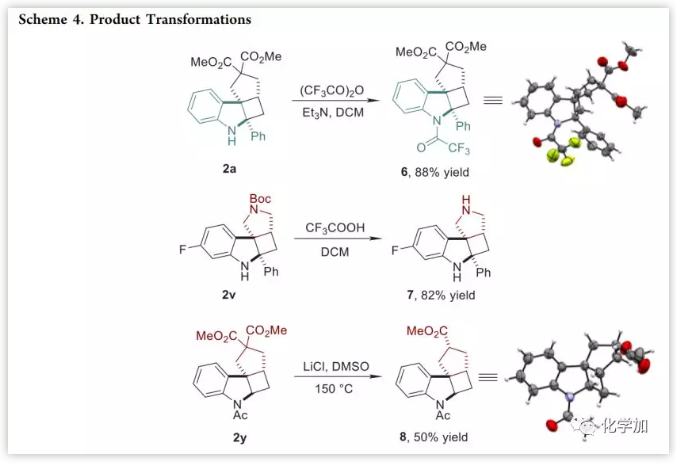
环丁烷稠合的四环螺二氢吲哚的转化(Scheme 4):利用三氟乙酸酐/Et3N对2a进行N-保护得到化合物6(88%);用三氟乙酸对2v进行脱N-Boc保护得到7(82%),裸露出两个NH易于进一步衍生化;在150 ℃、LiCl/DMSO条件下对2y进行单脱羧得到8(50%)。其中,6和8的结构通过X射线晶体学分析确定。
(图片来源:J. Am. Chem. Soc.)
机理研究
作者尝试通过实验和计算研究阐明这种[2+2]环加成反应的机理。首先,Stern-Volmer淬灭研究证实,光敏剂V的激发态易被底物1a淬灭(Figure 3)。通过循环伏安法实验测量了1a的氧化和还原电位(E1/2ox = +1.16 V,E1/2red = −0.44 V, vs Ag/AgCl in MeCN)。将其与所用光敏剂的值进行比较,发现氧化/还原电位(Figure 1)与反应性(Table 1)之间无明显相关性。 因此,该反应可能不涉及光诱导的单电子转移机制。
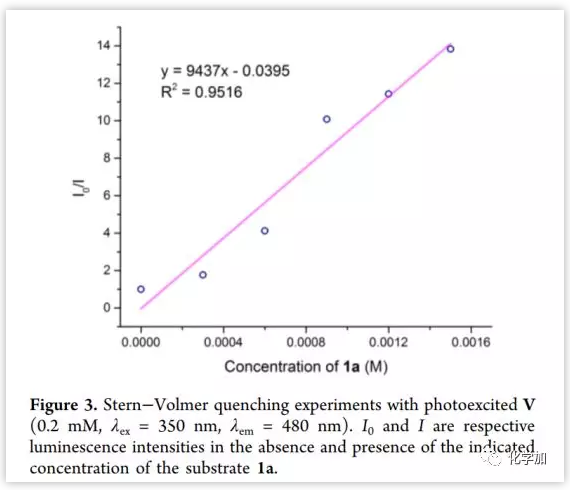
(图片来源:J. Am. Chem. Soc.)
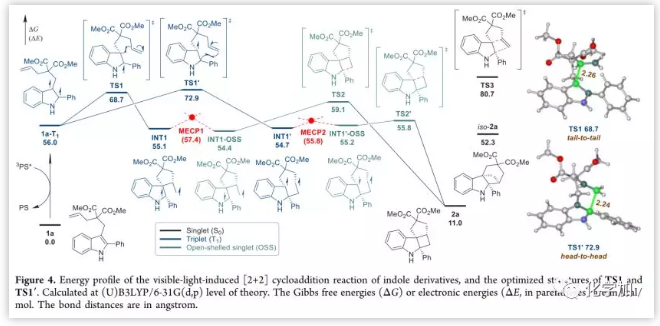
另一方面,在2,5-二甲基己-2,4-二烯(三重态淬灭剂,1 eq.)存在下,反应受到显著抑制,这表明三重激发态中间体参与这种[2+2]环加成反应。此外,底物的ΔG(T1-S0)值与去芳香化产物的分离产率具有相关性(Figure 2),ΔG(T1-S0)值小于光敏剂的吲哚衍生物也顺利反应。可以确定的是,底物和光敏剂的ΔG(T1-S0)值之间的差异越大,观察到预期产物的产率越高。通过DFT计算进一步研究了反应机理(Figure 4)。1a (0.0 kcal/mol)被激发至其T1态(56.0 kcal/mol),两个单电子主要位于吲哚环的C2和C3位,二者均可以通过尾对尾(TS1, 68.7 kcal/mol)或头对头(TS1′, 72.9 kcal/mol)过渡态对末端烯烃进攻产生螺[4.4] (INT1-T1, 55.1 kcal/mol)或桥接[5.3.0] (INT1′-T1, 54.7 kcal/mol)双环中间体。在这两种过渡态中,形成的C-C键的距离分别为2.26 Å (TS1)和2.24 Å (TS1′)。INT1-T1和INT1'分别可通过最小能量交叉点MECP1 (57.4 kcal/mol)和MECP2 (55.8 kcal/mol)转化为相应的单重态对应物(INT1-OSS, 54.4 kcal/mol;INT1′-OSS, 55.2 kcal/mol)。通过两种自由基-自由基结合过渡态(TS2, 59.1 kcal/mol或TS2′, 55.8 kcal/mol)得到预期产物(2a,11.0 kcal/mol),其能量远高于1a的能量,并且在加热条件下(TS3, 80.7 kcal/mol), [2+2]环加成是能量禁止的;然而,[2+2]环加成在激发态容易进行。尾对尾环化途径的能垒仅为12.7 kcal/mol (TS1 对于1a-T1),这表明了光致激发态反应在开发新的去芳构化中的巨大优势。此外,生成桥接[3.1.1]双环产物iso-2a(52.3 kcal/mol)的反应途径是相当不利的,通过头对尾环化过渡状态的尝试均告失败。
(图片来源:J. Am. Chem. Soc.)
(图片来源:J. Am. Chem. Soc.)
小结:游书力团队通过能量转移机制开发了可见光促进的含吲哚环的末端烯烃的分子内[2+2]环加成反应,可以在极其温和的条件下以良好的产率和优异的选择性快速构建出具有高度张力的环丁烷稠合的角四环螺二氢吲哚。此外,作者还通过组合实验研究和DFT计算探索了反应机理和结构-反应性关系。
撰稿人:爽爽的朝阳
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn