

吡啶衍生物是许多药物及生物活性分子中非常重要的结构单元,是美国FDA批准的药物中包含最多的氮杂芳环,因此关于吡啶环系的构筑和修饰具有十分重要的研究意义。目前报导的关于吡啶直接C-H键官能团化的方法还仅限于获得消旋的产物,关于对映选择性C-H键活化的报导很少,而且均是在2-位。日本理化所侯召民等人发展了Sc-催化的吡啶6-位C-H键的烷基化,但是吡啶3-位或4-位的不对称的C-H键活化还未曾有过报导。
5,6,7,8-四氢喹啉(THQ)及5,6,7,8-四氢异喹啉(THIQ)衍生物是药物分子中非常常见的结构。
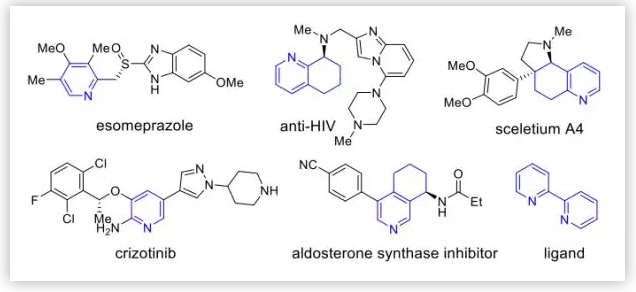
Figure 1. 含有吡啶环的药物分子及天然产物(图片来源:J. Am. Chem. Soc.)
目前已经发展了很多合成THQs及THIQs的方法,但是对映选择性的获取该类手性分子的方法几乎没有报道。目前获取该类化合物的方式主要是通过吡啶类似物的氢化,但是对于高度稳定的芳香体系的选择性氢化是很难实现的。Kuwano等人能够以82%的ee值合成5,6,7,8-THQs 及 -THIQs,这是目前报道的最高水平。本文作者开发了一种利用镍催化剂催化与吡啶连接的烯烃来实现吡啶区域选择性、立体选择性的官能团化,高效的合成了光学活性的THQs及THIQs (Scheme 1)。使用该体系,作者提出仍然需要面临三个强大的挑战:1.在Ni-催化的条件下,烯烃底物很容易发生异构化,必须抑制这一过程的发生;2.烯烃及吡啶完全的位点控制十分困难;3. Ni-催化的C-H键的官能团化目前鲜有报道,Ni对于配体及底物十分敏感,会极大的限制配体及底物范围。
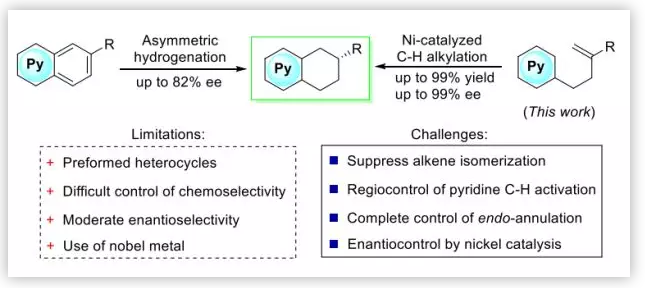
Scheme 1. 5,6,7,8-THQs及5,6,7,8-THIQs不对称合成方法(图片来源:J. Am. Chem. Soc.)
作者之前发展了一些N-杂环卡宾配体(NHCs),如SIPE和ANIPE,并成功实现了首例Ni-催化的炔烃对醇的不对称的烯基化反应,作者将此体系应用到吡啶的C-H键活化中去,来实现THQs及THIQs手性合成。
反应条件优化:作者受Nakao 及 Hiyama 等人在Ni-Al催化剂方面的工作以及Cramer及叶萌春等人在N-杂环不对称C-H键活化方面工作的启发,使用连有烯烃的吡啶1a作为模型底物,在Ni(cod)2存在下,使用含Al的Lewis酸及手性配体。作者最开始使用常见的手性膦配体及NHC配体,无法得到目标产物2a。使用配体L1并额外添加大位阻化合物MAD,可以以几乎当量的产率及72% ee值获得2a (Table 1, entry 1),而且没有观察到任何发生在吡啶2-位环化及烯烃移位的产物。作者推测主要是MAD通过Al-N配位,利用其大位阻屏蔽了2-位的反应位点。关于烯烃,作者认为与Ni配位的大位阻配体导致发生了反马氏规则的芳氢化。作者尝试使用更大位阻配体L2,L3,对映选择性不断提高(entries 2-3)。使用作者之前开发的SIPE类型的配体,对映选择性明显提高(entries 4-6)。使用不饱和的NHC L7配体,产率及对映选择性均明显下降(entry 7)。此外,作者尝试了其它Lewis酸AlMe3 及 AlEt3 均没有MAD效果好(entries 8-9)。控制实验证明Ni、MAD、NHCs对于该反应均是至关重要的(entries 10-12)。
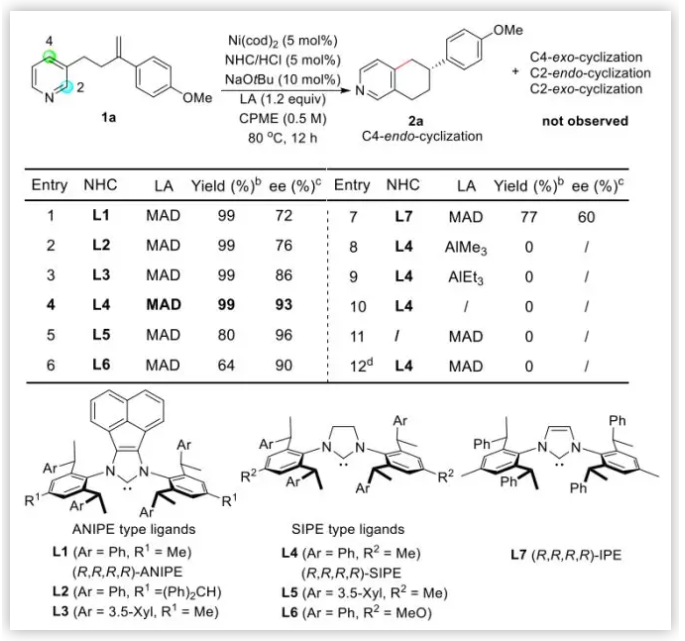
Table 1. 反应条件优化(图片来源:J. Am. Chem. Soc.)
底物拓展:作者以与吡啶3-位相连的烯烃进行底物拓展(Table 2),均可以以完全的区域选择性,中等到优秀的收率及非常好的立体选择性获5,6,7,8-THIQs。烯烃上取代基的立体效应对于反应的影响很小,2c-2f,2q均能以良好的收率及立体选择性获得。苯乙烯类型的底物无论苯环上连有供电子取代基(1a,1g,1i,1j,1k)还是弱吸电子取代基(1h),反应均能很好进行。如酰胺这种可以提供质子的底物可以获得很高的收率及极好的对映选择性,但是酯类底物如1m产率很低而且会发生烯烃的异构化。一些含有杂环的底物如1k,1n,1o,1x,1y均能兼容。除了1,1,二取代烯烃及苯乙烯类底物外,三取代烯烃(1v)及烯胺均能以较高的收率及极好的对映选择性获得产物。五元并环的吡啶依然能够获得(2w)。作者也尝试了吡啶环含有取代基的底物,同样能够兼容(1r,1s)作者随后以与吡啶2-位相连的烯烃进行了底物拓展,无论是1,1二取代烯烃类的底物(3a-3f),还是吡啶环上不同取代基的底物(3g,3h)均有良好的收率及立体选择性。作者使用与吡啶4-位相连的烯烃作为底物(5a),反应仍能顺利进行。最后作者以底物1c进行克级规模反应,可以以很高的产率及对映选择性获得产物2c。
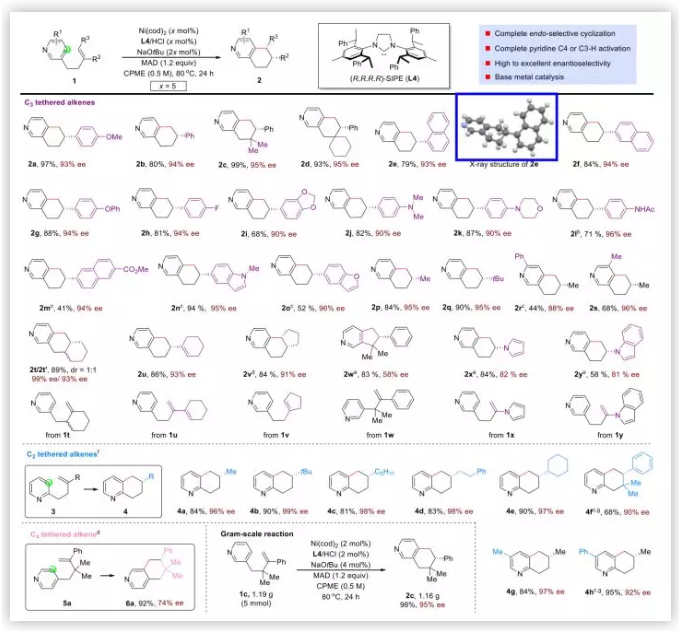
Table 2. 底物拓展(图片来源:J. Am. Chem. Soc.)
机理研究:首先,作者使用d-3a(96% D)作为底物进行反应,最终有92%D整合到烯烃的内部位置(Scheme 2A)。动力学同位素效应(KIE=2.5)表明C-H键断裂可能是决速步。有趣的是,作者使用底物3a在正辛烯存在下进行反应,几乎没有目标产物4a产生,而是获得了吡啶对位C-H键烷基化产物7,这表明对位的C-H键氧化加成可能是可逆且很快的(Scheme 2C)。此外,作者使用两种不同底物进行竞争实验,没有发生同位素的乱置现象(Scheme 2D)。
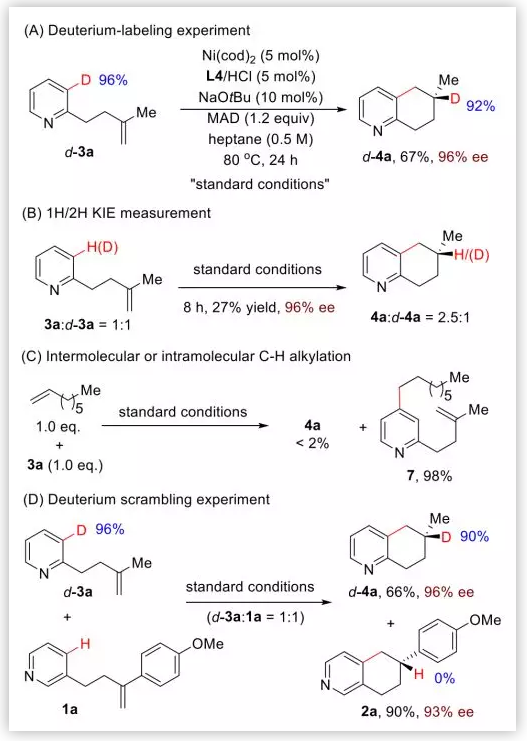
Scheme 2. 机理验证试验(图片来源:J. Am. Chem. Soc.)
基于以上实验结果,作者推测了反应的催化循环(Scheme 2E):(1)首先,大位阻的MAD与吡啶的N配位,挤压烯烃与Ni靠近发生配位;(2)随后,Ni发生C-D键的氧化加成;(3)然后,反马式的烯烃插入形成7元环;(4)最后,还原消除产生最终产物,催化剂再生。
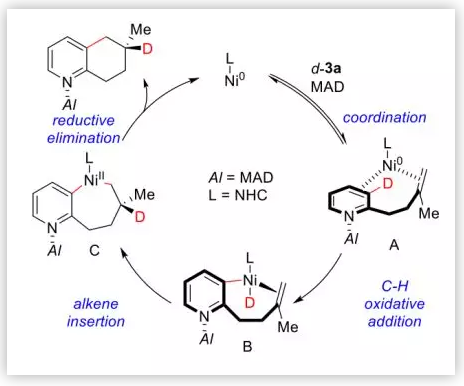
Scheme 2E. 推测的可能的催化循环(图片来源:J. Am. Chem. Soc.)
小结:上海有机所施世良课题组发展了第一例吡啶的不对称C-H键环化的方法,通过使用与吡啶相连的烯烃为底物,在Ni催化剂及手性NHC配体催化下,实现了吡啶3,4-位的C-H键的不对称烷基化。该方法为5,6,7,8-THQs 及 5,6,7,8-THIQs类化合物的获取提供了一种高效的方式,同时也拓展了Ni-NHC催化剂的应用范围。
撰稿人:超级玛丽
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn