

结核病(TB)是由结核分枝杆菌引起的一种传染病,是世界上主要的空气传播病原体之一。多重耐药结核病和广泛耐药结核病的发展和传播对全球公共卫生造成了显著威胁,因此,新的结核病化疗药物,特别是针对多重耐药结核病和广泛耐药结核病的化疗药物,有着极大的社会需求。Rodriguez等人从加勒比海牛鞭草中分离出了Pseudopteroxazole (1)和Ileabethoxazole (2)两种海洋苯并噁唑生物碱,1和2对结核分枝杆菌均有明显的抗菌活性。它们在抗结核药物开发上的潜力引起了有机合成化学家们的广泛关注。Corey等人用立体控制的阳离子环化过程实现了1的首例全合成和结构修定;Harmata等人通过苯并噻嗪化学合成了1;罗佗平等人基于环己烯酮的不对称共轭加成和立体选择性Cope重排,开发了一种针对1和其他天然产物的多样性和对映选择性合成方法;Williams等人通过铁介导的[2+2+1]碳环化实现了2的第一次全合成;李昂等人采用电环化/芳构化策略,完成了1,2和seco-pseudopteroxazole的集群式的全合成。近日,西北大学化学院胡向东教授课题组提出了一种新的对映选择性方法合成了1和2,相关成果发表在Angew上(DOI:10.1002/anie.201901651)。

图1. 目标分子结构及其逆合成分析(图片来源:Angew. Chem. Int. Ed.)
在结构上,1和2具有相同的A/B/D环系,在C2、C3和C4上具有相同的立体构型,不同之处在于C1上的取代基和构型以及C环的大小。考虑到Carreira课题组开发的不对称双催化烯丙基化反应有望可靠地引入醛6中的两个起始的手性中心(C2和C3),而且不对称双催化烯丙基化反应通过铱和胺催化的不同组合,可以促进四种立体异构体的合成,具有优良的对映选择性和良好的非对映选择性。因此,用该方法可以在1和2的C2和C3处得到非对映异构体。C环的形成,挑战是在1和2中的C1上构造相反的手性中心。Corey等人开发的立体控制阳离子环化反应是解决类似问题的有效方法。芳香环上具有不同电性的取代基可以通过不同的途径诱导阳离子环化,在C1上生成立体化学相反的产物。在此,作者设想,中间体5的阳离子环化也可能实现立体控制,并在1和2中为C1上两种相反的立体化学提供可靠的途径。在此基础上,采用分子内傅克反应生成环B。最后,C4羰基转化成甲基并引入噁唑环,分别完成1和2的全合成。
已知醛9与乙烯基溴化镁发生格氏反应,得到烯丙醇7。和丙醛8反应时,根据Carreira的不对称双催化烯丙基化反应,将[Ir/(S)-10]和(S)-11结合,在6中引入两种预期的立体化学。使用F2CHCO2H作为促进剂,能以10:1的非对映选择性和83%的产率得到6,并具有优秀的对映选择性(94%ee)。
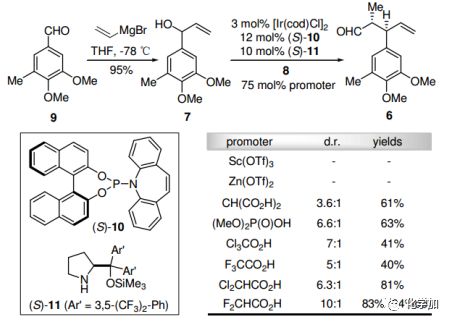
图2. 不对称双催化的烯丙基化反应条件筛选(图片来源:Angew. Chem. Int. Ed.)
醛6通过Wittig-Vedejs E-选择性烯烃化得到13,在甲磺酸作用下,13能以优秀的产率和非对映选择性发生阳离子环化反应得到14。值得注意的是,甲苯和DCM的共溶剂对非对映选择性至关重要。14的硼氢化-氧化反应得到醇15,产率72%,并经X-射线晶体衍射,确证了14中C1、C2和C3上的相对构型。在Hoveyda−Grubbs二代催化剂条件下,14和丙烯酸甲酯发生烯烃交叉复分解反应,然后进行Ni-催化的共轭还原,以优秀的产率得到化合物17。17皂化后得到羧酸18,经三氟乙酸酐处理,发生分子内傅克反应得到酮19。甲基锂亲核进攻19的酮羰基并用Et3SiH/TFA脱羟基,得到化合物21。将21的两个甲氧基保护脱除,随后用Kerr的方法引入噁唑环,就完成了(+)-Pseudopteroxazole (1)的全合成,其具有与天然产物相同的光谱数据和物理性质。
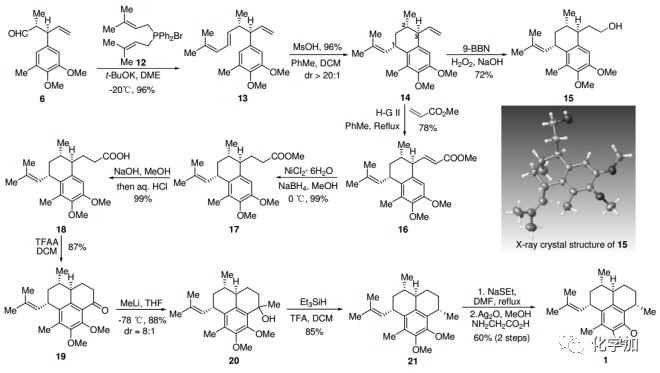
图3. Pseudopteroxazole (1)的合成路线(图片来源:Angew. Chem. Int. Ed.)
根据相同的策略,6和丙烯酸甲酯进行烯烃交叉复分解,然后乙烯基溴化镁亲核加成,生成醇23和24,比例为1:2.5。据Felkin-Anh模型,主要产物应为24。在BF3-Et2O条件下,24顺利进行环化反应,以约7:1的非对映异构体比例得到25。值得注意的是,在相同的条件下,23的环化也能形成25及其非对映异构体,比例为3:1。使用CuBr·Me2S/Red-Al对 α,β-不饱和酯25进行共轭还原,以90%的产率得到26。26皂化后发生傅克反应,得到酮27,构建了环B。C4中的甲基通过相同的程序——甲基化和脱羟基得到,得到单一产物29。
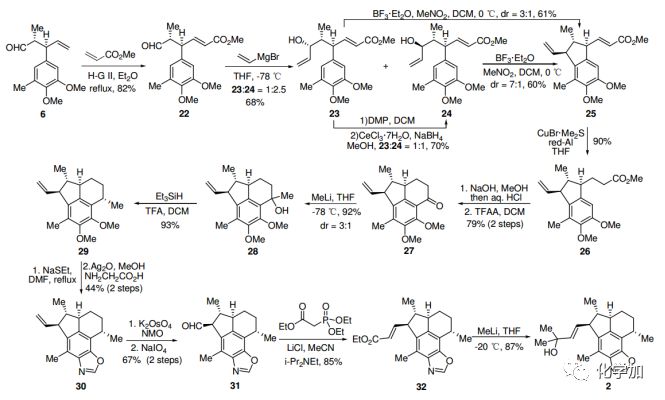
图4. Ileabethoxazole (2)的合成路线(图片来源:Angew. Chem. Int. Ed.)
继续采用Kerr方法引入噁唑环,两步产率44%,得到化合物30。30的末端双键二羟基化,随后氧化裂解形成醛31。31发生HWE反应得到α,β-不饱和酯32,经过量的甲基锂处理后,最终合成了(+)-Ileabethoxazole (2),其光谱数据和物理性质与报道的一致。

图5. 13和24的环化机理(图片来源:Angew. Chem. Int. Ed.)
虽然1和2的对映选择性全合成已经完成,但13和24的阳离子环化在14和25的C1上引入相反的构型,非常有趣,值得研究。为此,作者提出了如图5所示的一种立体化学控制的机制。对于13的阳离子环化反应,首先要通过甲磺酸的质子化生成中间体5a。接下来的过程可能受到三个因素的影响,第一种是C3取代基与芳香环之间的A1’3-相互作用,它倾向于氢在过渡态I和II 中,C3上的氢和芳香环共平面的构象。其次,根据Corey等人对这类阳离子环化的探索,在过渡态I和II中,宜采用螺五元环关环方式。第三,芳香环与异丁烯基之间的π-π相互作用将促进过渡态I的形成,从而导致螺中间体33的生成。33的1,2-迁移生成14,因此,π-π相互作用在C1的立体选择性中占主要地位。在24的环化反应中,相同的A1’3-相互作用将倾向于在过渡态III和IV中,C3上的氢和芳香环共平面的构象。芳环与过渡态乙烯基之间的π-π相互作用将通过并五元环模型促进中间体34的生成,最终形成25。值得注意的是,24的环化比23具有更好的立体选择性。这是因为羟基在24中的离去会直接导致过渡态Ⅲ的形成,因为C1的构型允许芳香环从羟基的背面进攻。在B3LYP/6-31g*水平上,用密度泛函理论(DFT)方法对该机理进行了计算,结果表明,π-π相互作用对13和24环化的非对映选择性起着重要作用。
总结:西北大学胡向东教授课题组完成了Pseudopteroxazole(1)和Ileabethoxazole (2)的不对称全合成。整条路线简洁高效,其关键步骤包括:通过Carreira的不对称双催化烯丙基化反应,在中间体6中构建了两个起始手性中心;13和24的阳离子环化提供了一种有效的途径,在1和2的C1上构建了相反的构型,这可能是通过π-π相互作用来控制阳离子环化的新版本。这条路线还具有立体选择多样性和结构多样性的特点,对系统研究该类天然产物的合成和生物活性具有重要意义。
撰稿人:诗路化语
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn