

过渡金属催化的不对称芳基-烷基交叉偶联反应受到化学家们的极大关注,且已经取得了不错的进展,但其催化剂用量较高,因此开发实用、有效的不对称芳基-烷基交叉偶联反应显得尤为重要。简单易得的α-卤代羰基化合物与芳基金属试剂的不对称交叉偶联反应是制备手性α-芳基羰基化合物最强有力的方法之一。Fu课题组、钟江春和边庆花团队以及Nakamura课题组已成功应用手性Ni,Co和Fe等过渡金属催化该类不对称交叉偶联反应,但其催化剂用量普遍> 5mol%(Scheme 1a)。若将上述催化剂换成低催化剂用量的Pd催化似乎是个不很好地解决办法。到目前为止,已有关于低催化剂用量的Pd催化α-溴代酯和苯硼酸的偶联反应的报道,但其主产物为苯硼酸发生自身偶联反应生成的还原酯和联苯(Scheme 1b)。在上述背景研究的基础上,中科院上海有机化学研究所汤文军团队报道了第一例Pd催化α-溴代酰胺化合物与芳基硼酸的不对称交叉偶联反应,能以良好的收率和优异的对映选择性得到一系列手性α-芳基酰胺化合物。
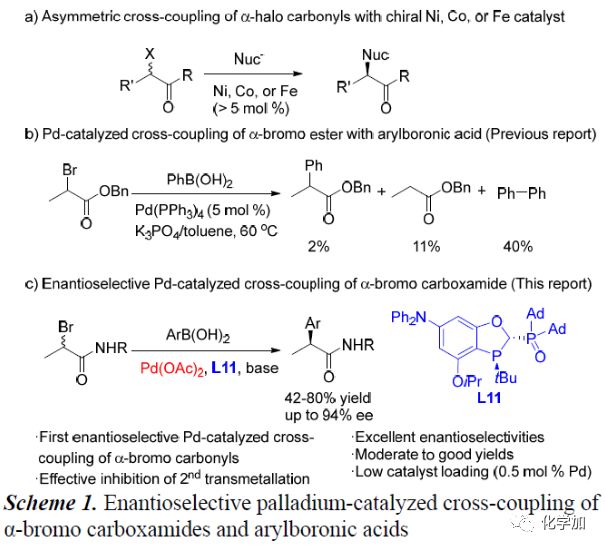
(图片来源:Angew. Chem. Int. Ed.)
Pd催化α-卤代羰基化合物与芳基硼酸的交叉偶联反应一直难以实现的主要原因是:Pd(0)中间体A促使α-卤代羰基化合物1发生氧化加成反应生成O-烯醇化物或C-烯醇化物B。B与芳基硼酸2发生过渡金属转移反应会生成Pd(II)中间体C。C一般不会直接发生还原消除反应得到偶联产物3,而会与芳基硼酸进行第二次过渡金属转移过程生成4和Pd(II)中间体D。紧接着,D发生还原消除反应生成5(Scheme 2)。为了得到理想的偶联产物3,作者猜想应用空间位阻较大的磷配体可以有效地抑制C的第二次金属转移反应,从而实现Pd催化α-溴羰基化合物的不对称交叉偶联反应。
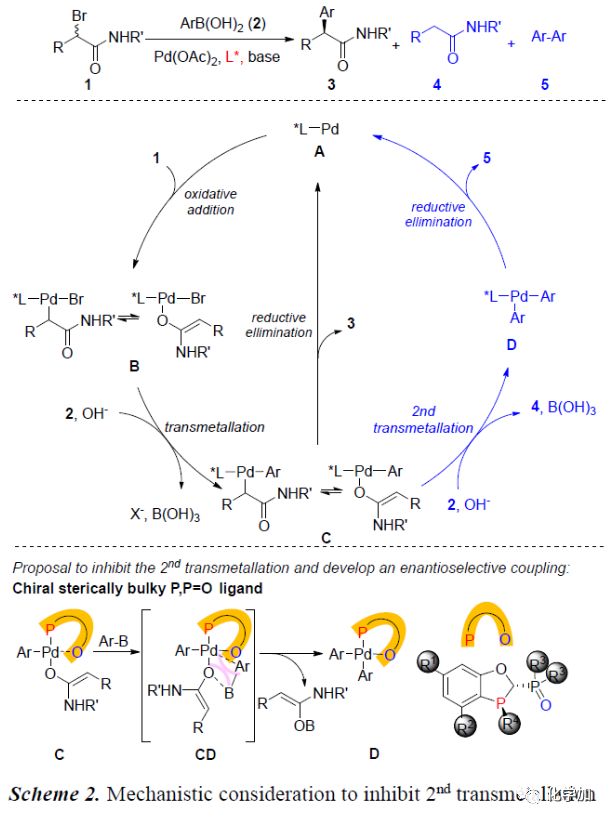
(图片来源:Angew. Chem. Int. Ed.)
以N-二苯甲基-2-溴丙酰胺1a和4-甲氧基苯硼酸2a为模板底物,作者对反应条件进行反复筛选,确定最优条件为(Table 1):N-二邻甲氧基苯甲基-2-溴丙酰胺1e和4-甲氧基苯硼酸2a为模板底物,1 mol% Pd(OAc)2和1.2 mol %L11为催化剂,2.0 equiv KF为碱,甲苯为溶剂,在60oC条件下反应48 h,能以77%的收率和91%的对映选择性得到目标产物。

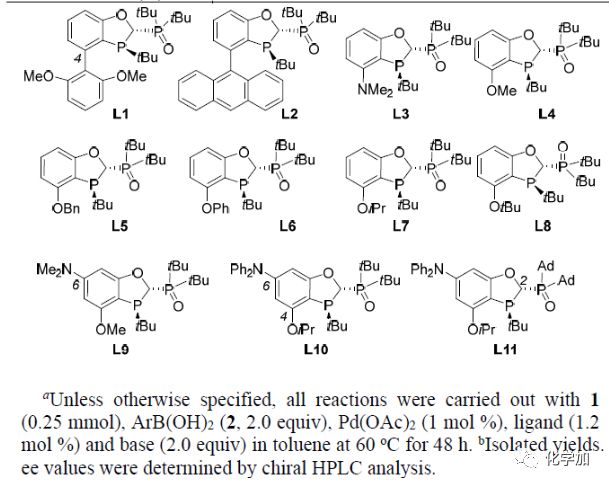
(图片来源:Angew. Chem. Int. Ed.)
在最优反应条件下,作者对该不对称偶联反应的底物范围进行了考察(Table 2)。对位给电子以及间位取代的α-芳基硼酸具有较好的耐受性,能以良好的收率和优秀的对映选择性得到相应产物。而邻位取代的α-芳基硼酸则表现出较低的对映选择性。各种3,4-二取代的芳基硼酸也能较好的适应反应条件,能以良好的收率和良好至优秀的对映选择性得到相应产物。但2-F,4-OMe-二取代芳基硼酸则只能以62%的收率和75%的对映选择性得到相应产物。萘硼酸、蒽硼酸以及杂芳基取代的硼酸也具有良好的耐受性,能以良好的收率和优秀的对映选择性得到相应产物。同时,各种α-溴代酰胺化合物均具有良好的耐受性,能以中等的收率和优秀的对映选择性得到相应的偶联产物,且影响其收率的主要原因是反应过程中伴随着β-H消除反应的副产物的生成。
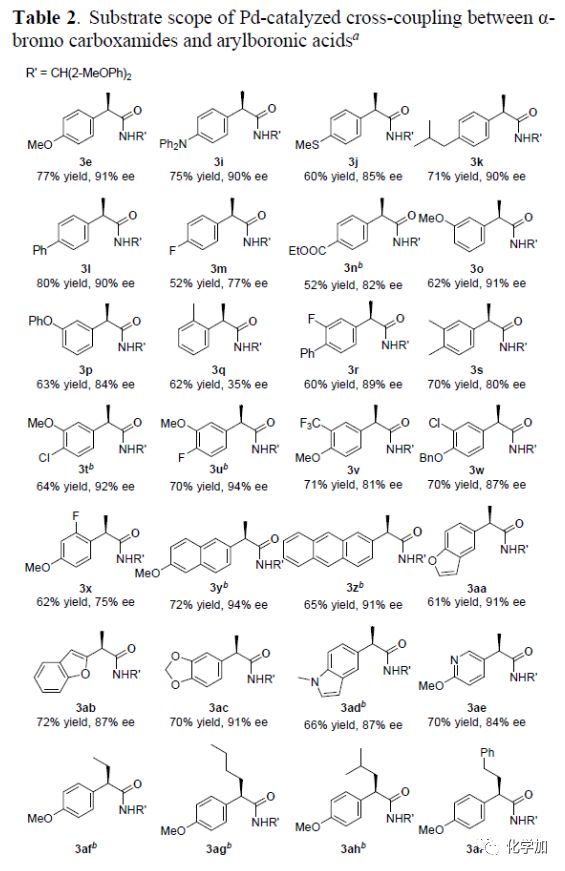
(图片来源:Angew. Chem. Int. Ed.)
外消旋α-溴代甲酰胺化合物能发生偶联反应,说明该交叉偶联反应为动力学拆分过程。为了进一步了解催化剂和络合物L11在该反应中所起的作用,作者进行了一系列对照实验(Scheme 3)。首先,作者分别制备了纯的(S)-1e和(R)-1e分别在标准条件下反应,发现:(S)-1e和(R)-1e均转化为相同构型的产物3e,但3e的对映选择性不同且(R)-1e的转化率高于(S)-1e的转化率(equations 1&2)。若将手性L11换成消旋的,其它条件保持不变,(R)-1e可以50%的转化率和52%的对映选择性得到相应产物(equations 3)。当反应转化率达到80%时终止反应,可以91%对映选择性分离出产物3e,同时以33%ee的对映选择性回收1e(equations 4)。标准条件下,不加入Pd催化剂,该反应不能得到目标产物(equations 5)。这些对照实验说明Pd催化剂决定反应能否发生,而手性配体决定产物的构型。

(图片来源:Angew. Chem. Int. Ed.)
作者提出了Pd(II)络合物在还原消除过程中的立体化学模型(Figure 1)。基于作者之前的报道以及空间位阻的影响,异构体A和B是还原消除过程最主要的中间体。其中,异构体B主要与还原消除或过渡金属转移过程相关,而异构体A则与偶联产物的生成以及产物的立体选择性相关。

(图片来源:Angew. Chem. Int. Ed.)
为了证明该反应的应用潜力,作者进行了一系列衍生反应合成各种治疗性药物(Scheme 4)。α-溴代羧酸6与NH2 CH(2-MeOPh)2在DCC和HOSu条件下可转化为酰胺8。8与2a可在Pd(OAc)2和L11催化作用下发生偶联反应生成9。9在TFA作用下脱掉R’保护基,紧接着,LiAlH4还原可得到伯胺10。10可在Ni催化作用下发生分子内C-N键偶联反应,能以80%的收率得到治疗神经系统疾病的药物11。同时,3k和3y在酸性高温条件下能良好的收率转化为非甾体类抗炎药布洛芬12和镇痛药萘普生13。为了证明该反应的实用性,作者又进行了克级反应,能以52%的收率和89%的对映选择性得到产物3r。3r在酸性高温条件下能转化为(R)-氟比洛芬15。

(图片来源:Angew. Chem. Int. Ed.)
小结:中科院上海有机化学研究所汤文军团队报道了第一例Pd催化α-溴代酰胺化合物与芳基硼酸的不对称交叉偶联反应,能以良好的收率和优异的对映选择性得到一系列手性α-芳基酰胺化合物。作者使用空间位阻较大的P,P = O配体可以有效地抑制第二次金属转移过程,成功的实现了Pd催化α-溴羰基化合物的不对称交叉偶联反应。该反应体系的催化剂用量低,且通过简单的衍生反应可转化为布洛芬,萘普生,氟比洛芬等抗炎药物。
撰稿人:暖冬
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn