

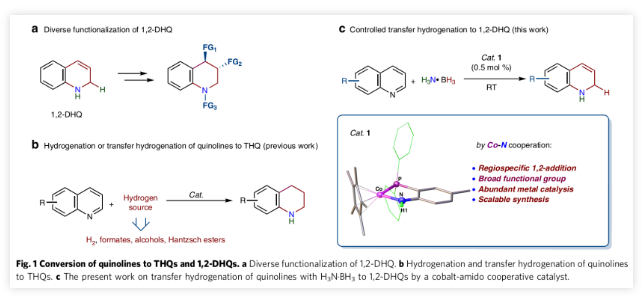
为了实现可持续的化学转化,类似于还原的烟酰胺腺嘌呤二核苷酸磷酸酯(NADPH)的结构,二氢喹啉(DHQs)也是H2的潜在替代物。更为重要的是,1,2-DHQ作为通用的合成子,在生物活性分子、药物、天然产物等方面有着广泛的应用。它们可以通过C-H官能团化方便地转化为复杂的有机结构,并可以实现不对称烯烃双官能团化和N-官能团化(Fig. 1a)。
苯的区域选择性催化氢化和对杂芳烃的转移加氢一直以来引起了人们的极大关注,而且在这一思路的指导下,就能直接获得所需的DHQ。目前,在将喹啉加氢生成四氢喹啉(THQs)反应方面已取得了重要进展(Fig. 1b),但迄今为止尚未发现直接生成DHQ的相关催化方法。催化获得1,2-DHQs的困难在于控制化学选择性和区域选择性,因为该反应始终会遭受反应性更大的DHQs过度还原为THQs的困扰。因而将喹啉催化转化为DHQ极具挑战性。
该领域的突破是近年来分别使用过渡金属催化剂或不含金属的有机催化剂,催化喹啉氢化硅烷化和硼氢化分别生成N-硅烷基化或N-硼化的1,2-DHQ。通过N-脱硅烷基或N-脱硼烷基保护可以作为合成1,2-DHQ的替代途径,但是,这样的氮保护/水解策略会遇到官能团相容性和复杂的纯化问题,因此发展一种直接合成1,2-DHQ的方法非常必要。
金属-配体协同催化机制是一种实用的策略,通过该策略设计新的催化剂可以进行精确的化学转化。近日,山东大学王文光课题组和华中科技大学廖荣臻课题组合作报道了在有效的钴-酰胺配合物的催化下,以H3N∙BH3作为氢源通过可控的部分加氢将喹啉氢化生成1,2-DHQ(Fig. 1c)。
(图片来源:Nat. Commun.)
控制实验表明,钴配合物催化该反应的进行,如果没有1则该反应不能发生。在优化条件下,即25 ℃下使用0.5 mol%的1在THF中,作者探索了底物范围(Fig. 2)。首先,将甲基变成苯基或者溴代基团,可以高收率获得相应的4-取代基-1,2-DHQ(3b,3c)。其次,种类繁多的喹啉如3-位上取代基团的Cl(2d),Br(2e), CH2OH(2f),COOC2H5(2g),NHCOCH3(2j),Bpin(2h),C = CPh(2l)和C≡CPh(2k)均以良好的产率得到了脱芳香化产物(3d-3l)。与酯基不同,酰基基团在这一过程中也会被氢化,3-乙酰基喹啉(2m)与两当量的H3N∙BH3反应可生成相应的羟基化合物(3m),产率为89%。可能是由于空间位阻对1,2-氢化的影响(3n),2-甲基喹啉的还原失败了。喹啉转移加氢后生成1,2-DHQ(3o)为固体。
通常,喹啉的区域选择性1,2-还原不受芳基环上功能基团的电子或空间性质的影响。各种功能化的1,2-DHQ(3p-3ad)在这种温和的催化条件下均获得的良好的收率。特别是卤素取代的喹啉对这一反应体系耐受性很好。虽然基于钴催化剂并且以H3N∙BH3作为氢源来氢化炔烃和烯烃已经有报道,但是在反应条件下二氢化反应还是选择性地发生在N-杂环的C=N键(3k,3l和3v)上。
该反应还可以有效地完成苯并噁唑,苯并噻唑,菲啶和吖啶的氢化反应并且都有极高的收率(3ae-3ah)。大多数1,2-DHQ可以方便地大规模合成而且通过X-射线单晶衍射确定了结构(3h,3u和3ag)。

(图片来源:Nat. Commun.)
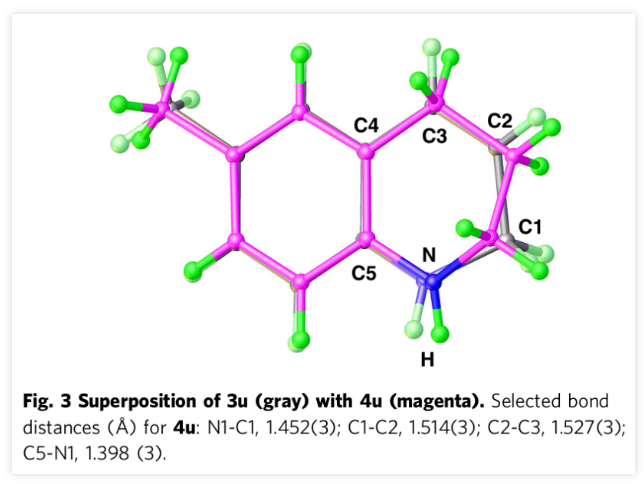
DHQ被看作是喹啉加氢生成THQ的关键中间体。实际上,在钴催化剂的存在下,H3N∙BH3可将1,2-DHQs进一步还原为THQs。在相同的条件下使用两当量的H3N∙BH3可将2u还原成4u而且产量极高。比较二氢化产物3u和四氢化产物4u在结构叠加部分间键距和键角,发现这两个化合物的杂环部分存在显著的差异(Fig. 3)。
(图片来源:Nat. Commun.)
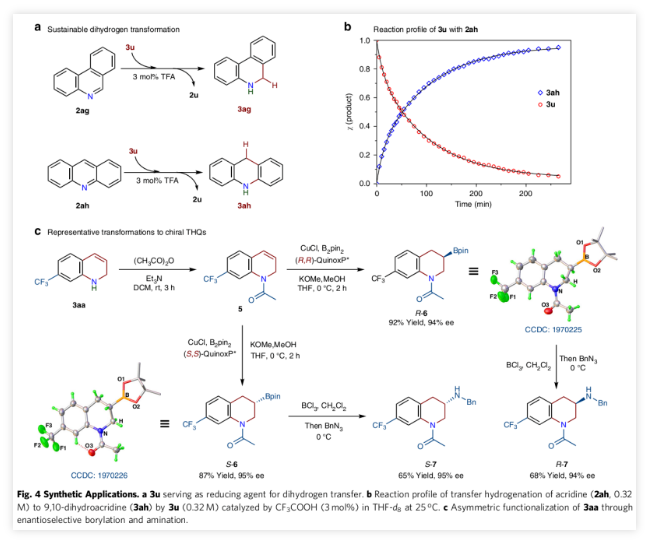
类似于氧化的和还原的烟酰胺腺嘌呤二核苷酸,作为部分饱和的杂芳族化合物,1,2-二氢喹啉既可以充当氢化物受体,也可以充当氢化物供体。在3 mol%的CF3COOH(TFA)存在下,3u可以将菲啶(2ag)定量还原为5,6-二氢菲啶(3ag),同样的条件下,3u也可以将吖啶(2ah)氢化为9,10-二氢吖啶(3ah)(Fig. 4a)。在酸催化下的氢转移反应未观察到3u歧化现象。
通过1H NMR的监测,得到的反应曲线可以清晰的看到3ah的浓度随时间增加与3u随时间的消耗量基本一致(Fig. 4b)。但是,3u在2,6-二甲基吡啶-3,5-二羧酸中稳定。这样的结果表明3u是一种温和的有机氢化试剂,并且其氢化供给能力(ΔHH-)小于Hantszch酯(ΔHH-= 69.3 kcal/mol)。
1,2-DHQ作为重要的合成中间体,可以生成各种氮杂环化合物,例如手性THQ和N-官能化DHQ,这在药物和天然产物中很常见。例如,通过酰化和对映选择性硼化,6-三氟甲基-二氢喹啉(3aa)顺利地转化为对映体3-硼基-四氢喹啉R-6(92%收率,94%ee)和S-6(87%收率,95%ee)(Fig. 4c)。随后将两种对映体胺化,可以构造一个新的C-N键,生成R-7和S-7化合物。对映异构体S-7的结构类似于正性肌力药物(S)-903和治疗帕金森的潜在药物Sumanirole。
(图片来源:Nat. Commun.)
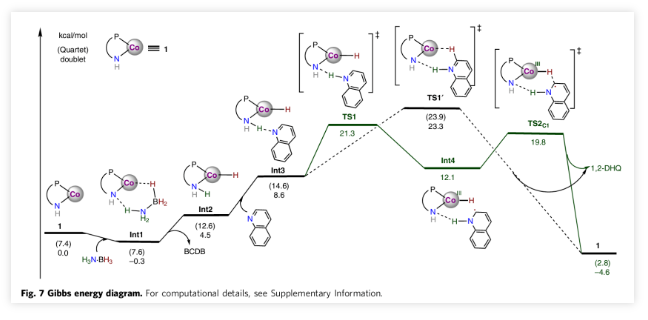
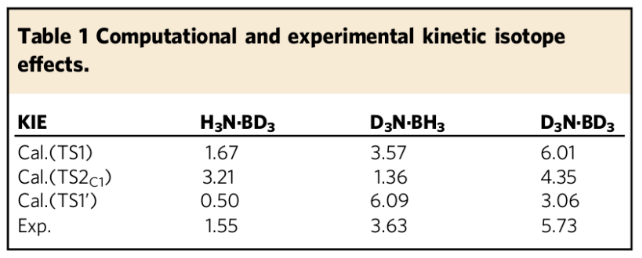
作者以密度泛函计算对该反应的详细机理和区域选择性进行了研究(Fig. 7)。确定TS2是区域选择性决定步骤并且区域选择性是由动力学所控制的,计算得到的能垒与经实验速率常数所算出的能垒一致。并由此,计算出1,2-/1,4-DHQ产物比为48.6:1,因此该反应主要生成1,2-还原产物。由TS1计算所得的DKIE值与实验值相符(Table. 1),这也验证了TS1是该反应的转化决定过渡态(TDTS)。
(图片来源:Nat. Commun.)
(图片来源:Nat. Commun.)
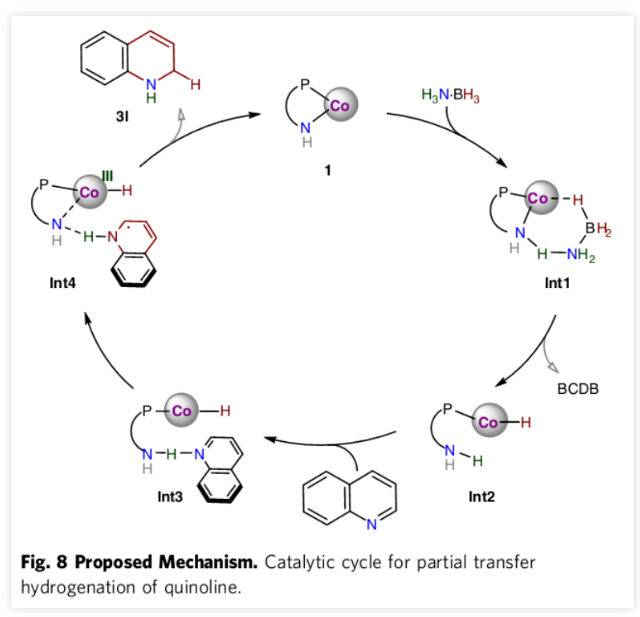
最后,作者提出了该反应的可能机理。辅以碱性位点,钴-酰胺基络合物(Co-NH)能够活化H3N∙BH3,生成氢化物-质子物种(HCo-NH(H)), Int2)进行氢转移。将实验数据与理论研究相结合,作者提出了逐步的H+- e- / H∙用于后续反应的机制。 C8H7N --- H-NH(Int3)的氢键引起质子从配体的氨基转移到喹啉的氮原子上并伴随着电子从金属中心的转移而生成Int4。在氢键与底物氮原子的相互作用下,酰胺基位置不仅有助于质子从NH3部分转移至氮原子,而且还将氢原子从Co(III)-H转移至2-位以得到1,2-还原产物。
(图片来源:Nat. Commun.)
总结:山东大学王文光课题组开发了高效的转移加氢方法将喹啉和杂芳烃底物氢化为1,2-氢化产物,通过钴-酰胺的协同作用,以H3N∙BH3作为质子/氢化物来源,在室温下使用等摩尔量的还原剂就可方便地实现该反应。该催化反应表现出广泛的官能团相容性并且可以大规模合成1,2-DHQ。实验和理论研究表明,关键的中间体氢化物-质子物种(HCo-NH(H)) 通过氢键与底物作用,其酰胺位对质子转移至关重要并由此完成了1,2-氢化过程。
撰稿人:Turro
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn