- 首页
- 资讯
清华罗三中课题组Angew. 电化学原位生成苯炔用于环状β-酮羰基化合物的不对称α-芳基化反应
来源:化学加编辑部 杉杉 2020-06-22
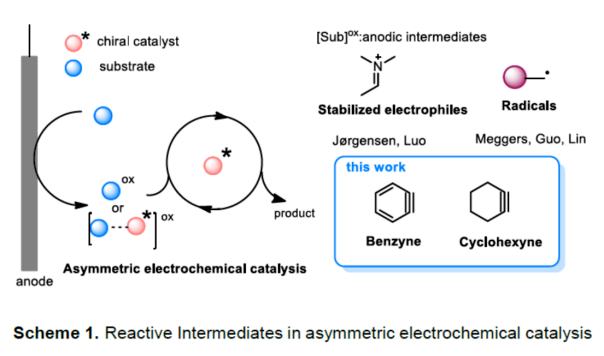
导读:由于苯炔是高反应活性和非极性的中间体,基于苯炔中间体的不对称催化是挑战性难题。近日,清华大学罗三中教授课题组在Angew发表论文,报道了一种电化学氧化生成苯炔和环己炔中间体的方法,并成功与手性伯胺催化相结合,从而实现第一例催化不对称烯胺-苯炔(环己炔)的偶联反应。研究发现乙酸钴可稳定原位生成的芳炔中间体并促进其与烯胺的偶联。此外,该催化体系可用于构建具有季碳手性中心的α-芳基或环己烯衍生物。文章链接DOI:10.1002/anie.202006016
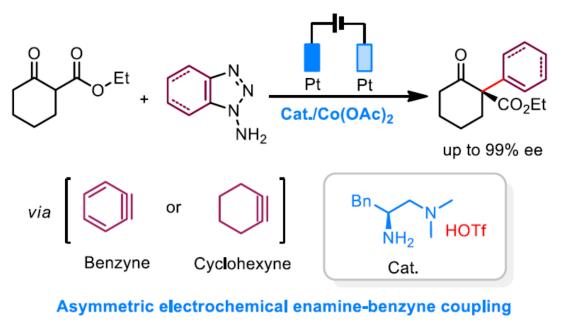
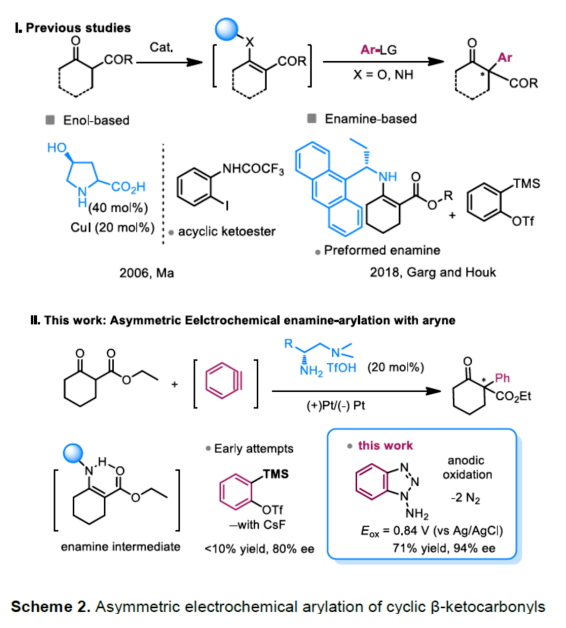
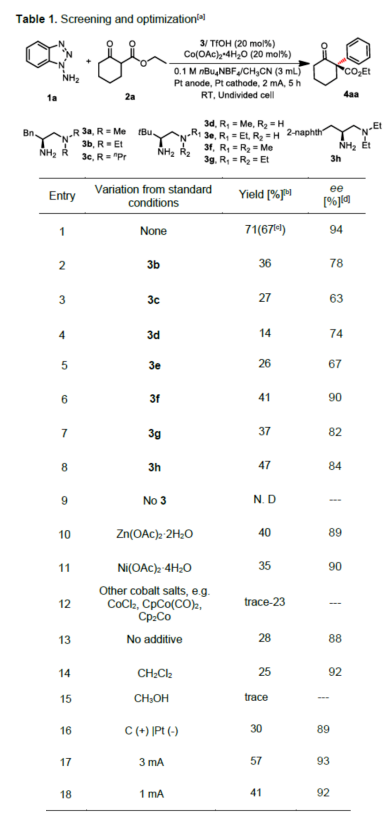
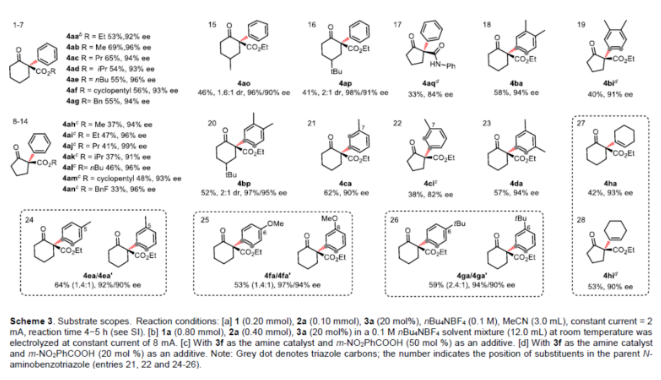
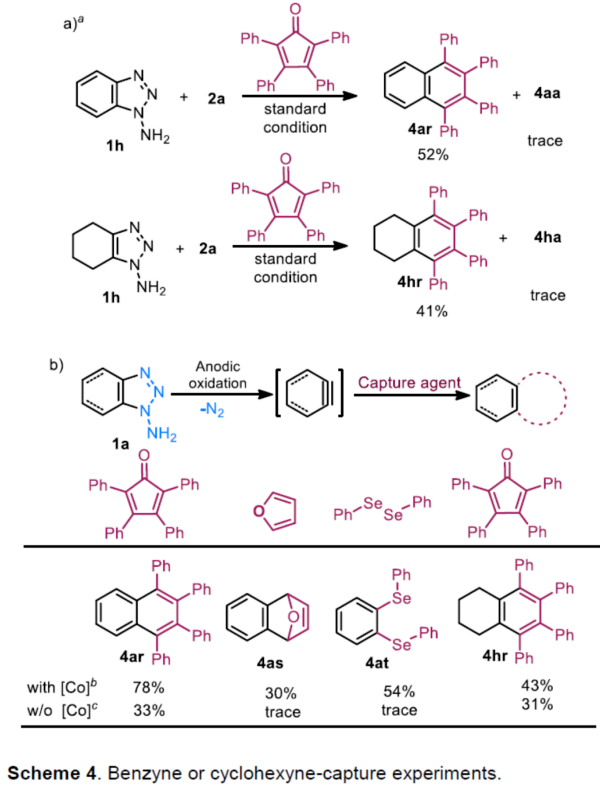
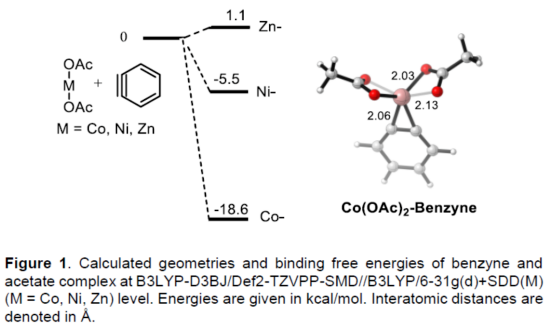
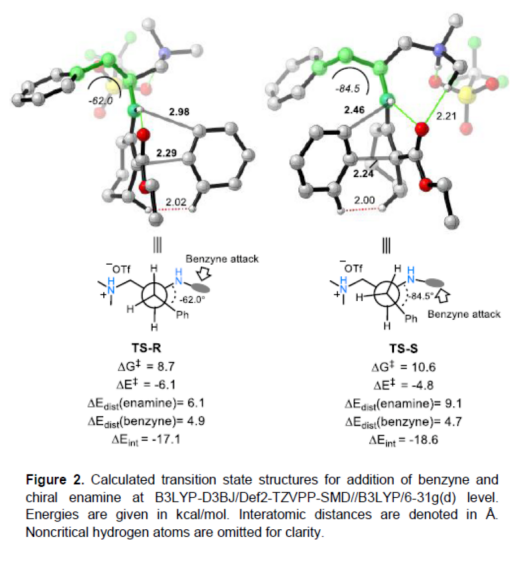
(图片来源:Angew. Chem. Int. Ed.)早在1966年就有不对称电化学催化相关的报道,然而由于不对称催化的成功和近期光化学反应的突破进展,从而导致该领域的研究未被高度关注。同时,该领域主要的挑战可能至少来自这样一种先入为主的观念,在电化学反应必不可少的导电介质中,可能对立体控制产生不利的影响。此外,不同于典型的溶液相不对称催化反应,不对称电催化存在非均相电子转移过程。近年来,由于绿色化学和可持续发展的需求,不对称电化学催化已成为研究的热点(Scheme 1)。Jørgensen和罗三中等课题组报道了阳极氧化可用于不对称氨基催化过程中,可生成稳定的亲电体(如亚胺或亚胺阳离子中间体)。最近,Meggers、郭昌和林松课题组报道了通过阳极产生的自由基实现不对称催化反应。尽管目前已取得一定的进展,但不对称电化学催化的潜力仍未得到充分探索。在此,清华大学罗三中课题组报道了通过阳极氧化生成苯炔或环己炔中间体,随后在手性伯胺催化下,即可实现不对称芳基化反应。(图片来源:Angew. Chem. Int. Ed.)苯炔很少用于不对称催化反应中,因为这种中性和高反应性物质的猝灭通常是自发发生的,在大多数情况下超过任何明显的外部控制。同时,苯炔的捕获总是伴随着不希望的键形成和断裂,从而增加了立体控制的复杂性。因此,苯炔参与的不对称反应极为罕见。最近,Garg和Houk报道通过预先制备的手性烯胺和苯炔实现不对称偶联反应(Scheme 2, I)。受此启发,作者试图使用手性伯胺催化剂,实现β-酮酯与苯炔的催化烯胺芳基化反应。此前马大为课题组报道了唯一例β-酮酯的高对映选择性的催化反应,即2-乙酸乙酰甲酯与2-碘代三氟乙酰苯胺的偶联(Scheme 2, I)。作者使用手性伯胺催化剂,初步研究了环状酮酸酯2a与经典的Kobayashi苯炔前体(2-(三甲基甲硅烷基)苯基三氟甲磺酸酯)的偶联反应。尽管反应得到了的80%ee,但进一步优化条件,产率也从未超过10%(Scheme 2, II)。因此,作者尝试了其他的苯炔前体以及由Campbell和Rees开发的1-氨基苯并三唑。这一前体可在氧化条件生成苯炔中间体,但通常需使用高毒性的Pb(OAc)4作为氧化剂,从而导致反应经济性、可持续性、兼容性等问题。然而,电化学氧化可以解决这些问题。(图片来源:Angew. Chem. Int. Ed.)首先,作者以1-氨基苯并三唑(1a)和2-环己酮甲酸酯(2a)作为模型底物,分别对手性伯胺催化剂、金属添加剂、溶剂、电极材料、电流等条件进行了广泛的筛选(Table 1)。筛选结果表明,当以手性伯胺3a作为催化剂,Pt作为阳极和阴极,nBu4NBF4作为电解质,在室温下的无隔膜电解槽中反应,能以71%收率和94%ee得到预期产物4aa。(图片来源:Angew. Chem. Int. Ed.)在获得上述最佳反应条件之后,作者首先对β-酮羰基化合物的底物范围进行了扩展(Scheme 3)。当2-环己酮甲酸酯中的酯被其它基团(如甲基、乙基、正丙基、异丙基、正丁基、环戊基和苄基酯基)取代时,均可获得高收率和高对映选择性的目标产物4aa-4ag。4-取代的2-环己酮甲酸酯,也可获得不对称芳基化产物4ao和4ap,虽然非对映选择性较低,但两种对映异构体均具有较高的对映选择性。而以2-环戊酮甲酸酯作为底物时,同样可以获得相应的产物4ah-4an,此时手性伯胺催化剂3f给出了更好的对映选择性,从而。此外,2-环戊酮甲酰胺也可获得α-芳基化产物4aq。然而,使用非环状的β-酮酸酯未能获得所需的产物。随后,作者研究了1-氨基苯并三唑不同位置取代基对反应的影响。对于对称的二甲基取代苯炔(如邻二甲基、间二甲基取代),均以良好的收率和高对映选择性获得预期产物4ba,4bi,4bp,4da。对于单取代苯炔,邻甲基取代获得具有高对映选择性的产物4ca,4ci。此外,对于间甲基取代的苯炔(或芳烃),观察到两个区域异构体4ea和4ea’,但两种区域异构体均具有高对映选择性。同样,使用甲氧基和叔丁基取代甲基时,也观察到了类似的结果4fa(4fa’)和4ga(4ga’)。此外,使用环己炔时,同样可以获得具有良好立体选择性的α-环己烯化产物4ha和4hi。 (图片来源:Angew. Chem. Int. Ed.)为了探究原位生成的苯或环己炔中间体,作者在该催化反应中加入两当量的四苯基环戊二烯酮(淬灭剂),分别以52%和41%的收率获得相应的淬灭加合物(4ar和4hr)(Scheme 4, a),并且检测到痕量的烯胺偶联产物。这些结果表明,电化学可生成高反应性的苯炔或环己炔中间体。此外,在不存在乙酸钴的情况下,在阳极条件下仅检测到痕量的淬灭加合物(Scheme 4, b),而三唑底物1a被完全消耗,阳极上沉积了未知的棕色焦油物。相反,加入乙酸钴可大大促进苯炔的淬灭,同时阳极沉积也减少。因此,根据钴在炔烃活化和转化中的催化能力,作者认为钴可以与苯炔的三键结合,从而起到稳定苯炔中间体并增强其与烯胺中间体偶联的作用。 (图片来源:Angew. Chem. Int. Ed.)此外,作者也通过密度泛函理论(DFT)计算揭示了乙酸钴对苯炔的稳定作用。计算结果表明,乙酸钴与苯炔的结合自由能为-18.6 kcal/mol,乙酸镍为-5.5 kcal/mol,而醋酸锌为1.1 kcal/mol(Figure 1)。同时,该配位对烯胺中立体控制影响很小。因此,苯炔-钴配合物可能是游离苯炔在阳极条件下捕集烯胺的“储存库”。(图片来源:Angew. Chem. Int. Ed.)随后,作者又通过DFT计算进一步阐明α-芳基化对映选择性的起源(Figure 2)。TS-R和TS-S之间的计算能量差为1.9 kcal/mol,与2.1 kcal/mol的实验值非常吻合,从而有利于R的选择性。在这两个过渡态中,烯胺N-H和羰基分子内H键被认为限制了构象灵活性,并且形变主要来自催化剂部分。在TS-R中,以绿色突出显示的催化剂骨架的二面角(-62.0o),与起始烯胺中间体的二面角(-66.0o)相差不大。相比之下,不利的TS-S二面角为-84.5o,构象形变较大,以最小化苯炔的进攻的位阻效应影响。(图片来源:Angew. Chem. Int. Ed.)总结:清华大学罗三中教授课题组报道了一种通过电化学阳极生成苯炔中间体的方法,并成功与手性伯胺催化相结合,实现了第一例催化不对称烯胺-苯炔(环己炔)的偶联反应。同时,乙酸钴作为添加剂可以稳定原位生成的苯炔中间体,并促进其与手性烯胺中间体的偶联。烯胺-苯炔偶联可用于高立体选择性的合成环状β-酮羰基化合物的α-芳基化或α-环己烯基化衍生物。
撰稿人:杉杉
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn