

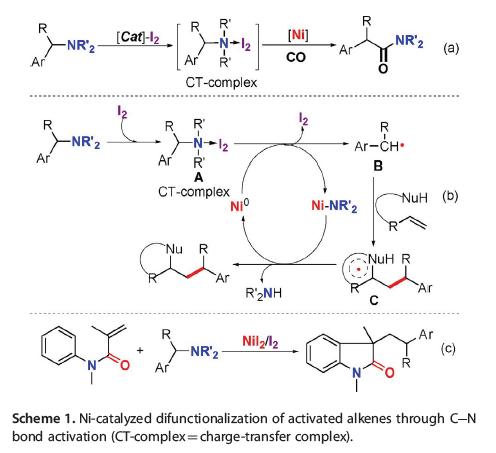
近年来,中国科学院兰州化学物理研究所和中国科学技术大学的黄汉民教授和兰州化学物理研究所的胡斌研究员合作在过渡金属催化的C-N键活化研究领域取得了一系列重要研究进展。2017年,团队开发了一种碘介导的苄胺C-N键活化反应,并利用金属镍催化实现了一氧化碳对C-N键的插入反应(Scheme 1a)。近日,团队在以往研究的基础上利用镍催化的C-N键活化实现了苄胺向苄基自由基的转化,并成功将其应用于烷基取代吲哚酮及二氢喹啉酮的合成(Scheme 1b和1c)。相关研究成果发表在Chem. Eur. J.上(DOI: 10.1002/chem.201800543)。
(来源:Chem. Eur. J.)
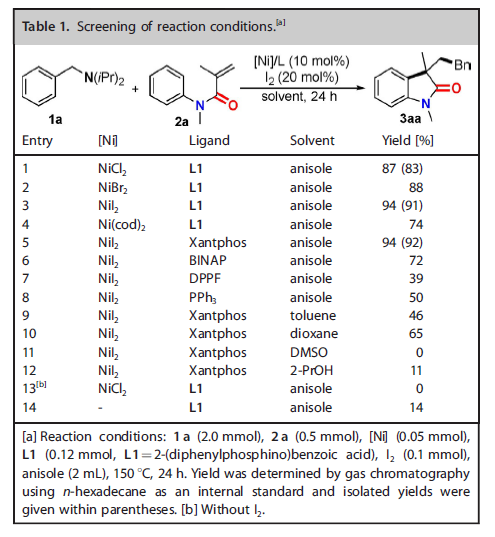
首先,作者以N,N-二异丙基苄胺(1a)和N-甲基-N-苯基甲基丙烯酰胺(2a)为模型底物对反应条件进行了筛选(Table 1)。以10 mol%的NiI2和20 mol%的碘作为催化剂,Xantphos作为配体,150 ℃下反应24小时,作者得到了分离产率为92%的目标产物3a(entry 5)。对照实验表明碘和金属镍对苄胺C-N键的活化是必要的。
(来源:Chem. Eur. J.)
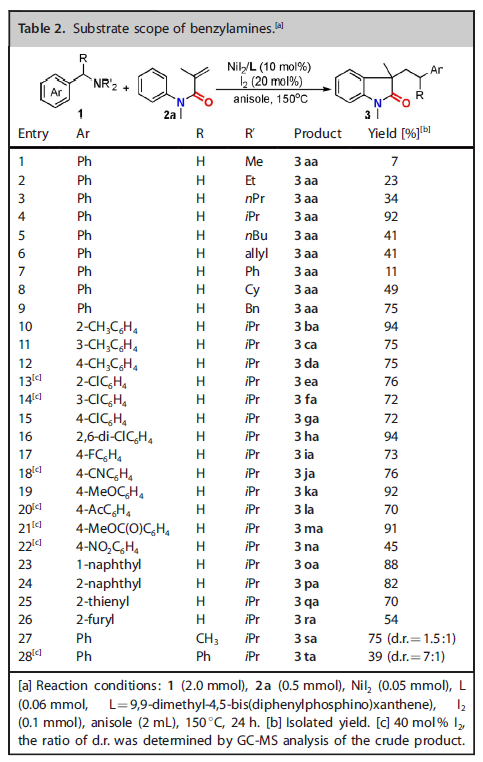
随后,作者对苄胺的底物适用性进行了考察(Table 2)。三级胺氮原子上的取代基对反应影响比较大,只有当取代基为异丙基或苄基时,反应可以获得良好的产率。苯环上取代基的电性及取代基的位置对反应的影响并不明显,反应均可以获得比较好的产率。其它芳环如萘环、噻吩环、呋喃环在反应中具有很好的耐受性。
(来源:Chem. Eur. J.)
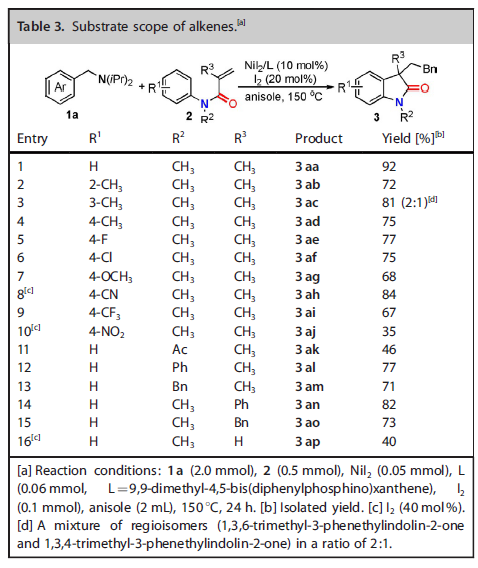
紧接着,作者考察了活泼烯烃的底物范围(Table 3)。富电子及缺电子芳环取代的α-取代丙烯酰胺均具有良好的反应活性。间甲基取代的底物2c可以与1a反应生成两种异构体的混合物3ac。氮原子上取代基为乙酰基、苯基和苄基时反应也可以顺利进行。
(来源:Chem. Eur. J.)
除了α-取代的丙烯酰胺,β-取代的丙烯酰胺2q也适用于该类型的转化(Table 4)。当碘的量增加到40 mol%时,2q可以与含有不同取代基的芳胺及杂芳胺进行反应,并以良好的产率得到相应的目标产物。产物中的两个非对映异构体可通过柱层析进行分离纯化。
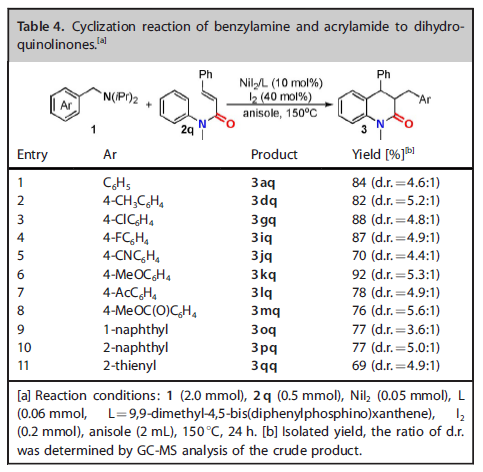
(来源:Chem. Eur. J.)
结语:兰化所和中科大的黄汉民教授与兰化所的胡斌研究员合作开发了一种新型的镍催化苄胺C-N键活化反应,并借助苄胺与α或β-取代丙烯酰胺的自由基加成/环化反应合成了一系列具有生物活性的吲哚酮及二氢喹啉酮类化合物。该反应不需要氧化剂,并且具有良好的底物适用性。
参考资料
[1]ChemBeanGo,【有机】兰化所和中科大的黄汉民教授与兰化所胡斌研究员合作通过镍催化C-N键活化实现活泼烯烃与苄胺的烷基芳化反应
[2]Nickel‐Catalyzed Alkylarylation of Activated Alkenes with Benzyl‐amines via C−N Bond Activation,Hui Yu,Bin Hu,Hanmin Huang,https://doi.org/10.1002/chem.201800543
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn