

然而,许多表观遗传调节蛋白尚无有效的抑制剂/激活剂,因此,发挥这些修饰的协同作用面临巨大挑战。最近研究发现,干扰线粒体代谢和铁稳态是非常有前景的抗癌策略。线粒体代谢中的中间产物是组蛋白/DNA/RNA去甲基化酶的辅因子或天然的抑制剂;而铁则是这些生物大分子Fe(II)/2-氧代戊二酸依赖性去甲基酶的活性中心。
近日,中山大学的毛宗万教授和谭彩萍副教授团队设计了偶联临床铁螯合剂的线粒体靶向铼(I)配合物,以期达到同时破坏线粒体代谢和细胞内铁稳态的目的(图1A)。其中,DFX-Re3可以将细胞中的铁重新定位到线粒体,并干扰线粒体代谢,包括与表观遗传修饰密切相关的关键代谢物(图1B),并对三阴性乳腺癌表现出高选择性杀伤效果。此外,铁的重新定位导致Fe(II)/2-氧代戊二酸依赖性去甲基酶的下调。结果显示,DFX-Re3可以同时提高DNA、RNA和组蛋白的甲基化水平,最终改变RNA聚合酶II的活性以及基因表达图谱。机制研究表明DFX-Re3可以诱导细胞免疫原性凋亡,并在体内表现出显著的抗肿瘤活性。该研究提供了一种通过干预线粒体代谢和铁稳态来调节癌症表观基因组的抗癌新策略。
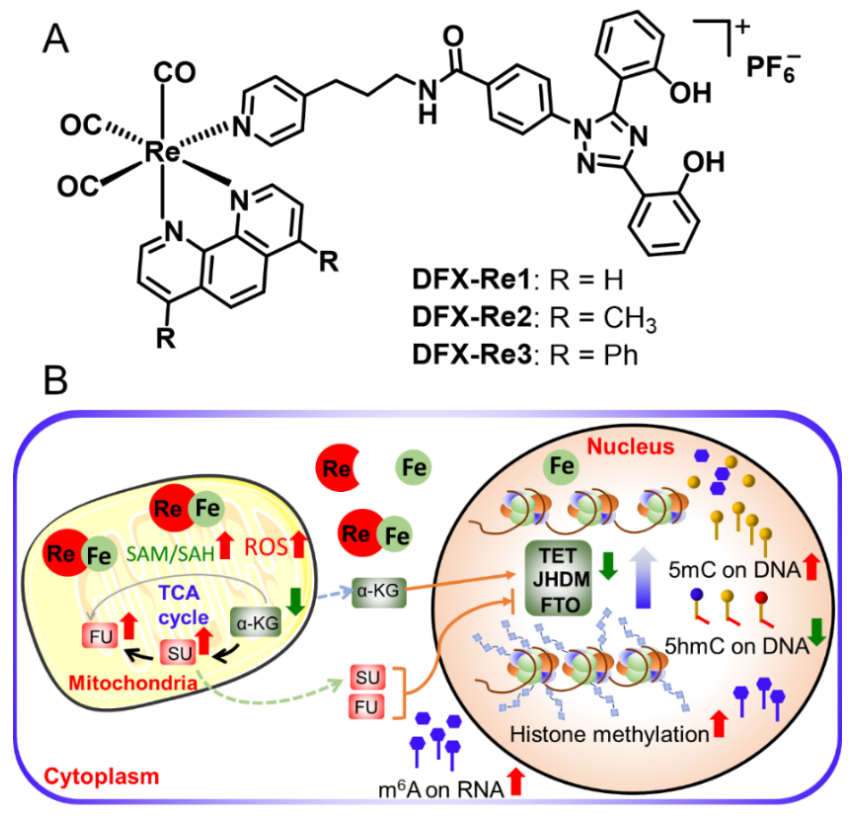
作用机制研究发现,该设计具有以下几个显著优势:
(1) DFX-Re3影响线粒体代谢中与表观遗传修饰相关的代谢物;
(2) DFX-Re3将细胞铁富集于线粒体并诱导线粒体产生大量活性氧;
(3) DFX-Re3同时提高组蛋白、DNA和RNA的甲基化水平;
(4) DFX-Re3改变转录组,尤其是RNA聚合酶II的活性;
(5) DFX-Re3诱导细胞免疫原性凋亡并在体内表现出很高的抗癌活性。
研究成果发表在化学顶级期刊《Angew. Chem. Int. Ed.》,并被评为VIP论文。题目为 “Recoding Cancer Epigenome by Intervening Metabolism and Iron Homeostasis with Mitochondria-Targeted Re(I) Complexes”, Angew. Chem. Int. Ed. 2020, 59, 18755-18762.
中山大学化学学院2017级博士研究生潘正银为论文的第一作者,谭彩萍副教授、毛宗万教授为共同通讯作者。上述研究工作得到了国家自然科学基金(21778078, 91953117,21837006),教育部创新团队(No.IRT-17R111),广东省自然科学基金(2015A030306023)和中央高校基础研究经费等项目的资助。
参考资料
[1]中山大学,毛宗万教授、谭彩萍副教授课题组在金属配合物用作表观遗传调控剂方面取得重要进展,研究成果在《Angew. Chem. Int. Ed.》发表
[2]https://doi.org/10.1002/anie.202008624
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn