

金属酶中的长程电子转移是一个生物体内广泛存在且重要的过程,对氧气的还原与活化起关键作用。顽固多糖单加氧酶(LPMOs)是一种单铜酶,其主要催化顽固多糖的氧化裂解。纤维二糖脱氢酶(CDH)是目前研究最多的能够为LPMOs提供电子的天然的电子供体酶。尽管两种蛋白之间的相互作用得到了广泛的研究,两种蛋白之间的长程电子转移过程仍然存在争议。
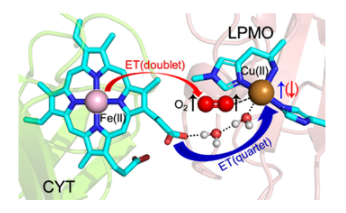
在该工作中,课题组通过多尺度的模拟计算表明:(1)LPMO与CDH的相互作用基中在铜活性中心附近;(2)它们之间的相互作用主要是通过氢键相互作用,尤其是CDH(CYT)的heme b的两个丙酸形成的氢键作用贡献;(3)由于O2结合产生额外的驱动力,有O2参与的电子转移会比没有O2时速率快10倍左右;(4)氧气结合驱动的长程电子转移过程具有自旋选择性,四重态比二重态热动力学更有利。该研究不仅解释了实验上氧气的存在对CDH与LPMO之间的长程电子转移有明显促进的现象,也有助于我们深入理解金属蛋白中自旋调控的长程电子转移过程。
该工作主要由王斌举教授课题组博士后王展峰完成,赵仪教授及其博士生冯施施参与了论文的研究和讨论。该研究工作得到国家自然科学基金(批准号:22073077、21933009、21907082)的资助和支持。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202011408
参考资料:
[1]厦门大学,金属酶中的长程电子转移机制研究,https://chem.xmu.edu.cn/info/1274/9991.htm
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn