(图片来源:Angew. Chem. Int. Ed.)
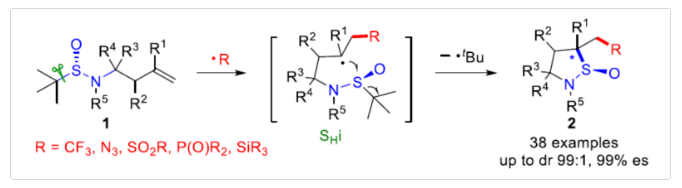
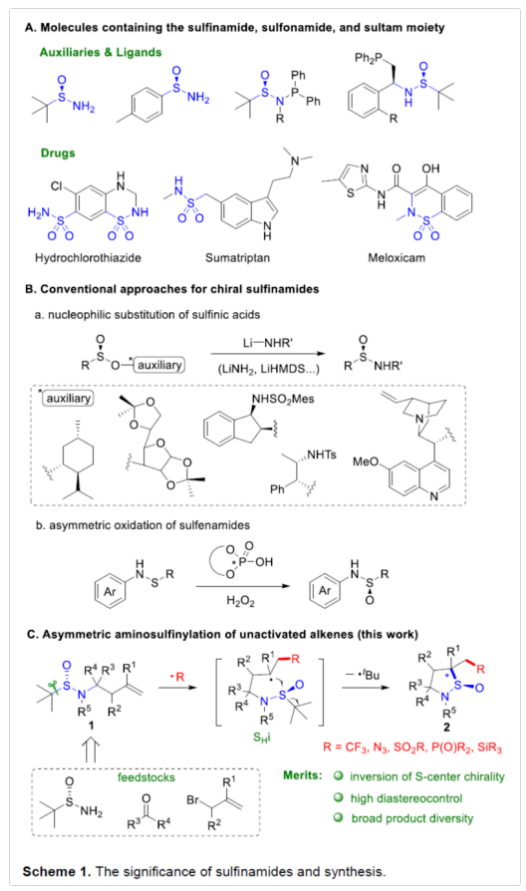
亚磺酰胺是合成手性胺的特殊前体,也是不对称合成领域中常见的手性配体。同时,亚磺酰胺也易转化为一些具有价值的磺酰胺类与磺内酰胺(sultams)类药物,如氢氯噻嗪、舒马曲坦和美洛昔康(Scheme 1A)。然而,对于手性亚磺酰胺的合成却较少有文献报道。常规方法主要依赖于含有手性辅助化合物亚磺酸盐的亲核取代反应,如薄荷醇、双丙酮-D-葡萄糖、氨基醇和奎宁(Scheme 1B, a)。同时,次磺酰胺(sulfenamides)的不对称氧化反应也是另一种有效的合成方法(Scheme 1B, b)。作者设想,是否可通过自由基介导的高烯丙基亚磺酰胺环化来合成手性亚磺酰胺(1)(Scheme 1C)。作者假设,在向烯烃中引入外部自由基后,新形成的烷基自由基和亚磺酰基之间通过五元环状过渡态进行分子内均裂取代(SHi)反应,可生成环状亚磺酰胺(2)。尽管SHi-型反应已被广泛探索,但亚磺酰基的均裂取代却很少被研究,且主要涉及以 C(sp2)为中心的芳基自由基。Fensterbank和Schiesser研究团队发现,除了芳基自由基之外,由烷基溴和硒醚均裂生成的烷基自由基也可能参与亚磺酸盐和亚磺酰胺的SHi过程。进一步的 DFT 研究表明,S原子上的SHi以立体专一性的方式进行,并具有构型反转。此外,由C(sp3)为中心的烷基自由基介导的SHi过程中立体选择性控制,则具有挑战。在此,苏州大学朱晨课题组报道了一种通过亚磺酰胺的立体专一均裂取代反应实现了烯烃的不对称自由基环化,并合成了一系列环状亚磺酰胺衍生物,具有出色的立体控制性。下载化学加APP,阅读更有效率。
(图片来源:Angew. Chem. Int. Ed.)
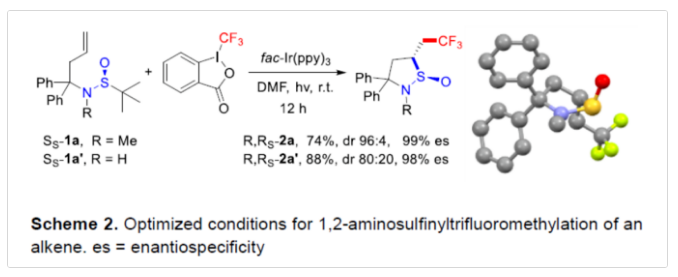
首先,作者以Ss-1a与Togni's试剂作为模型底物,进行了相关环化反应条件的筛选(Scheme 2)。当以fac-Ir(ppy)3作为光催化剂,在DMF溶剂中于蓝光LEDs辐射下室温反应,从而获得了手性环状亚磺酰胺产物2a,收率为74%,dr为96:4,es为99%。
(图片来源:Angew. Chem. Int. Ed.)
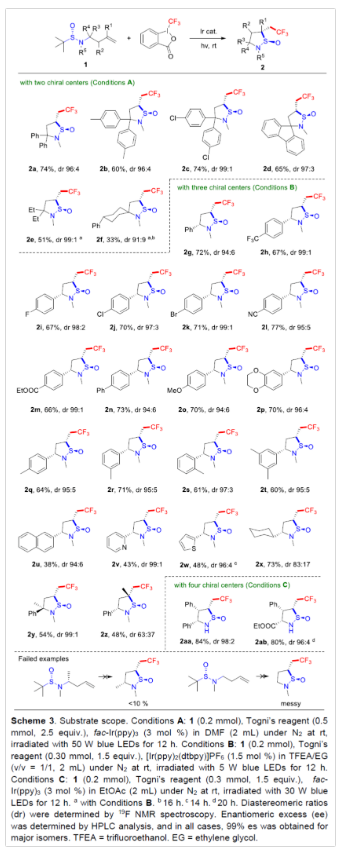
在获得上述最佳反应条件后,作者对底物1的范围进行了扩展(Scheme 3)。首先,该反应具有良好的官能团兼容性,如卤素(2i-2k)、氰基(2l)和酯基(2m),均与体系兼容。不同电性取代的底物,均可顺利进行反应,具有良好的收率和出色的立体选择性。取代基的位置(邻、间或对位)也不影响反应,可合成具有两个、三个甚至四个手性中心的多种环状亚磺酰胺产物(2q-2t)。以叔-高烯丙基亚磺酰胺(1a-1f)为底物,可获得具有两个手性中心的相应产物(2a-2f)。芳基和烷基底物均为合适的底物,但后者收率较低(2e-2f)。值得注意的是,通过该策略还可合成螺-亚磺酰胺产物(2d,2f)。其次,使用仲烯丙基亚磺酰胺(1g-1x),通过调整光催化剂和溶剂的比例(即Conditions B),可获得具有三个手性中心的产物(2g-2x)。各种杂芳基底物,如吡啶基或噻吩基,也可获得良好收率的相应产物(2v-2w)。烷基底物1x,以良好的收率生成所需的产物2x,但非对映选择性降低。此外,将环己基改为甲基时则收率较低,而与未取代高烯丙基磺酰胺反应则体系较为复杂(see failed examples)。1,1-二取代烯烃的官能团化未能获得令人满意的结果(2z),可能是由于空间位阻阻碍了分子内的环化。通过对比2a 和2y的dr值发现,新立体中心的构建主要由亚磺酰胺中邻位S-中心的控制,而非α-碳中心的控制。值得注意的是,通过该策略还可合成具有连续四个立体中心的手性环状亚磺酰胺(2aa-2ab),这是其他方法很难实现的。并且,在上述策略中,反应均具有出色的对映专一性(99% es)。
(图片来源:Angew. Chem. Int. Ed.)
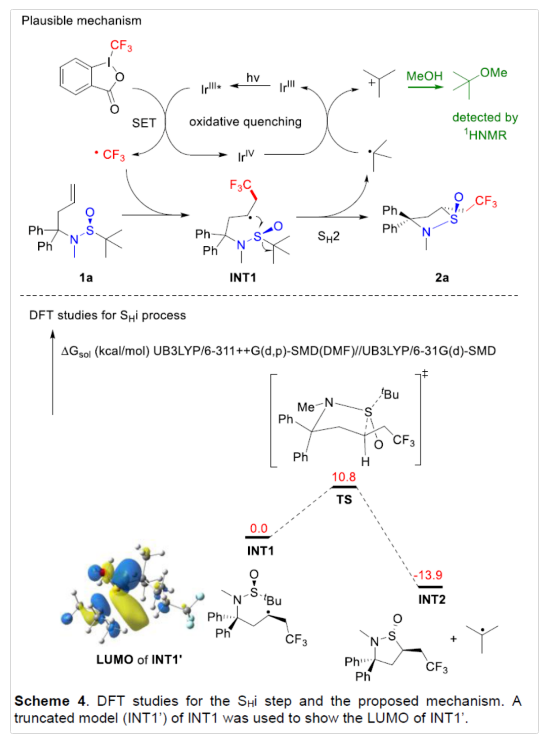
基于上述的结果,作者提出了一种合理的催化循环过程(Scheme 4)。首先,在可见光辐射下,激发的Ir(III)配合物与Togni’s试剂经单电子转移(SET)生成CF3自由基,可与1a进行加成生成INT1。随后,INT1通过SHi-型亚磺酰基交换进行分子内环化,生成产物2a以及叔丁基自由基。同时,在无外部还原剂时,叔丁基自由基对光氧化还原过程至关重要,可将Ir(IV)还原为Ir(III),从而完成催化循环。此外,当使用甲醇作为反应溶剂时,可生成叔丁基甲基醚副产物,从而表明反应形成了叔丁基阳离子。DFT计算表明,反应有利于进行自由基均裂取代的过程。INT1'的前沿分子轨道(FMO)分析表明,INT1'的LUMO位于S中心,更易受到烷基自由基的分子间进攻。(图片来源:Angew. Chem. Int. Ed.)
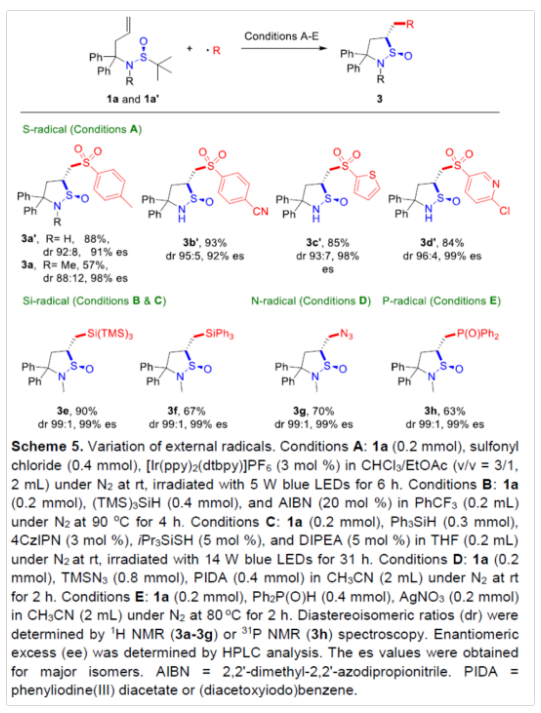
紧接着,作者进一步扩展了外部自由基的范围(Scheme 5)。研究表明,除CF3-自由基以外,一系列含有S-、Si-、N-和P-自由基,均可顺利反应,获得相应的环状亚磺酰胺产物。无论底物的电性如何,芳基和杂芳基(如噻吩基、吡啶基)取代的磺酰基自由基均可生成所需的产物(3a'-3d')。与1a'相比,具有N-甲基基团的底物(1a),可获得更好对映专一性的产物3a,但收率有所下降,可能是由于空间位阻导致。通过加热或在光化学条件下生成的硅基自由基,也可获得目标产物(3e-3f),且较高的反应温度不会影响出色的立体控制性(3e)。此外,具有叠氮基和膦酰基自由基的底物,也可获得良好收率的产物(3g-3h)。下载化学加APP,阅读更有效率。(图片来源:Angew. Chem. Int. Ed.)
最后,作者对反应的实用性进行了研究(Scheme 6)。首先,克级规模实验,可获得74%收率的产物2g,dr为94:6(Scheme 6a)。其次,2g经氧化反应,可生成手性磺内酰胺4(收率为77%,dr为94:6)。2g经亲核开环反应,可生成手性氨基亚砜5(收率为25%,dr > 99:1)。(图片来源:Angew. Chem. Int. Ed.)
总结:苏州大学朱晨课题组报道了一种通过亚磺酰胺的立体专一性均裂取代反应实现了烯烃的不对称自由基环化,从而合成了一系列环状亚磺酰胺衍生物,且具有出色的立体控制性。同时,在光氧化还原催化或其他氧化条件下,自由基串联通过立体专一性SHi过程进行,并且各种外部自由基(C-、S-、Si-、N-和P-自由基)均易进行转化。此外,该策略具有官能团兼容性高、原料易得、底物范围广泛等特点。