

Science:氢键供体催化实现手性膦化合物的对映选择性合成
膦(V)手性中心广泛存在于药物分子及手性配体和催化剂中(图1A)。手性P(V)中心的亲核取代可以立体特异性地发生,从而为从简单的P(V)结构单元合成复杂的膦手性化合物提供了强有力的策略。
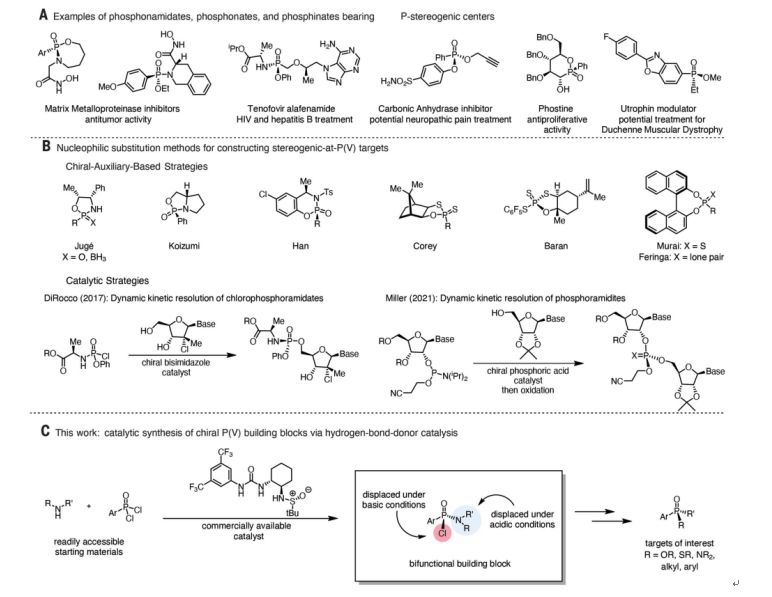
图1. 研究背景及Jacobsen课题组的工作(图片来源:Science)
通常,获得手性膦化合物的主要依赖于使用共价连接的手性助剂来实现非对映体控制,为此,化学家成功开发了多种螯合助剂(图1B)。尽管在这些催化的亲核取代反应中都实现了高水平的立体选择性,但每个反应的底物都仅限于一小类亲核试剂。
为此,Jacobsen教授课题组选择了氯膦酰胺作为对映选择性催化方法的潜在目标(图1C)。P(V)上的氯和氨基显示出正交反应性,可在合成具有广泛取代模式的手性P(V)化合物的过程中被连续和立体特异性取代。
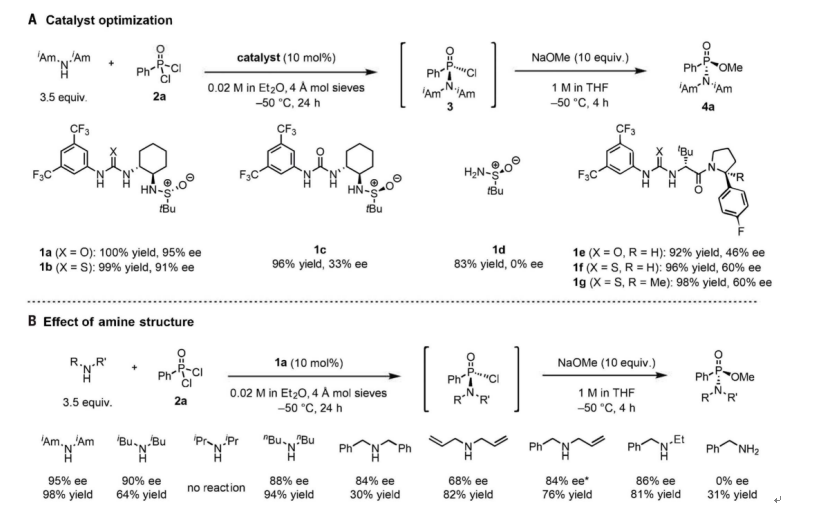
图2. 催化剂的优化及胺结构的影响(图片来源:Science)
首先,作者选择了苯基二氯氧膦2a作为模型底物与各种胺亲核试剂和潜在的手性催化剂进行反应(图2)。在对一系列手性双氢键供体催化剂和胺亲核试剂进行系统评估后,发现亚磺酰胺脲1a能促进二异戊胺的亲核取代,具有95% ee和定量产率(图2A)。取代的对映选择性也与胺结构密切相关,二异戊胺相对于任何其它的亲核试剂都具有明显优越的结果(图2B)。
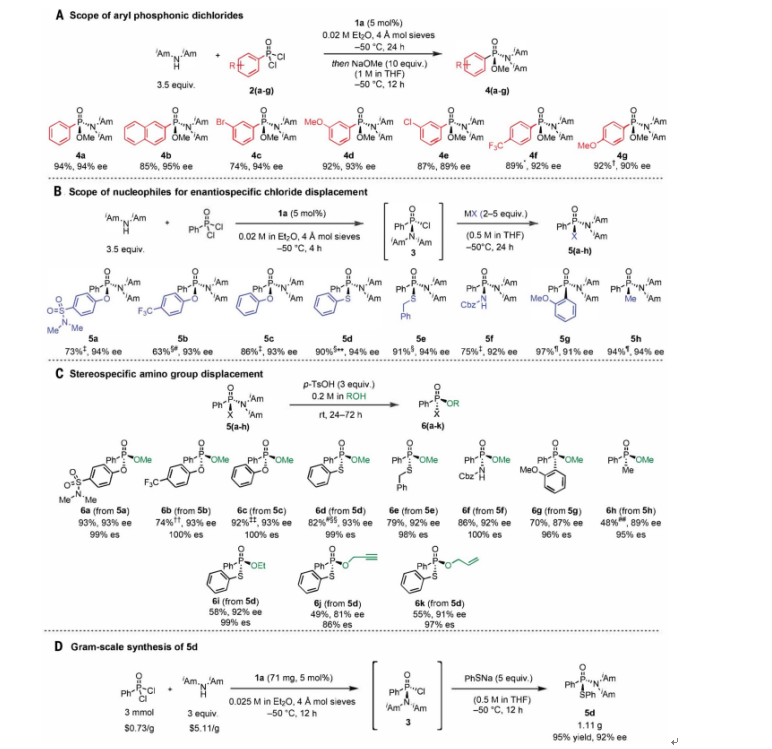
图3. 底物范围(图片来源:Science)
接着,作者对底物范围进行了扩展,各种芳基膦酰二氯与二异戊胺的反应中都具有高水平的对映选择性(图3A)。带有吸电子或给电子取代基芳烃的底物的取代都具有优异的对映选择性(4b-4g)。而己基膦酰二氯仅以26% ee和50%的产率转化为相应的膦酰胺酯。
对映选择性反应的产物具有两种不同的离去基团,它们可以被选择性地取代以获得多种手性P(V)化合物。首先,作者探索了能够对剩余的氯进行对映特异性取代的亲核试剂的范围(图3B)。醇盐、酚盐、硫醇盐、去质子化氨基甲酸酯和格氏试剂的反应在所有情况下(5a-5h)均提供了具有高水平对映体特异性(es)的所需产物。5d的合成还可通过一锅法以3 mmol的规模进行,以95%的产率和92%的ee得到1.11 g产物(图3D)。
氯化物取代反应的产物可以通过酸介导的二异戊氨基立体反转取代进一步衍生化来合成烷氧基取代的P(V)化合物(图3C)。用甲醇取代5a-5h产生多种对映体富集的膦酸酯、次膦酸酯和膦酰胺酯(6a-6h),在每种情况下都观察到几乎完全的对映体特异性。
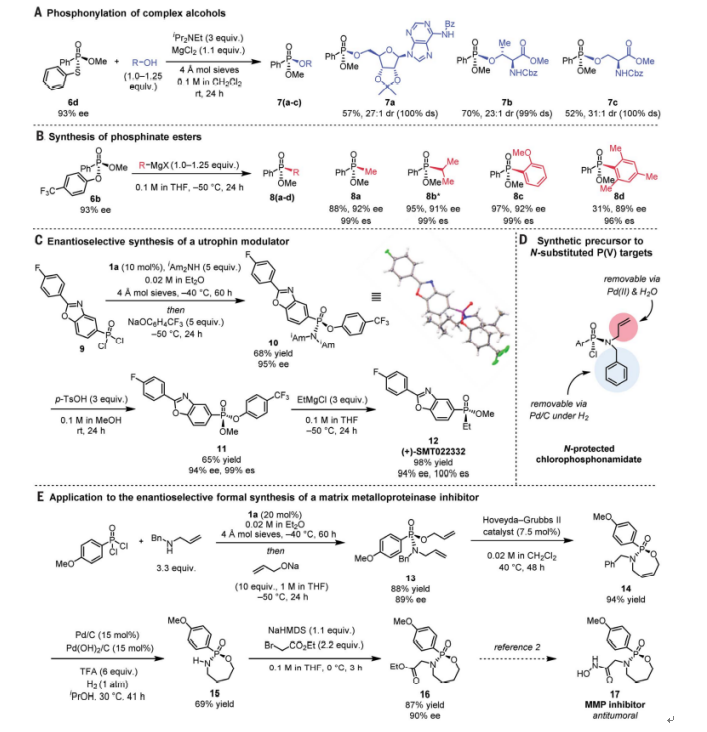
图4. 合成应用(图片来源:Science)
膦酸硫酯6d与复杂的醇发生反应,可得到相应的具有高立体特异性(7a-7c)的膦酰化生物分子(图4A)。膦酸酯6b被格氏试剂取代了缺电子的芳氧基,产生高度对映体富集的次膦酸酯,这是手性氧化膦的已知前体(图4B)。将二氯氧膦9置于优化条件下可得到膦酰胺酯10,其结构由单晶确证(图4C),随后与甲醇反应,接着发生格氏反应就得到了(+)-SMT022332 (12),三步总产率43%,ee 值94%。N-烯丙基苄胺在优化条件下的取代反应中也具有较高的对映选择性。氯膦酰胺产物上的苄基和烯丙基均可以依次被取代,可用于合成具有抗癌活性的MMP抑制剂膦酰胺17(图4E)。二氯氧膦2h与N-烯丙基苄胺有效催化反应生成膦酰胺13,膦酰胺13经过三步反应,得到了90% ee的环状膦酰胺16,完成了MMP抑制剂17的对映选择性形式合成。
Nature:较少保护的糖类的位点选择性、立体控制的糖基化
未保护糖和其他多羟基化亲核试剂的选择性糖基化是合成化学中的一个特别重要的目标,不仅需要在立体化学复杂的环境中控制形成键的立体化学,还要区分相似的反应性亲核位点。化学家通常依赖多步保护基策略来实现糖基化中的位点控制,但效率较低。作者在这里报道了一种使用精确设计的双硫脲小分子催化剂对无保护或最少保护的单糖和二糖进行小分子催化剂控制、高度立体和位点选择性糖基化的新策略。从而实现了多种多功能亲核试剂的立体和位点选择性半乳糖基化和甘露糖基化。动力学和计算研究提供的证据表明,位点选择性来自稳定催化剂和亲核试剂之间的 C-H/π相互作用,类似于糖结合蛋白中记录的那些。这项工作表明,高度选择性的糖基化反应可以通过控制稳定的非共价相互作用来实现,这是碳水化合物选择性功能化的潜在通用策略。
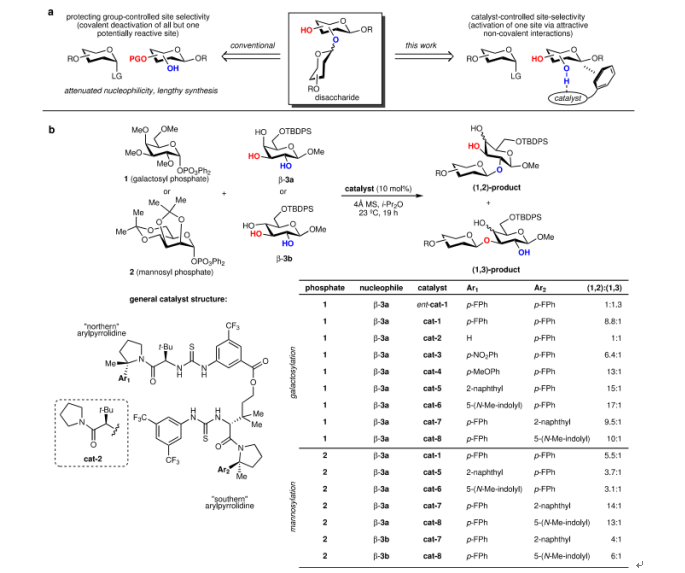
图5. 位点选择性糖基化和催化剂优化(图片来源:Nature)
首先,作者将单糖3a的半乳糖基化作为模型反应,发现芳基双硫脲小分子催化剂中的“南芳基” Ar2的具体种类对单糖3a半乳糖基化的位点选择性(1,2-糖基化 vs 1,3-糖基化)影响很小,而“北芳基”Ar1的种类则对其糖基化反应的位点选择性具有非常明显的影响。这表明只有芳基 Ar1吡咯烷酰胺参与亲核试剂识别。同时,位点选择性与芳基 Ar1的电子密度呈正相关,表明受催化剂取代基的电子特性影响的非共价相互作用可能在控制位点选择性中起关键作用。当Ar1为5-(N-甲基吲哚基)和Ar2为对氟苯基组合的催化剂具有最大的位点选择性,可以达到17:1(1,2- vs 1,3-)。
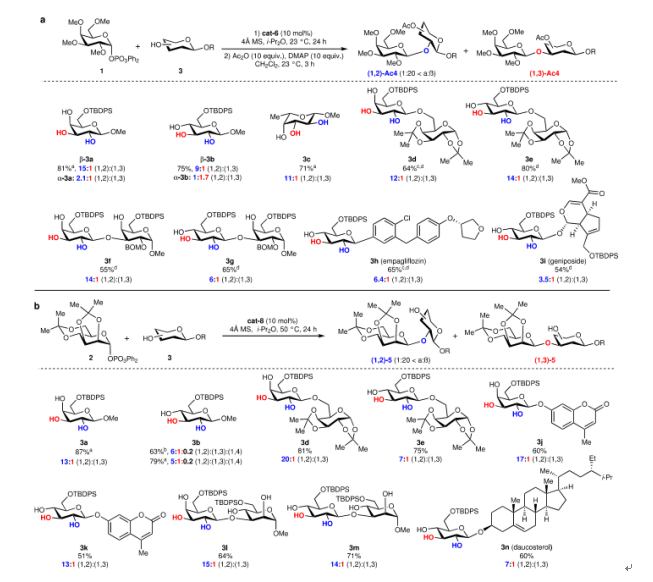
图6. 底物范围(图片来源:Nature)
接着,作者采用了类似的方法来开发用于位点选择性甘露糖基化的催化剂,但这一反应对催化剂 Ar1与 Ar2性质的依赖与上述反应相反。观察到位点选择性对芳烃 Ar2而不是芳烃 Ar1的变化最敏感。在该条件中,作者选择了与上述催化剂 Ar1与 Ar2顺序相反的催化剂来催化甘露糖基化。有了最佳条件,作者探索了立体选择性和位点选择性半乳糖基化和甘露糖基化的底物范围。单糖如3a-c和含有半乳糖或葡萄糖单元(3d-g,3l-m)的受保护较少的二糖经历了两种反应,对 C-2羟基具有高选择性,没有观察到过度糖基化。含糖苷的药物和天然产物(3h-i,3n)也经历了具有较高(1,2)-选择性的糖基化。位点选择性对异头基团的种类不敏感,表明异头取代基远离与催化剂的关键相互作用。
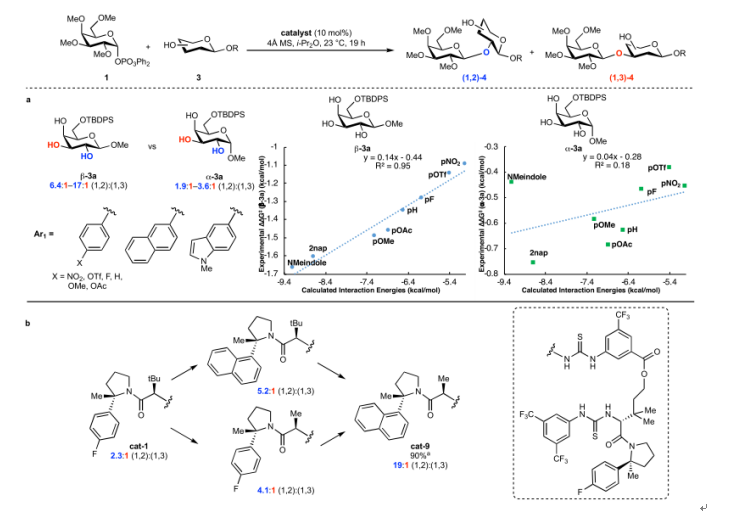
图7. 线性自由能关系研究及催化剂优化(图片来源:Nature)
经过动力学实验结合计算化学,作者初步给出了该反应可能的机理。该催化过程中选择性的产生很大程度上归因于C-H/π相互作用。通过量子化学溶剂化计算,表明观察到的(1,2)-选择性来自过渡态稳定化。
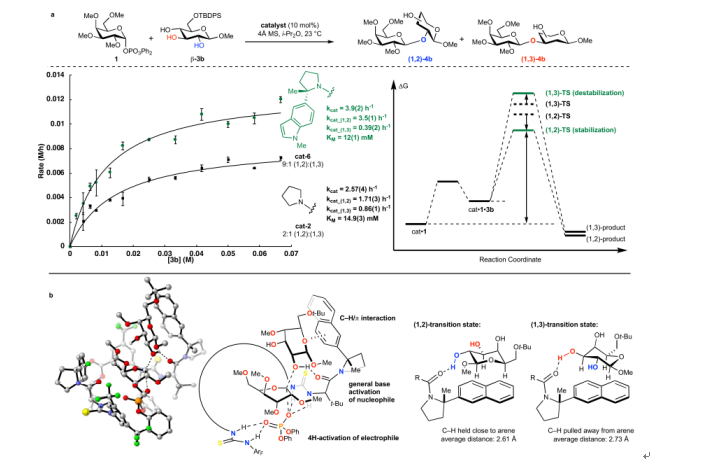
图8. 动力学及计算研究(图片来源:Nature)
总结:E. N. Jacobsen教授课题组利用自己发展的小分子(硫)脲催化剂,分别报道了一种基于氢键供体合成手性有机膦化合物的新方法,该方法能实现各种复杂有机膦分子的不对称合成,且可用于含磷药物分子的开发。另一方面,通过改造常用的双硫脲小分子催化剂实现了在无保护或少保护的情况下对单糖半乳糖基化及甘露糖基化的高区域选择性控制,扩展了该方法的底物适用范围并研究了其反应机理,更广泛地展示了利用非共价相互作用在小分子催化糖基化中实现高立体和位点控制的可行性
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn