

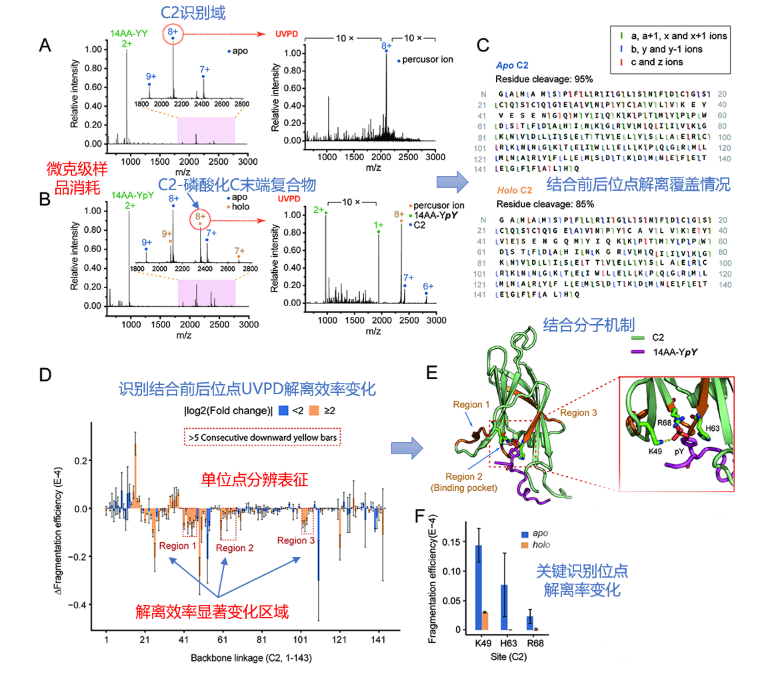
与常规毫秒级碰撞诱导质谱解离(CID)相比,5ns单脉冲193nm紫外激光解离(UVPD)可直接激发非变性蛋白质骨架共价键至高能态引发高效解离,激发解离速率提升6个数量级,位点解离效率和碎片离子产率与其局部非共价作用和微观结构密切相关,通过碎片离子和解离产率分析可同时获得蛋白质序列和结构信息。目前,193nm紫外激光解离质谱尚未商品化设备,仅在少数实验室有自主搭建设备。
免疫共受体CD28是癌症免疫治疗的重要靶点,其胞质端酪氨酸磷酸化激活引起的下游蛋白识别结合机制尚不清楚。本工作中,研究人员采用光亲和质谱法发现CD28磷酸化胞质端与激酶PKCθ的C2结构域特异性结合;利用193nm紫外激光解离质谱对C2结合前后进行了全序列覆盖位点光解离效率的差异分析,发现了光解离效率显著下降的三个关键结合区域和核心识别位点K49、H63、R68;证明了高能紫外激光解离策略在蛋白质动态识别结构变化分析中的高灵敏度和单位点分辨高精度优势。
中科院大连化物所王方军和肖春雷研究员通过交叉学科联合攻关,在大连相干光源搭建了193nm紫外激光解离-高分辨质谱装置,在前期工作中通过高能光子对多肽分子的高效激发解离实现了多磷酸化肽修饰位点精确定位(Chin. Chem. Lett.,2018)和蛋白质组学规模化序列鉴定(Anal. Chim. Acta.,2021)。
文章链接:https://doi.org/10.1016/j.chembiol.2022.01.005
参考资料:http://www.dicp.cas.cn/xwdt/kyjz/202207/t20220711_6475056.html
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn