

正文
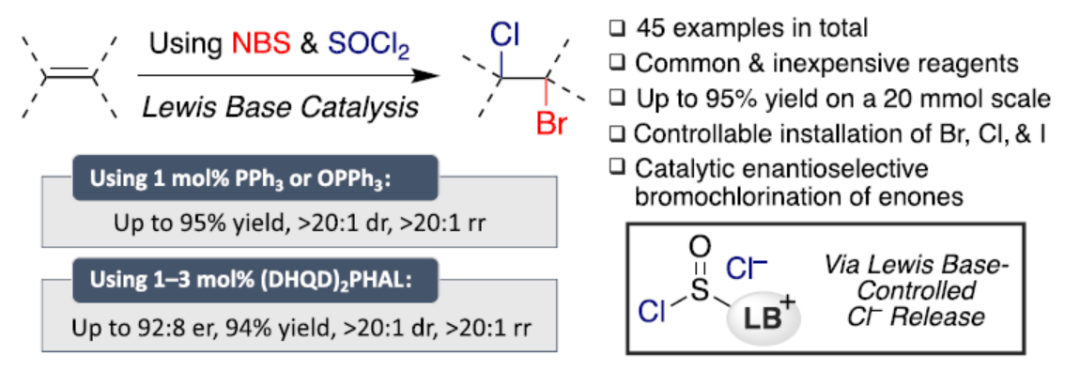
近日,美国贝勒大学Liela Bayeh-Romero课题组报道了一种新型Lewis碱催化烯烃和炔烃的溴氯化反应(bromochlorination)。其中,使用亚硫酰氯作为氯源,三苯基膦或三苯基膦氧化物作为Lewis碱活化剂,具有出色的化学、区域和非对映选择性。同时,通过简单改变不同的卤源,可实现相应的双卤化反应。此外,当使用手性Lewis碱催化剂((DHQD)2PHAL)时,可实现烯酮催化对映选择性溴氯化反应。
(图片来源:J. Am. Chem. Soc.)
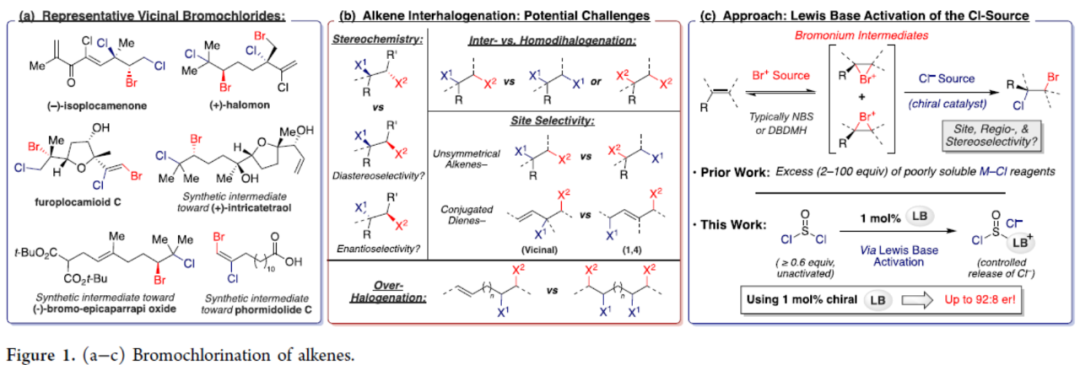
有机卤化物是一类具有价值的化合物,广泛存在于商用化学品、药品、农用化学品和多种天然产物中。同时,有机卤化物也是通用的合成中间体,能够参与亲核置换、自由基介导的交换和各种交叉偶联反应,从而实现C-C和C-杂原子键的构建。其中,含氯和溴的化合物是工业中使用最广泛的两类有机卤化物。目前,化学家们已对烯烃的立体专一性邻位二卤化反应(二溴化和二氯化)进行了广泛的研究,其中以亲核试剂作为卤化物。相比之下,由于最近对具有生物活性的多卤代天然产物的兴趣,不饱和烃的选择性溴氯化最近再次受到关注(Figure 1a)。然而,除了位点选择性的挑战之外,(多)不饱和体系的统一溴氯化带来了许多立体和化学选择性挑战,必须避免这些挑战才能以合成有用的产率提供合理纯度的产品(Figure 1b)。传统上,烯烃和炔烃的溴氯化反应主要依赖于使用高活性卤源,从而限制了底物的通用性,并且在制备和处理过程中需要特别小心。或者,将亲电溴化试剂(如NBS和DBDMH)与亲核氯源相结合使用,从而反应具有更高的选择性和更广泛的范围。然而,这些反应中大多数仅限于使用碱金属氯化物,因此需要使用超化学计量量的难溶性试剂(如LiCl)。近日,美国贝勒大学Liela Bayeh-Romero课题组报道了一种新型Lewis碱催化烯烃、炔烃和二烯烃的溴氯化反应。其中,使用亚硫酰氯作为氯源,三苯基膦或三苯基膦氧化物作为Lewis碱活化剂,具有出色的化学、区域和非对映选择性。
(图片来源:J. Am. Chem. Soc.)
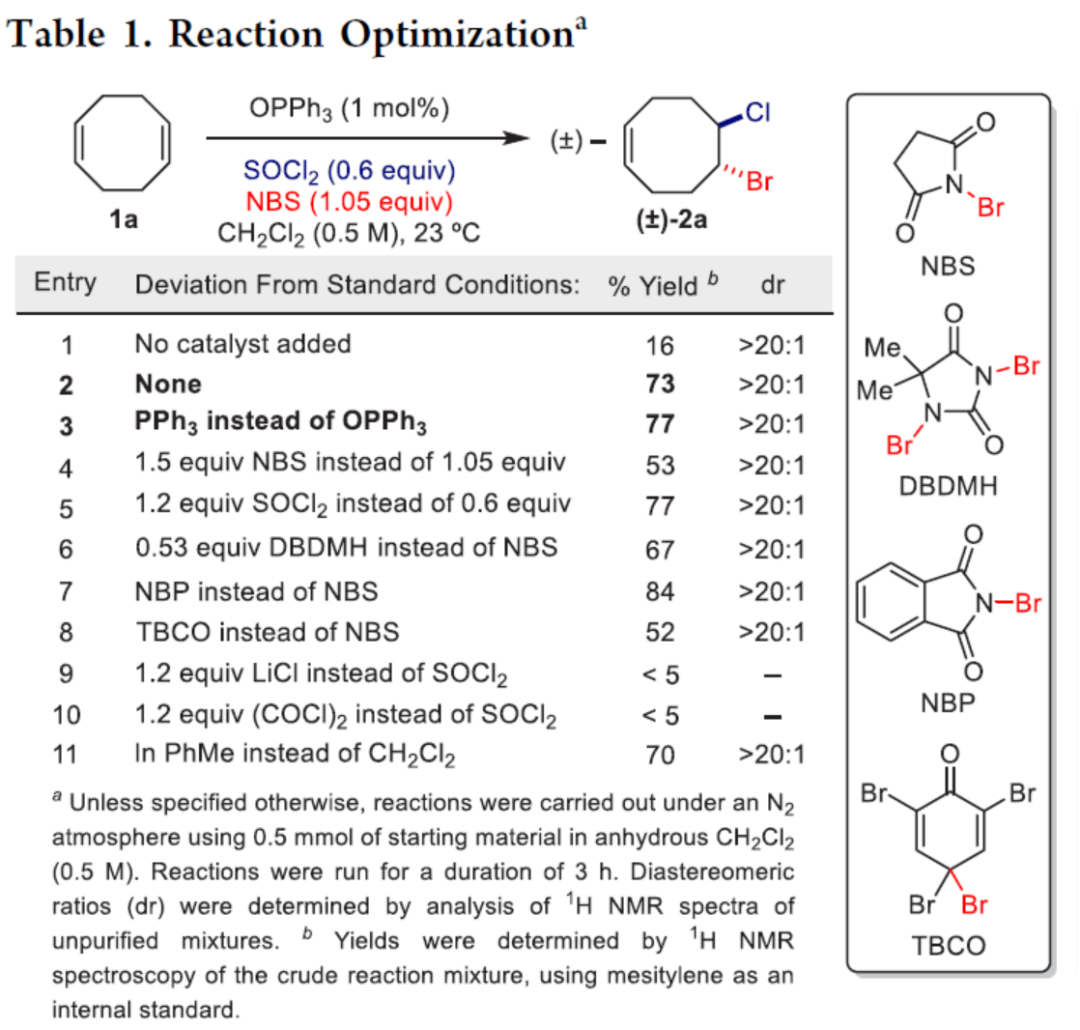
首先,作者以1,5-环辛二烯1a作为模型底物,进行了相关溴氯化反应条件的筛选(Table 1)。当以NBS作为溴源(成本相对较低且可用性更广),SOCl2作为氯源,PPh3作为活化剂,在CH2Cl2溶剂中反应,可以77%的收率得到溴氯化产物2a,dr > 20:1。
(图片来源:J. Am. Chem. Soc.)
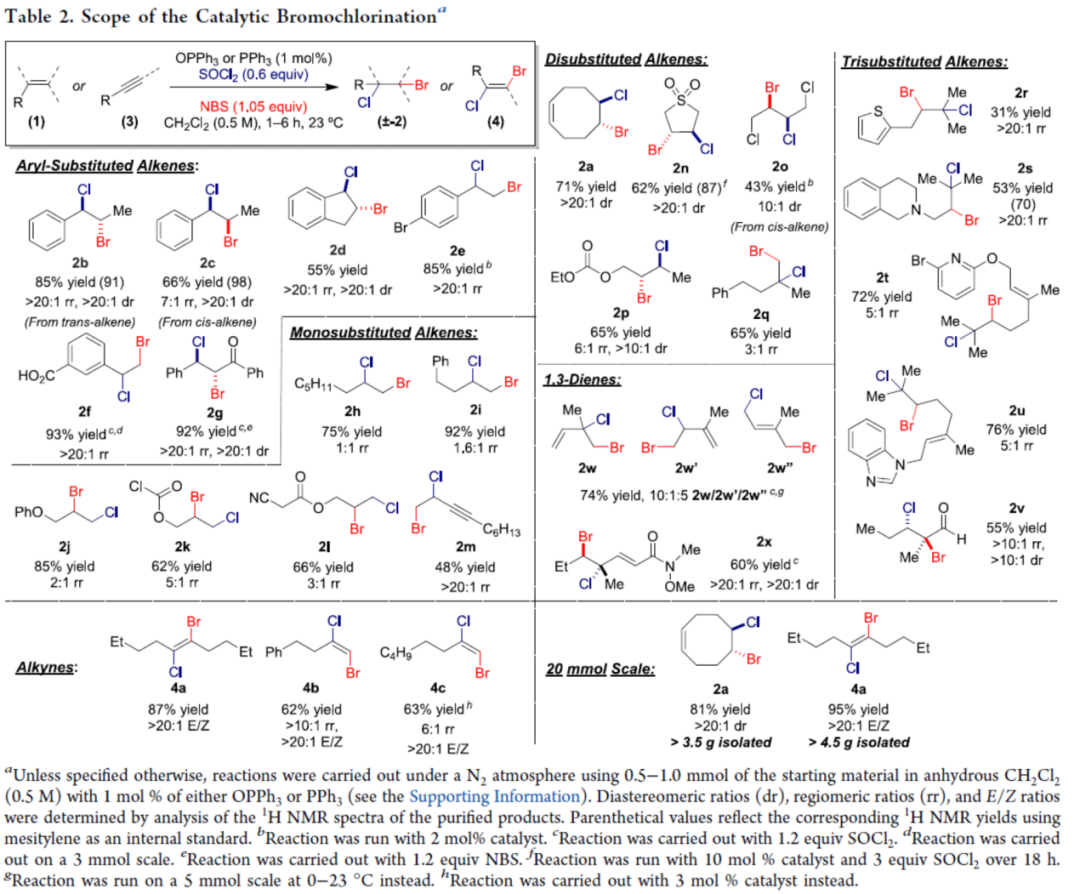
在获得上述最佳反应条件后,作者对底物范围进行了扩展(Table 2)。首先,一系列芳基取代的烯烃,均可顺利进行反应,获得相应的产物2b-2g,收率为55-93%,dr > 20:1,rr > 20:1。然而,对于非活化单取代烯烃的位点选择性在大部分情况下均较差(除2m以外),获得相应的产物2h-2m,收率为48-92%。其次,二取代烯烃也是合适的底物,可获得良好非对映选择性的产物2n-2p,收率为43-65%。对于1,1-二取代和三取代的烯烃,也与体系兼容,获得相应的产物2q-2u,收率为31-76%,rr为3:1-> 20:1。烯醛1v也是合适的底物,获得55%收率的产物2v,dr > 10:1,rr > 10:1。对于异戊二烯底物,可同时获得混合产物2w/2w’/2w”(10:1:5),总收率为74%。1,4-二取代二烯酰胺1x,可在末端烯烃上具有明显的反应性,可以60%的收率获得产物2x,dr > 20:1,rr > 20:1。此外,炔烃衍生物,也可顺利进行反应,获得相应的产物4a-4c,收率为62-87%,rr为6:1-> 10:1,E/Z > 20:1。值得注意的是,克级规模实验,可获得81%收率的产物2a(dr > 20:1)和95%收率的产物4a(E/Z > 20:1)。
(图片来源:J. Am. Chem. Soc.)
基于相关实验的研究以及相关文献的查阅,作者提出了一种合理的催化循环过程(Figure 2)。其中,三苯基膦(I)和TPPO(II)都是该反应的有效催化剂。首先,亚硫酰氯可将I快速氧化为II。其次,II可作为Lewis碱,可与亚硫酰氯中的硫原子发生亲核加成,形成离子化的中间体III。随后,III与溴配合物IV之间通过anti-非对映专一性溴鎓离子开环,生成溴氯化产物V,并再生活性催化剂II,以完成催化循环的过程。
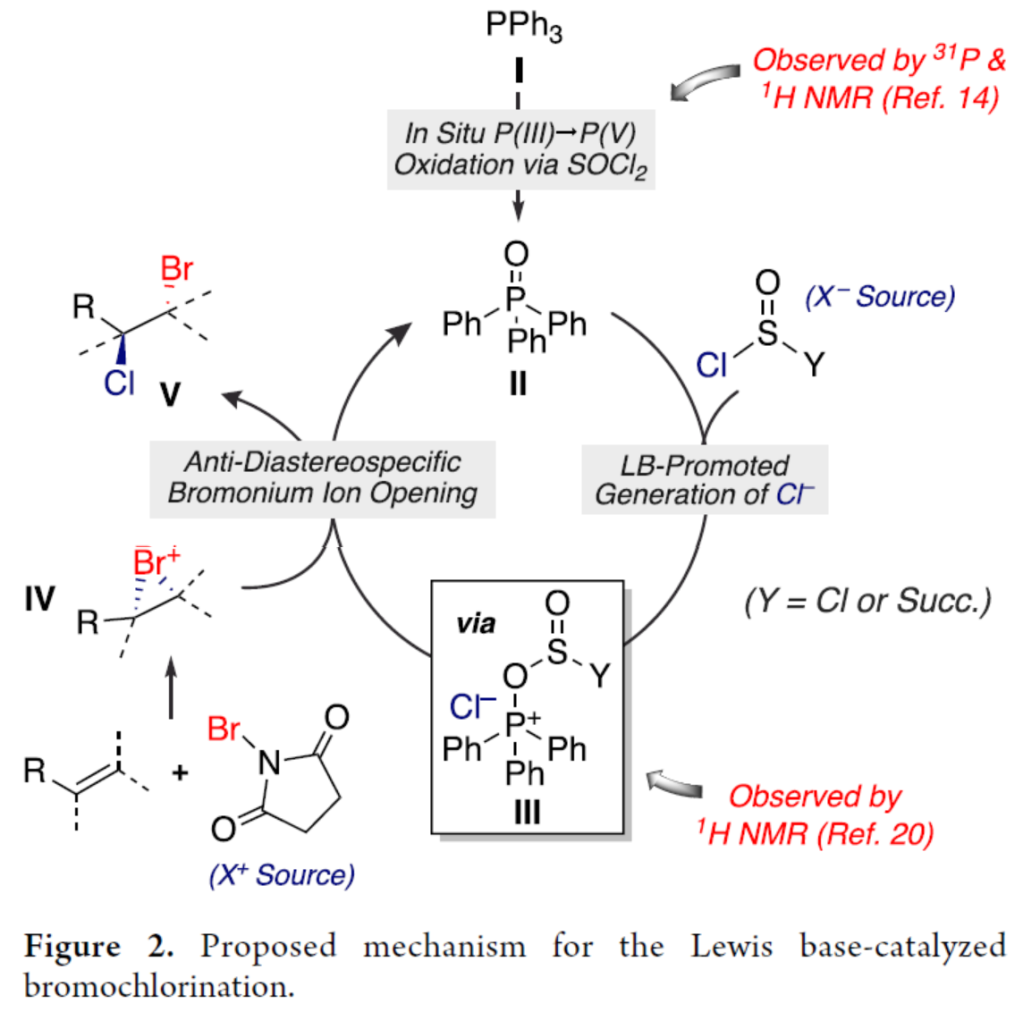
(图片来源:J. Am. Chem. Soc.)
紧接着,作者对选择性双卤化反应的范围进行了研究(Table 3)。首先,当使用SOBr2与NBS作为双溴源时,可获得双溴化产物2y、4d和2z,收率为59-84%。其次,当使用SOCl2与DCDMH或TCCA作为双氯源时,可获得双氯化产物2aa-2ac,收率为66-84%。此外,当使用SOCl2作为氯源,NIS作为碘源时,可获得氯碘化产物2ad、2ae和4f,收率为40-96%。当使用SOBr2作为溴源,NIS作为碘源时,可获得溴碘化产物4d和2af,收率为73-81%。
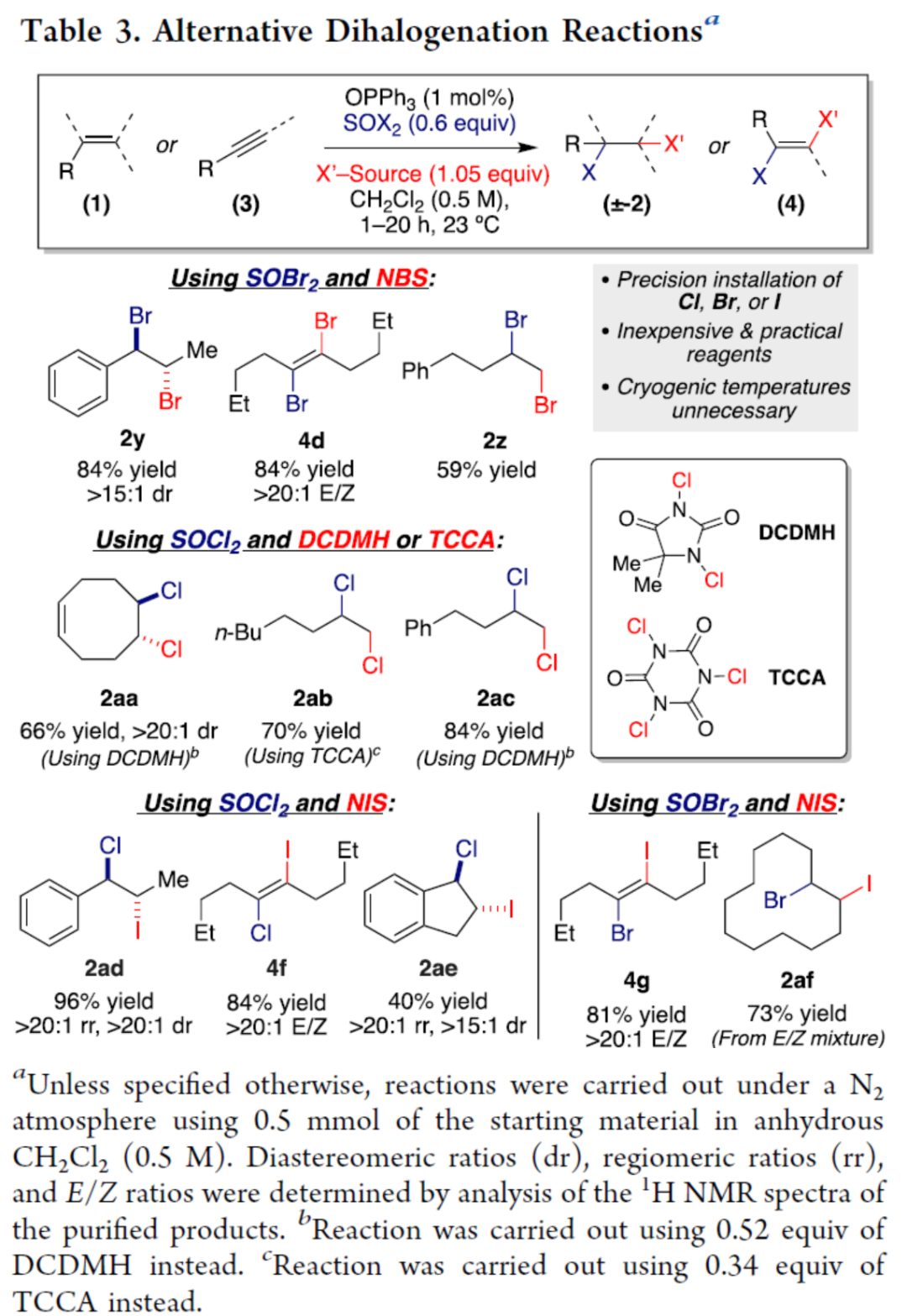
(图片来源:J. Am. Chem. Soc.)
此外,对于催化烯烃的对映选择性溴氯化反应的策略仍非常罕见,迄今为止仅有两例开创性的策略,但这两种策略均需使用相应的导向基团和(碱)金属氯化物试剂(Figure 3a)。然而,对于烯酮和烯醇负离子的催化对映选择性溴氯化反应,仍有待探索。基于前期工作的总结,作者选择了一种金鸡纳生物碱作为对映选择性溴氯化的手性Lewis碱催化剂(Figure 3b)。其中,互卤化的关键步骤在于亚硫酰氯的活化。作者认为,手性氯盐可能参与对映体决定步骤,即将氯化物添加到构型不稳定的溴鎓(bromiranium)中间体中。
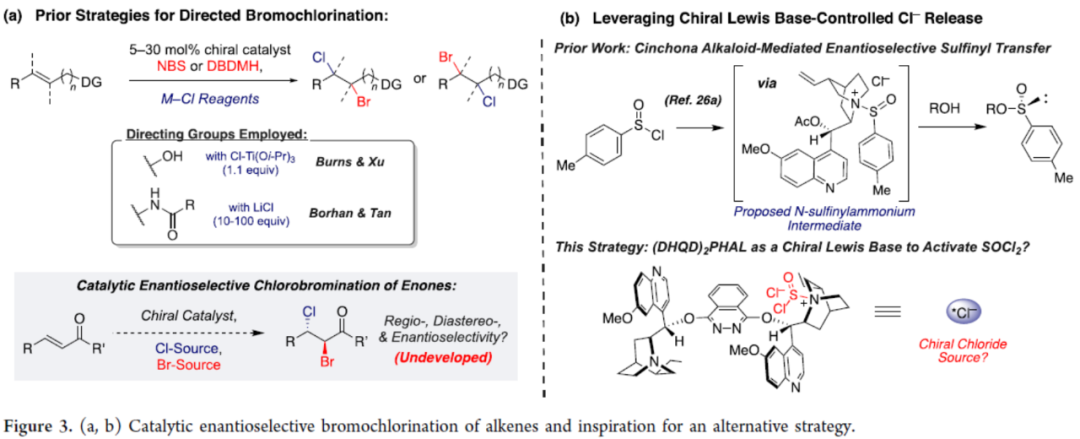
(图片来源:J. Am. Chem. Soc.)
因此,作者对不对称溴氯化反应的范围进行了扩展(Table 4)。研究表明,一系列烯酮衍生物,均可顺利进行反应,获得相应的产物2g和2ag-2am,dr > 20:1,rr > 20:1,er为71.5:28.5-92:8。值得注意的是,与文献中对映选择性二卤化的有机催化方法(通常需要极低的反应温度或使用10-30 mol%的催化剂负载量)相比,该策略所需的催化剂负载量较低且反应条件温和。
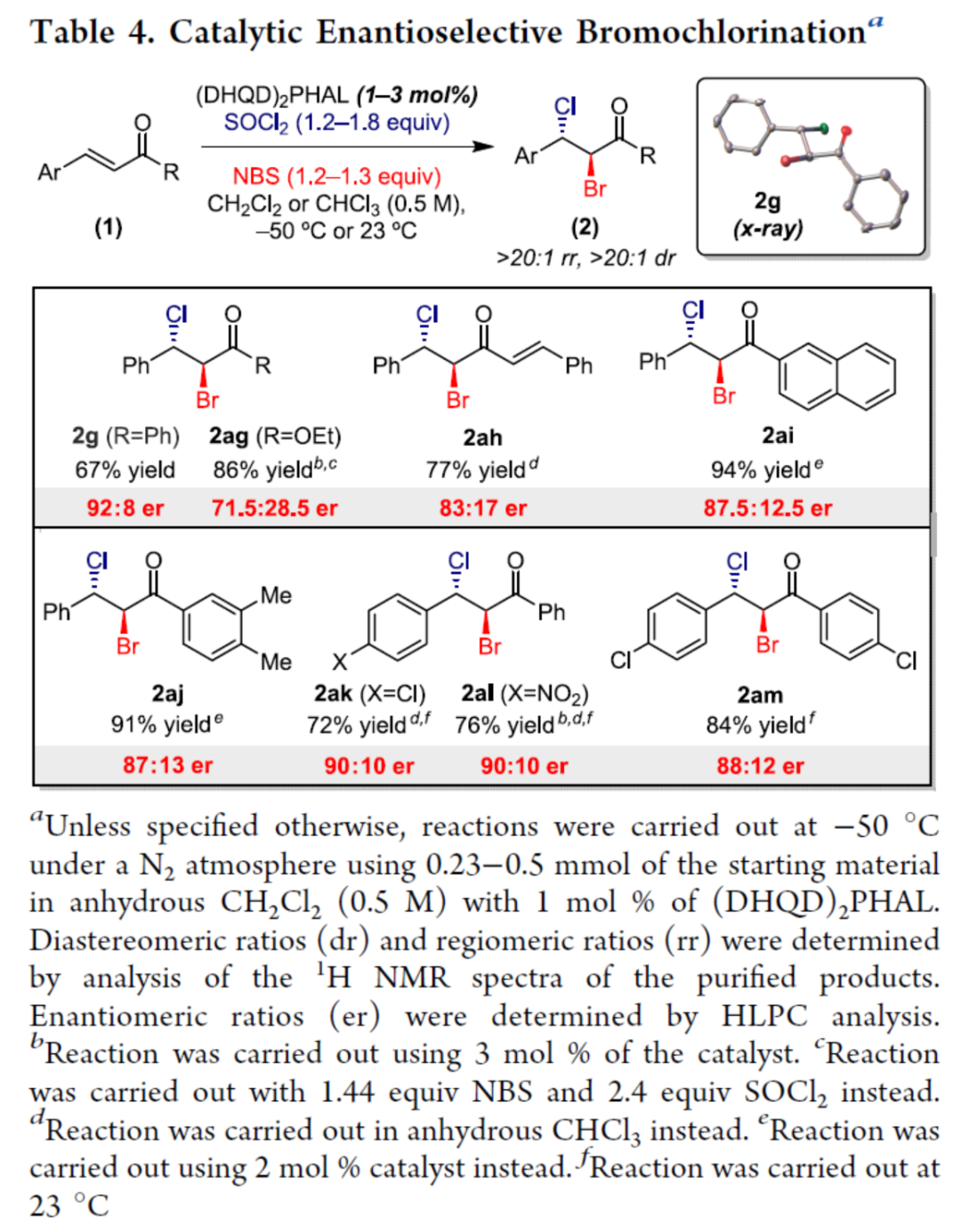
(图片来源:J. Am. Chem. Soc.)
总结
美国贝勒大学Liela Bayeh-Romero课题组报道了一种新型Lewis碱催化烯烃和炔烃的高选择性溴氯化反应。其中,使用亚硫酰氯作为氯源,三苯基膦或三苯基膦氧化物作为Lewis碱活化剂,具有出色的化学、区域和非对映选择性。同时,通过简单改变不同的卤源,可实现相应的双卤化反应。此外,当使用手性Lewis碱催化剂((DHQD)2PHAL)时,可实现烯酮催化对映选择性溴氯化反应,且具有较低的催化剂负载量以及温和的反应条件。值得注意的是,该策略作为催化不对称卤化领域的一项重大进展,并与该领域以前的方法不同,并且无需导向基团的预引入过程。
文献详情:

声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn