

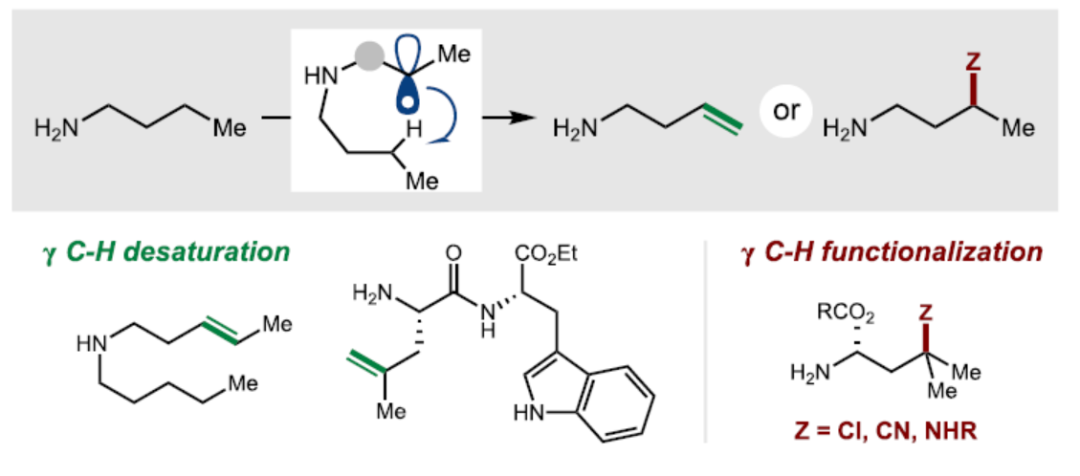
正文
近日,美国俄亥俄州立大学T. V. RajanBabu和David A. Nagib课题组报道了一种脂肪族胺的选择性远程去饱和策略,直接合成了一系列高烯丙基胺(homoallyl amines)。该反应采用三重氢原子转移(HAT)串联策略,即钴催化金属-HAT(MHAT)、碳-碳之间的1,6-HAT以及通过MHAT再生Co-H。同时,所开发的新型磺酰基自由基chaperone能够使多种胺、氨基酸和肽进行远程去饱和过程,具有出色的位点、化学和区域选择性。在这个串联过程中碳碳之间的 HAT关键步骤经过计算设计以满足热力学(键强度)和动力学(极性)的要求,并通过区域选择性、异构化和竞争实验对其进行了深入研究。此外,通过中断(interrupted)该自由基转移脱氢策略,还实现了γ-选择性C-Cl、C-CN和C-N键的构建。
(图片来源:J. Am. Chem. Soc.)
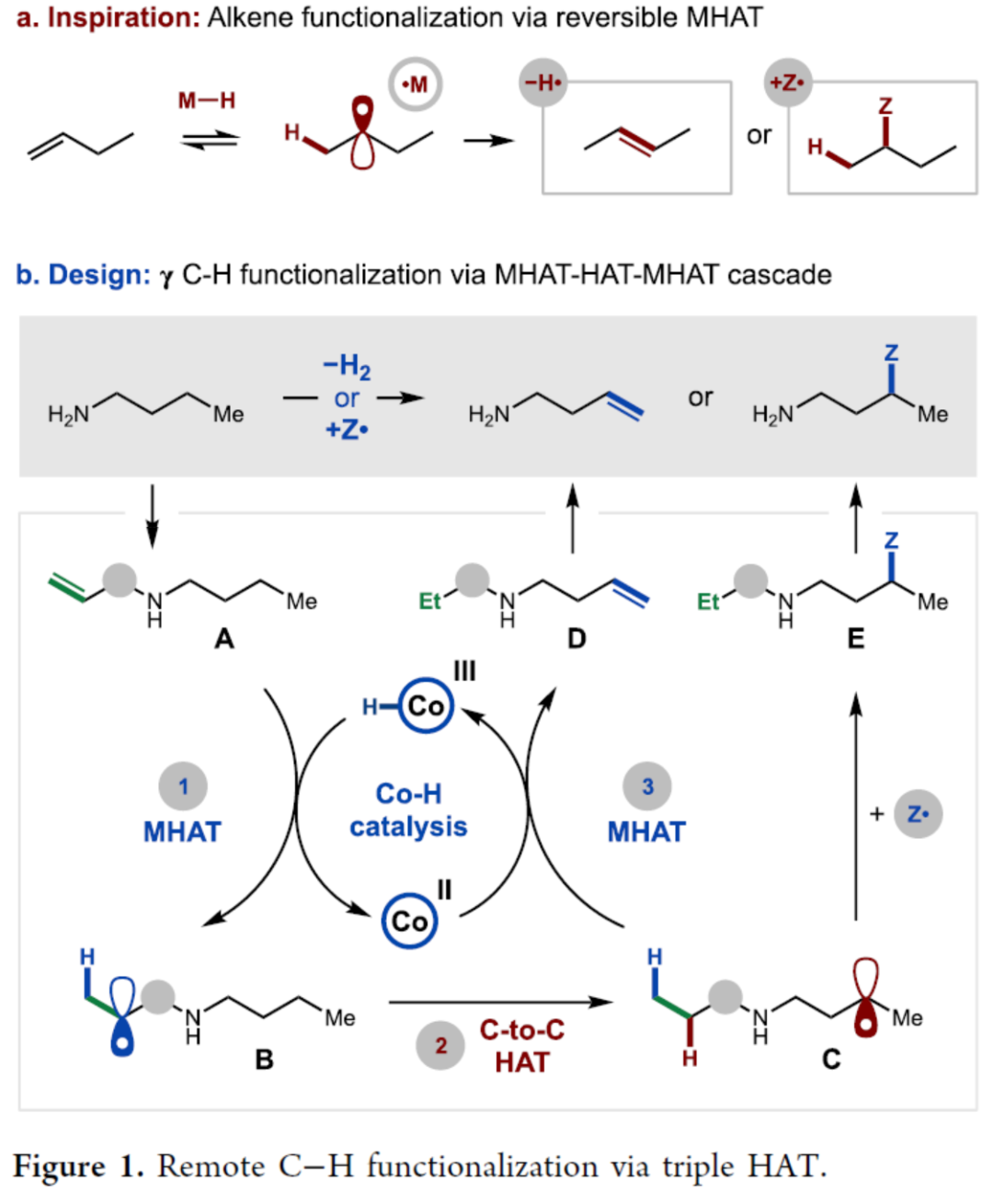
烯基是合成化学中用途广泛的单元。理想情况下,双重C-H键的氧化可在远端位引入具有化学和区域选择性的关键基团。然而,除了选择性策略之外,由于烯烃产物的过氧化倾向,氧化去饱和难以实现。为了克服这些挑战,作者提出了一种以胺为底物,进行温和的、氧化还原中性的去饱和方法(通过一种新型自由基chaperone来促进选择性烯基转移)。金属氢原子转移(MHAT)是一种通过烯烃、硅烷和第一行金属生成以C-中心自由基的稳健方法(Figure 1a)。这种 MHAT 介导的策略能够实现烯烃的加氢官能团化和异构化,具有化学、区域和立体选择性。然而,对于将MHAT与分子内HAT相结合实现远程C-H键的官能团化反应,仍有待进一步的研究。
为了实现这一目标,作者试图开发一类新型的自由基chaperone,以通过瞬态亚胺酯(imidate)自由基来补充醇的β-C-H胺化反应。在此,作者设计了一种通过MHAT- HAT-MHAT串联策略,实现了γ-C-H键的官能团化反应(Figure 1b)。该策略涉及MHAT(A→B)、碳-碳之间的1,6-HAT(B→C)以及MHAT(C→D),从而实现了自由基中间体生成、转移和终止。此外,通过中断终端MHAT并捕获远程自由基C,从而生成各种γ-C-H官能团化的产物E。
(图片来源:J. Am. Chem. Soc.)
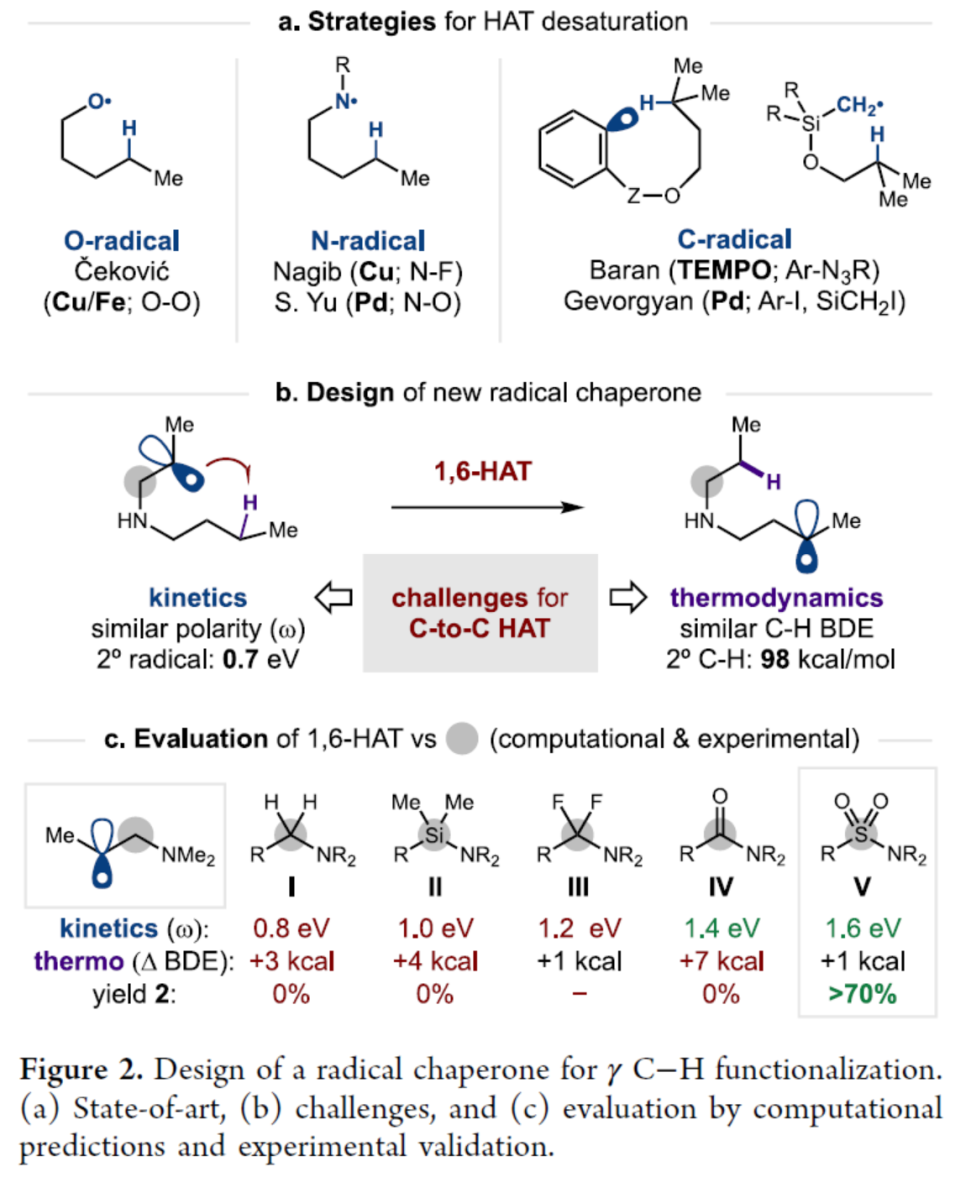
自由基去饱和通常需要相邻的官能团(如芳烃、杂原子、羰基)以及化学计量的氧化剂。在催化或区域选择性去饱和的罕见例子中,已通过HAT去饱和策略实现了O-、N-或 C-中心自由基的形成(Figure 2a)。总的来说,这些开创性策略通过生成强的O-H、N-H和一级或芳基C-H键克服了C-H键的抽象热力学挑战。然而,苄基或三级C-H 键仍是有效反应所必需的,这可能是由于必需的催化剂(如 Pd、Cu)或阳离子中间体产生的动力学效应。
为了克服这些挑战,作者提出了一种三重HAT串联策略。其中,碳碳之间的HAT 所需的自由基易位(translocation)是困难的,因为它缺乏热力学驱动力,因为断裂和形成C-H键的键强度相似(2°C-H)(Figure 2b)。此外,由于参与 HAT 的两个烷基自由基的相似极性(2°自由基极性),存在动力学能障。亲电自由基通常用于HAT以避免竞争性副反应(如还原、二聚化和聚合)。
此外,作者对五个有代表性的例子进行了计算,并评估了这些动力学(自由基亲电性,ω)和热力学(键解离能,BDE)参数(Figure 2c)。其中,唯一能够提供远程去饱和的成功候选者是乙烯基磺酰胺V。值得注意的是,虽然在1,5-HAT 中使用了α-砜自由基,但这是由α-磺酰胺自由基介导的分子内 HAT 的第一个例子。
(图片来源:J. Am. Chem. Soc.)
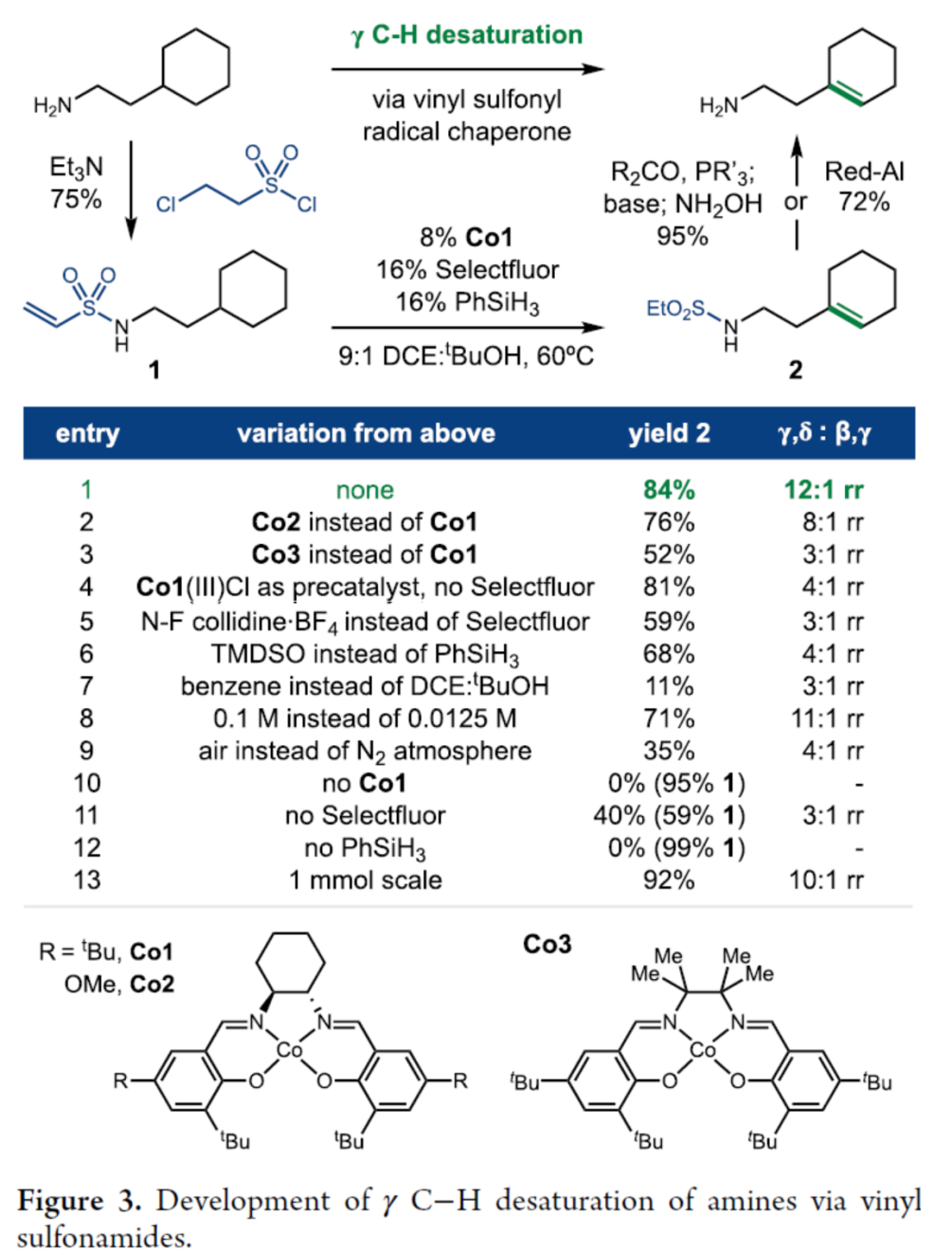
首先,作者以乙烯基磺酰胺1作为模型底物,进行了相关γ-C-H去饱和反应条件的筛选(Figure 3)。当以Co1作为催化剂,Selectfluor作为氧化剂(生成Co(III)),PhSiH3作为硅源(生成 Co-H),在DCE/tBuOH(9:1)混合溶剂中60 oC下反应14 h,可以84%的收率得到γ-C-H去饱和产物2,rr为12:1。
(图片来源:J. Am. Chem. Soc.)
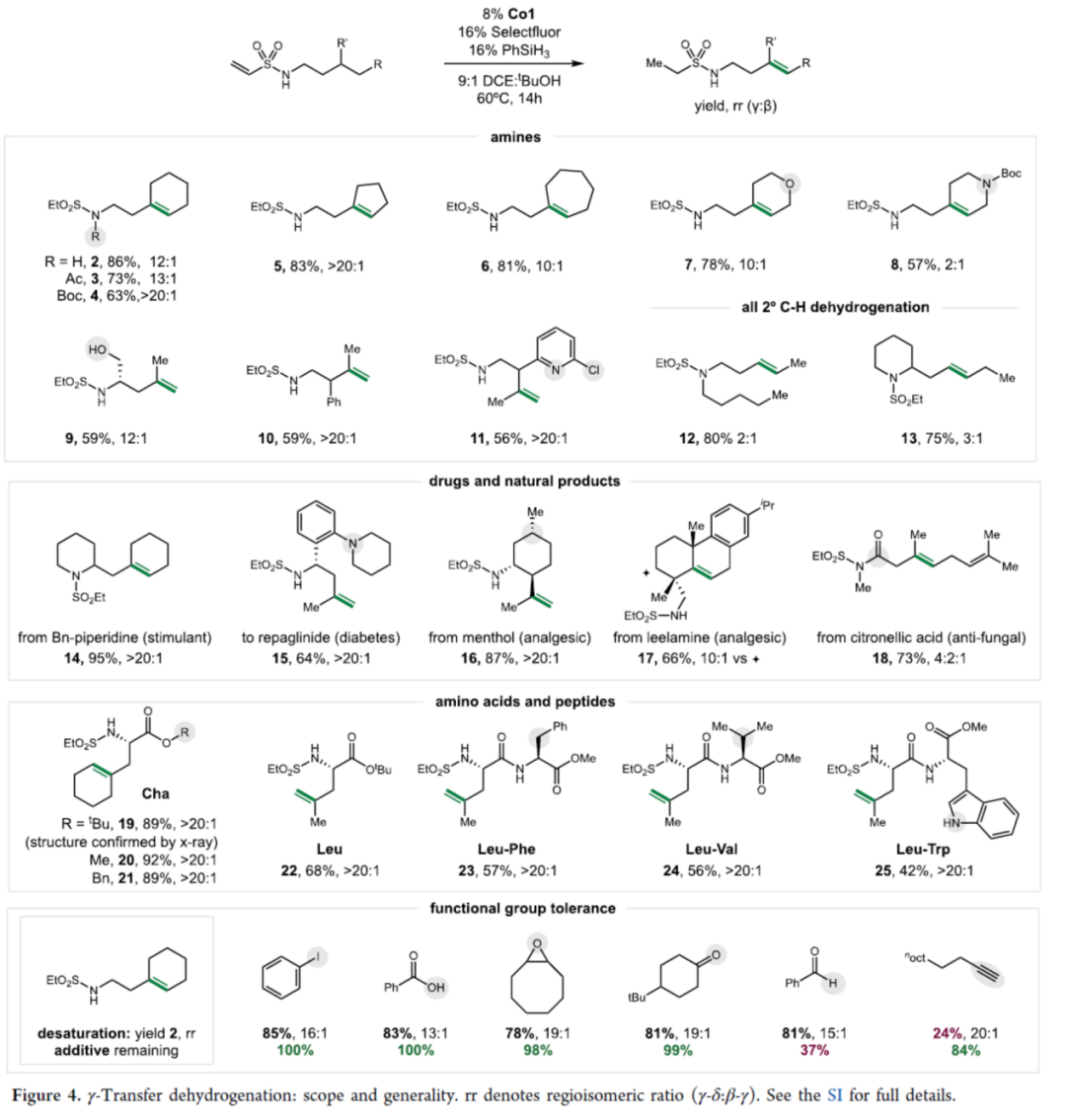
在获得上述最佳反应条件后,作者对γ-δ去饱和的底物范围进行了扩展(Figure 4)。首先,一系列不同取代的磺酰胺底物,均可顺利反应,获得相应的产物2-13,收率为57-86%,rr为2:1->20:1。值得注意的是,该策略还可用于药物分子和天然产物的后期衍生化实验,如14-18。其次,一系列氨基酸衍生物与肽,均为合适的底物,获得相应的产物19-25,收率为42-92%,rr > 20:1。此外,该反应还具有良好的官能团耐受性。
(图片来源:J. Am. Chem. Soc.)
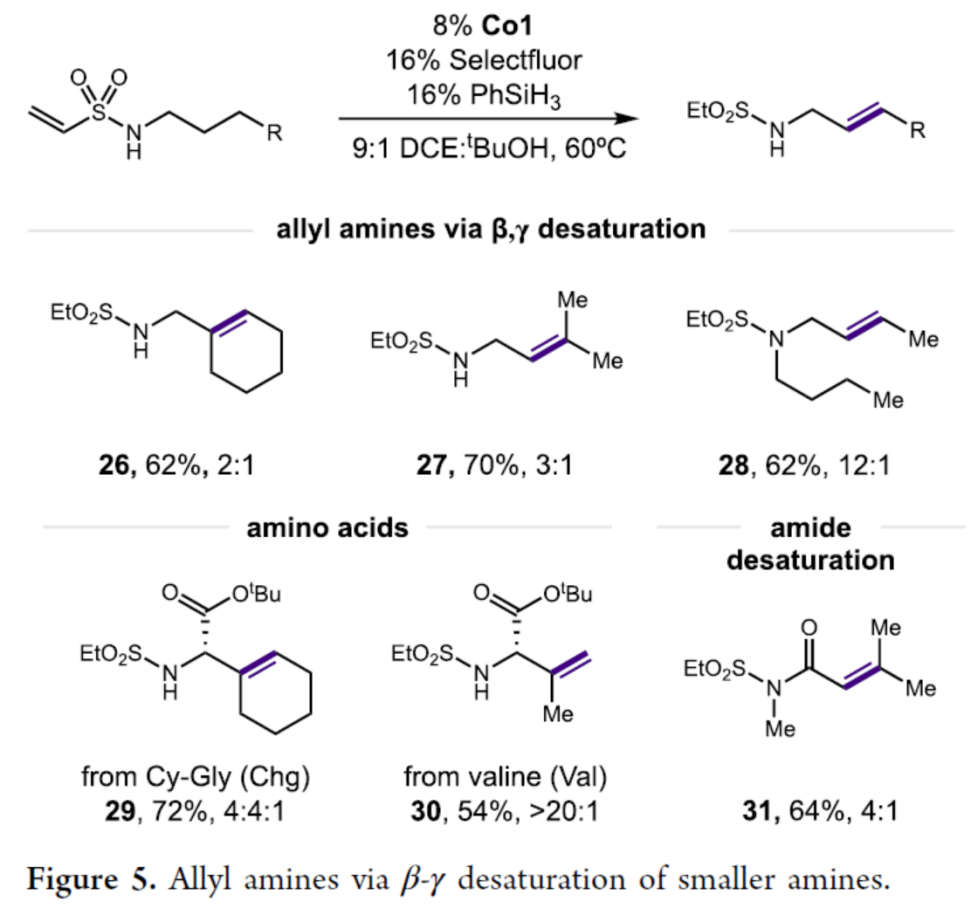
同时,作者发现,对于一些特殊的底物,反应可进行β-γ去饱和过程,获得相应的产物26-31,收率为54-72%,rr为2:1->20:1(Figure 5)。
(图片来源:J. Am. Chem. Soc.)
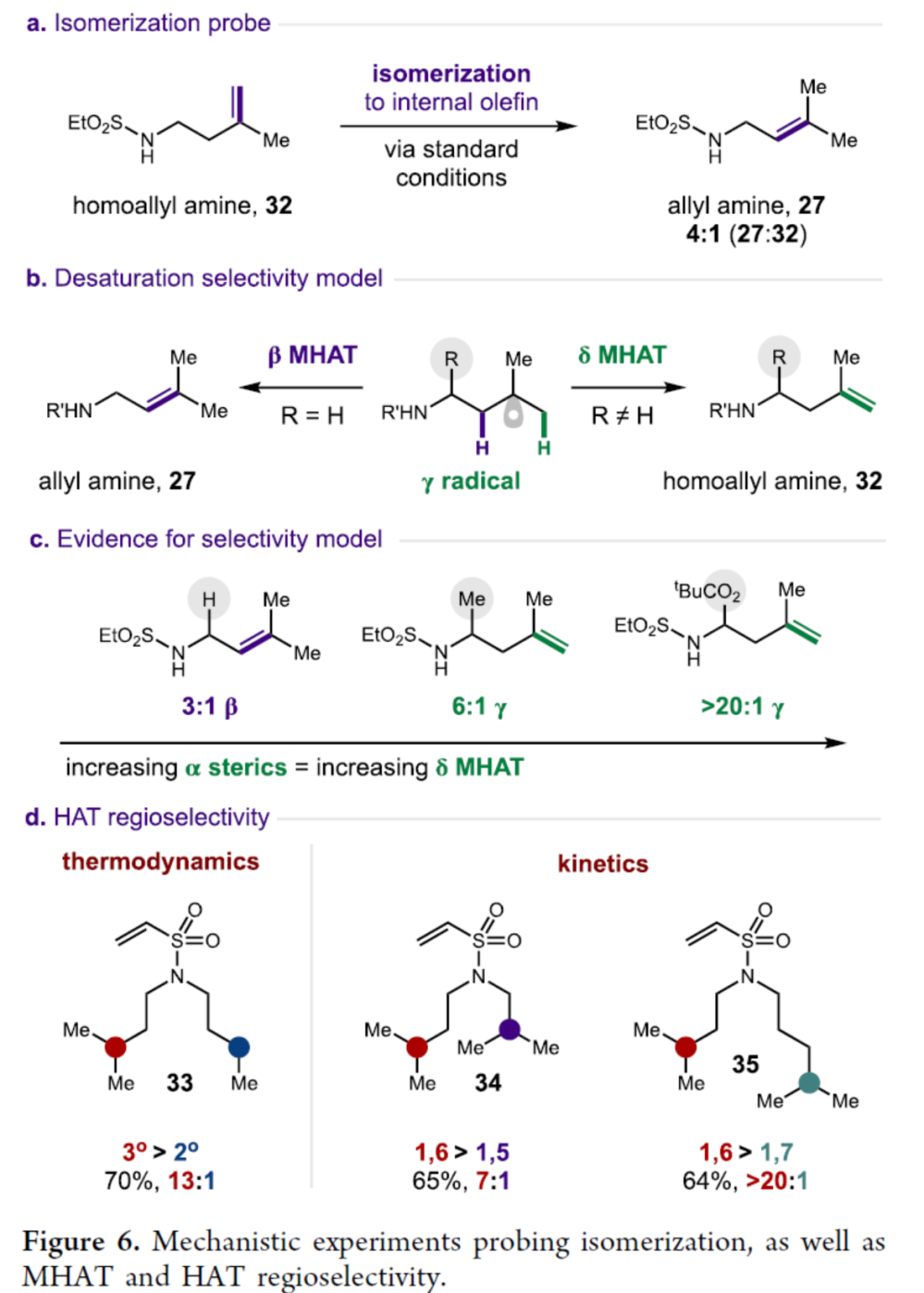
此外,作者还对反应机理进行了进一步的研究(Figure 6)。首先,高烯丙基胺32在标准条件下可异构化为三取代烯烃27,其中27:32为4:1(Figure 6a)。同时,胺底物α-或β-取代基为MHAT消除产生了空间差异,从而获得末端烯烃32而不是烯丙基胺27(Figure 6b)。因此,虽然1,6-HAT在所有情况下都选择性地生成γ-自由基,但空间位阻较小的δ MHAT(相对于β MHAT)提供了逆热力学去饱和的动力学选择性。其次,胺底物α-取代基越大,则δ MHAT选择性越高(Figure 6c)。此外,通过一系列分子内竞争实验对HAT的区域选择性进行了研究(Figure 6d)。研究表明,1,6-HAT在所有情况下都攫取γ-C-H,而MHAT(由α-或β-取代基的空间决定)提供去饱和的区域选择性。
(图片来源:J. Am. Chem. Soc.)
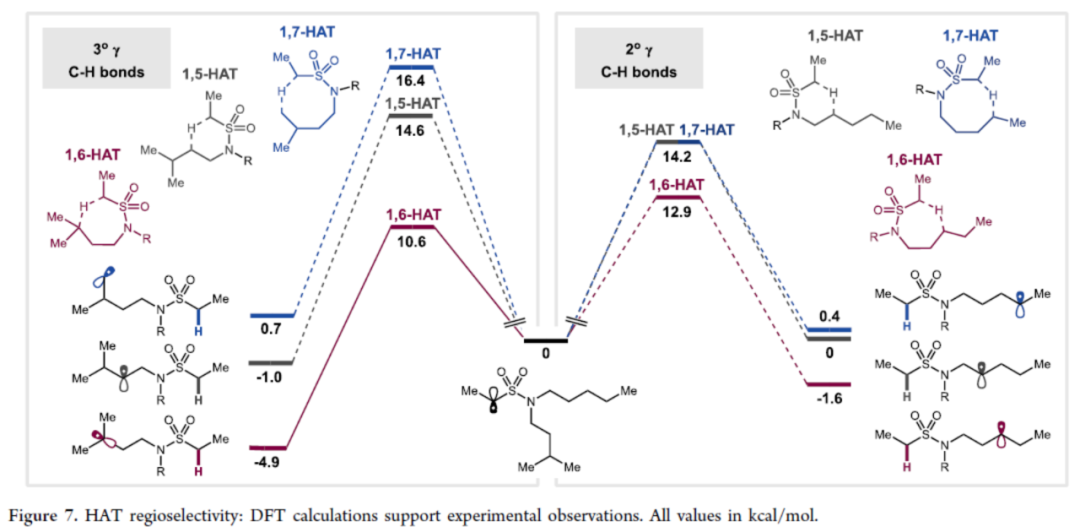
为了进一步了解反应的HAT 区域选择性,作者进行了相关的DFT 计算(Figure 7)。研究表明,在所有情况下,反应性趋势为1,6 > 1,5 > 1,7 HAT,同时该趋势也反映在远端自由基产物的相对稳定性中。
(图片来源:J. Am. Chem. Soc.)
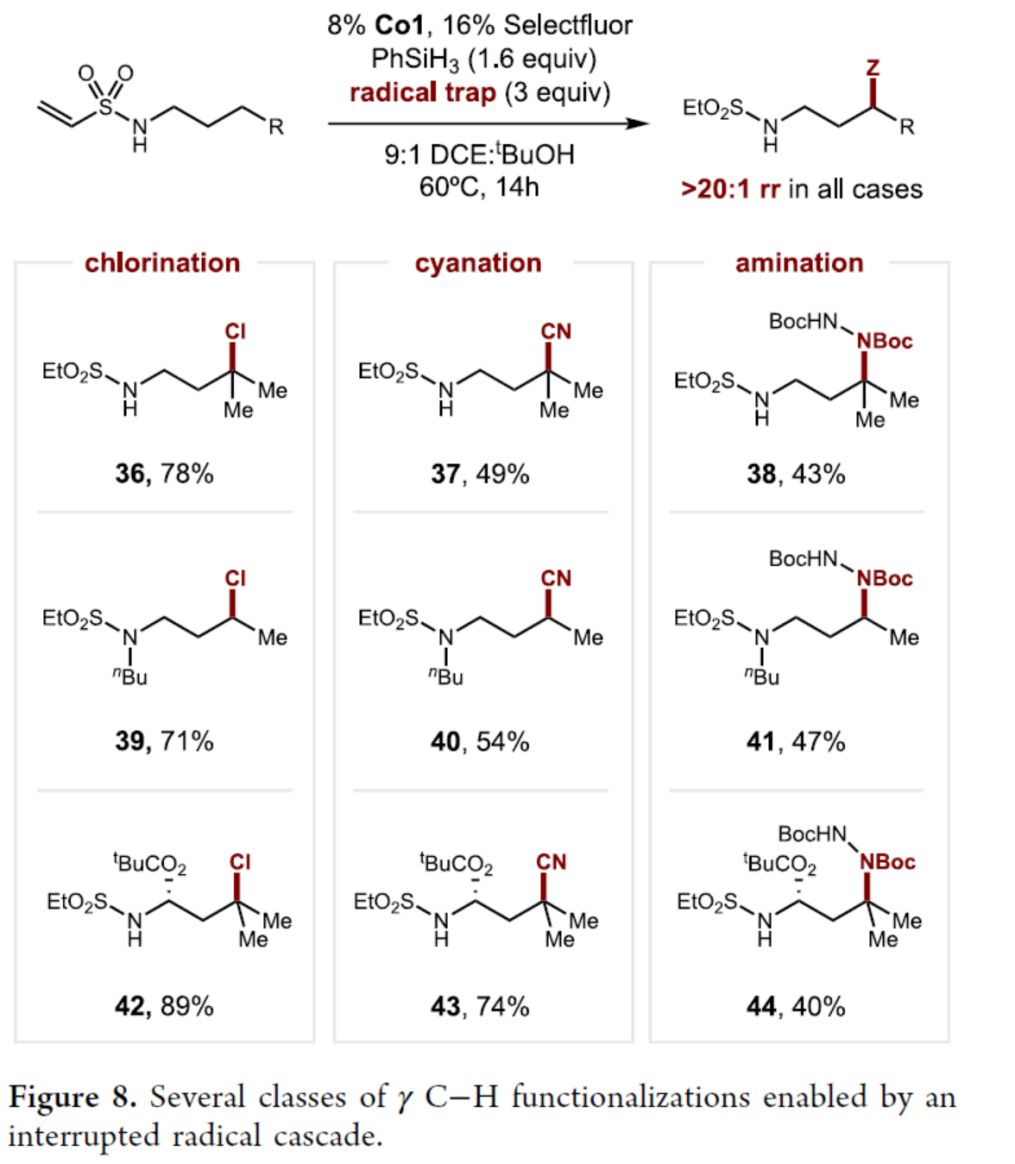
最后,作者发现,当向反应体系中加入化学计量的PhSiH3和各种自由基捕获剂(如TsCl、TsCN和DBAD),可实现γ-C-H 官能团化反应,获得相应的产物36-44,收率为40-89%(Figure 8)。
(图片来源:J. Am. Chem. Soc.)
总结
美国俄亥俄州立大学T. V. RajanBabu和David A. Nagib课题组开发了一种新型的乙烯基磺酰胺自由基chaperone,可实现胺、氨基酸和肽的化学选择性和远程去饱和反应。同时,该反应采用了
MHAT- HAT-MHAT串联策略。其次,该策略具有底物范围广泛、官能团兼容性高等特点。此外,加入自由基捕获剂来中断三重HAT串联过程,可实现了γ-选择性C-Cl、C-CN和C-N键的构建。
文献详情:

声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn