

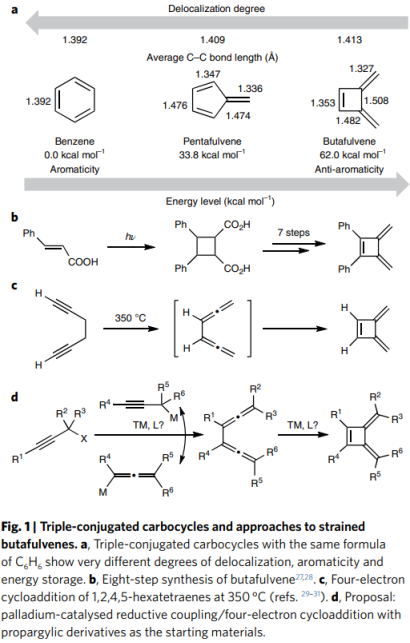
自1865年Kekulé提出苯的合理结构以来,苯及其衍生物的合成和转化就取得了里程碑式的成就,由于六个π电子的完美离域,苯是一种高度稳定的芳烃,所有碳-碳键的长度均为1.39 Å(Fig. 1a)。相比之下,苯的五元环状异构体pentafulvene表现出由环外双键引起的非常不同的反应性。如果三共轭碳环的环尺寸进一步缩小,将形成反芳香性的丁富烯,它由带有两个环外亚甲基单元的环丁烯组成。
图片来源:Nat. Chem.
60多年前,Blomquist等人从truxinic酸开始8步合成了丁富烯(Fig. 1b)。后来,Huntsman 等人报道了,1,5-己二炔可以通过1,2,4,5-六四烯中间体和随后的四电子环加成转化为丁富烯,但需要克服非常高的能垒,因为该反应在350 oC下在流动反应器中进行(Fig. 1c)。受在过渡金属催化的联烯和联烯衍生物的环化反应的启发,麻生明院士团队设想:从易得的炔丙醇衍生物和炔丙基/联烯基金属偶联形成双联烯(bisallenes),然后经历环金属化和还原消除,将温和有效地合成丁富烯(Fig. 1d)。本文中,作者展示了一种有效的钯催化策略,通过炔丙基化合物的反应快速组装了对称和非对称丁富烯。
图片来源:Nat. Chem.
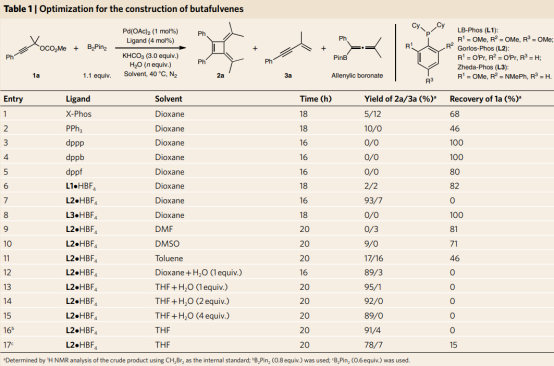
首先,作者以碳酸炔丙酯1a和B2Pin2的反应为模型反应,对反应条件进行了筛选和优化(Table 1)。得到的最佳条件是:Pd(OAc)2 (1 mol%)、Gorlos-Phos•HBF4 (4 mol%)、B2Pin2 (1.1 eq.)、KHCO3 (3.0 eq.)、H2O (2.0 eq.),在40 °C的THF中反应20 h,可以92%的产率得到丁富烯2a(entry 14)。

图片来源:Nat. Chem.
有了最佳反应条件,作者对3-芳基取代的炔丙基碳酸酯的范围进行了扩展(table 2,条件A)。具有给电子或吸电子取代基芳基的底物都适用于该反应,能以72-85%的产率得到高张力的丁富烯2a-2f。除了甲基之外,炔丙基取代基还可以是四亚甲基、五亚甲基、4-氧杂五亚甲基、二乙基和二丙基。该反应还可以在克级规模上进行,以75%的产率提供丁富烯2i。酯官能团也可以兼容,能以46%收率得到丁富烯产物2q,但需要更高的催化剂载量。当使用3-单取代炔丙基碳酸酯时,也可以获得所需的产物2r和2s。
但一级炔丙基底物与当前的最佳反应条件不相容。作者在调整联烯基前体后,原位制备的联烯基-铟试剂可以在 Pd(PPh3)4存在下与3-苯基炔丙基溴4a顺利反应合成末端丁富烯5a(条件B)。除了炔丙基溴外,炔丙基碘和氯化物也适用于该反应,分别以42%和74%的产率提供丁富烯5a。底物与苯环对位的给电子取代基和吸电子取代基都能兼容,得到丁富烯产物5b-5h。炔丙基溴苯环间位的取代基对产率没有明显影响。大位阻的2,6-二取代底物4l,也能以56%的产率获得丁富烯产物5l。当使用仲和叔炔丙基溴作为底物时,可以形成2a和5m,但产率稍低。此外,作者还在标准条件下成功完成了5a的克级规模合成,产率高达89%。
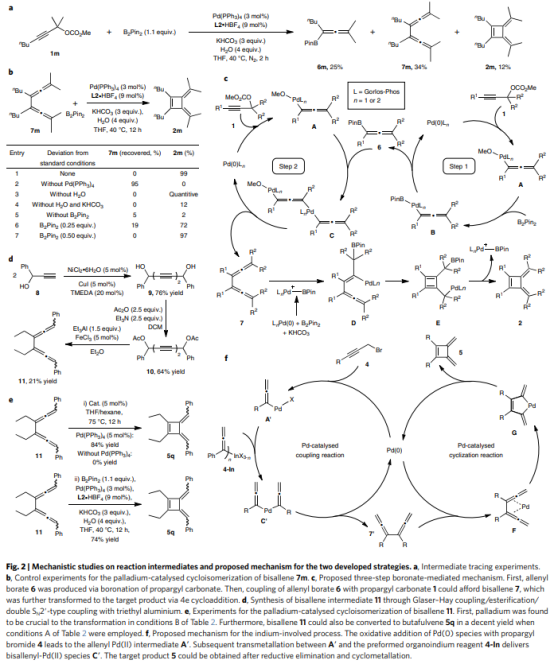
为了研究B2Pin2促进的丁富烯一锅法合成的机理(Fig. 2),作者进行了一系列对照实验。缩短反应时间或者在在较低温度下进行反应,都没有检测到相关的双联烯中间体。当反应在2 h后停止时,可以34%的收率分离得到双联烯7m。为阐明双联烯7m是否是转化的关键中间体,在最佳条件下对7m进行处理,能以99%的NMR产率形成丁富烯2m。表明钯、KHCO3和B2Pin2对2m的形成都至关重要。2m的产率与B2Pin2的量呈正相关,表明[B]物种在环化过程中具有重要作用。
图片来源:Nat. Chem.
基于以上实验结果,作者提出了B2Pin2促进的丁富烯合成机理,如Fig. 2c所示。 Pd(0)催化剂与碳酸炔丙酯的氧化加成得到联烯基钯中间体A,它与B2Pin2反应生成联烯基钯中间体B。还原消除后,得到硼酸联烯基6并再生催化活性Pd(0)。同时,另一分子联烯基钯物种A与联烯基硼酸酯6偶联,生成双联烯基钯C,C在还原消除后得到双联烯基7。随后,LnPd与B2Pin2的氧化加成,然后与KHCO3进行配体交换生成LnPd+-Bpin。双联烯 7中的两个联烯单元之一插入LnPd+-Bpin形成D,其进一步经历分子内碳钯化得到环丁二烯E。最后,在释放LnPd+-Bpin后生成丁富烯2。
对于铟介导的过程,Pd(0)物种与炔丙基溴4的氧化加成会产生联烯基Pd(II)中间体A'。随后在A'和预先形成的有机铟试剂4-In之间进行转金属化,得到双联基-Pd(II)物种C'。然后,C'还原消除得到双联烯中间体7'-Pd配合物F。F的氧化环金属化产生五元钯环物种G。G的最终还原消除得到丁富烯产物5并再生Pd(0)催化剂。
图片来源:Nat. Chem.
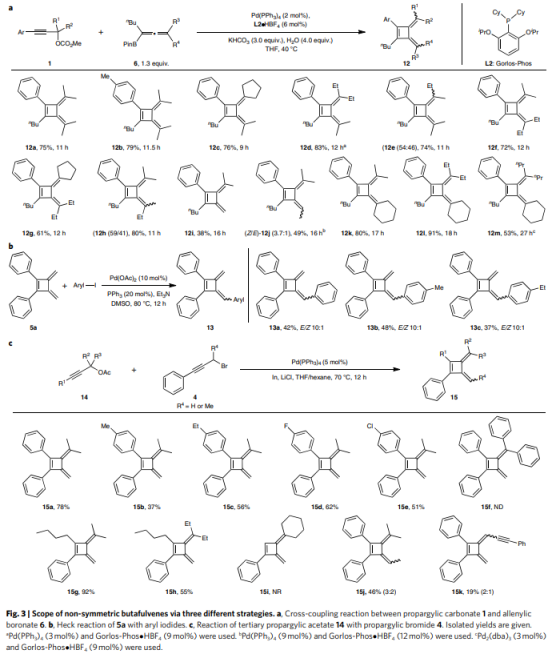
基于上述机理,作者通过碳酸炔丙酯1和联烯基硼酸酯6之间的交叉偶联反应开发了一种获得非对称丁富烯12的方法(Fig. 3a),以中等收率和良好立体选择性得到非对称丁富烯13a-c(E/Z 10:1,Fig. 3b)。此外,非对称丁富烯15也可以由叔炔丙基乙酸酯与炔丙基溴化物的反应形成(Fig. 3c)。具有不同电性的苯基取代基(R1)的叔3-芳基取代的炔丙基乙酸酯与该策略兼容(15a-15e),并且其他3-烷基取代的炔丙基也可以提供相应的产物15g和15h。仲炔丙基溴化物4j和仲炔丙基乙酸酯14k的反应分别得到相应的丁富烯15j和15k。
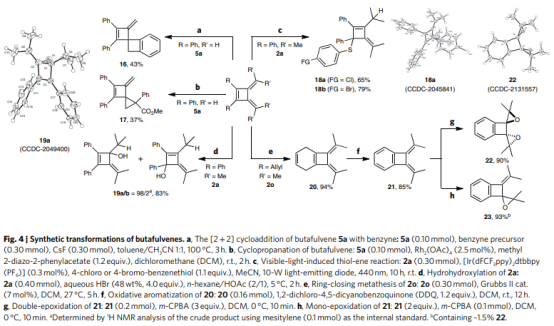
最后,作者还研究了丁富烯在合成中的应用(Fig. 4)。丁富烯5a与苯中间体的[2+2]环加成反应得到具有两个四元环的高张力螺环16,其中末端C=C键用于进一步的合成转化。5a与2-重氮-2-苯乙酸甲酯的环丙烷化反应可以得到双环产物17。此外,可见光诱导下,2a中的二烯单元与4-氯或4-溴-苯硫醇反应,能以良好的产率专一得到1,4-加合物18a和18b。2a中的两个环外C=C键之一可以在HBr水溶液中氢羟基化,具有显著的区域选择性,形成19a。当R基团是烯丙基单元时,2o的RCM反应可以94%的收率获得[4.2.0]-双环产物20,其可以进一步芳构化得到苯并环丁烷21。21的环氧化在不同当量的m-CPBA 条件下,可以分别得到高张力的苯并环丁二螺环环氧乙烷22和23。
图片来源:Nat. Chem.
总结:麻生明院士、郑剑教授、陈庆安研究员团队通过使用容易获得的炔丙基碳酸酯或溴化物作为起始原料,开发了一种实用且全面的钯催化构建高张力对称或非对称反芳香性丁富烯的方法,该方法反应条件温和、底物适用性广泛,将促进丁富烯化学的发展。
文献详情:
Xin Huang, Bing-Zhi Chen, Pengbin Li, Ding-Wei Ji, Jinxian Liu, Hao Zheng, Sa-Na Yang, Yan-Cheng Hu , Boshun Wan, Xiang-Ping Hu, Chunling Fu, Yankai Huang, Jian Zheng*, Qing-An Chen*, Shengming Ma*. Palladium-catalysed construction of butafulvenes. Nat. Chem. 2022. https://doi.org/10.1038/s41557-022-01017-9
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn