

正文
(图片来源:Nat. Chem.)
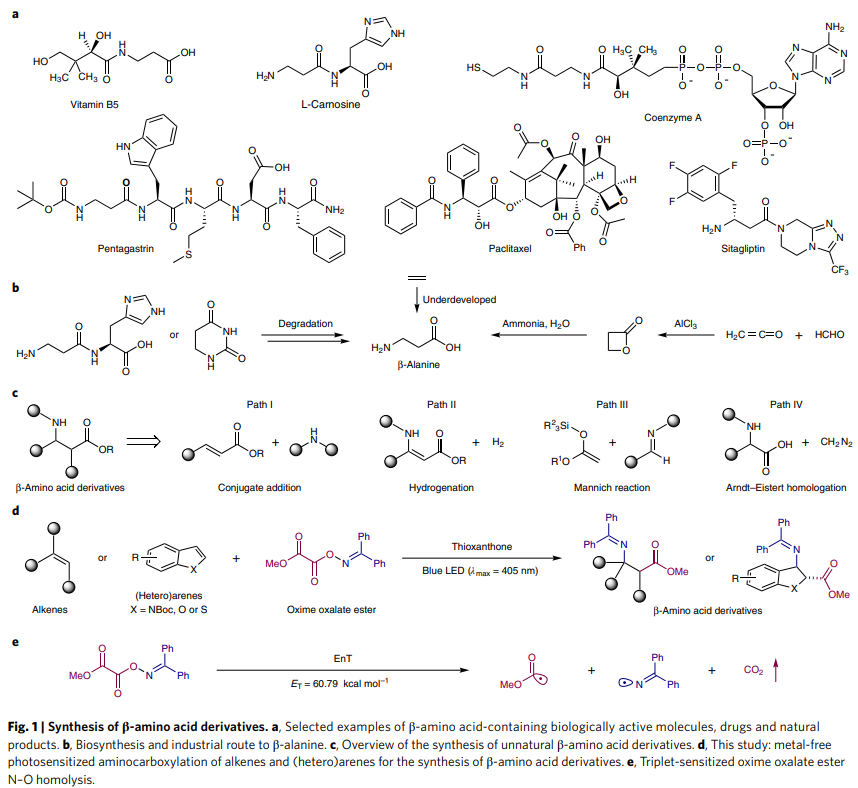
β-氨基酸作为一种重要的结构骨架广泛存在于众多生物活性分子、药物以及天然产物中(Fig. 1a)。此外,由于此类骨架可以增加代谢稳定性,β-氨基酸也被广泛用于构建生物活性多肽和模拟肽学。因此,探索β-氨基酸及其衍生物的高效合成在有机化学和药物化学中具有重要意义。
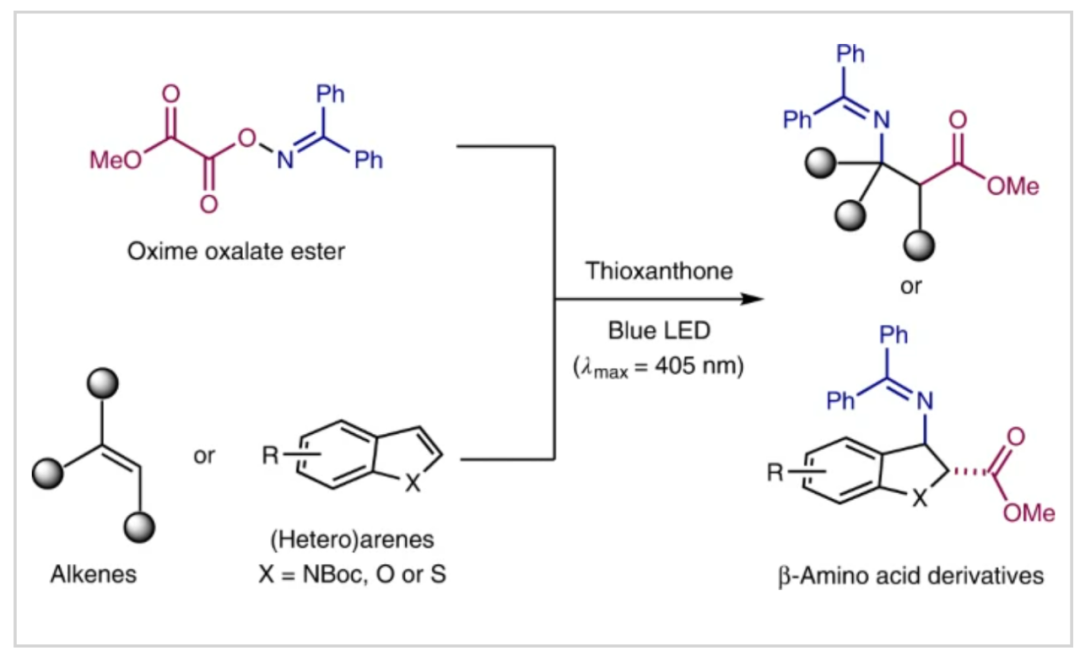
β-丙氨酸作为最简单的β-氨基酸,是唯一天然存在的β-型氨基酸,其可以用于食品添加剂和药物,与我们的日常生活密不可分。目前,在生物合成中可以通过二氢尿嘧啶和肌肽降解来合成β-丙氨酸。而大部分β-丙氨酸的生产主要来源于氨与β-丙内酯反应的工业化生产过程。尽管这是一种高效制备β-丙氨酸的方法,但β-丙内酯需要多步制备且反应条件苛刻等不足降低了其经济效益。从环境和经济效益上来讲,如果直接选用简单易得的乙烯作为起始原料来实现β-氨基酸的工业制备,则具有重要的意义(Fig. 1b)。
近些年,化学家们利用各种合成方法制备非天然β-氨基酸衍生物取得了很大的进展。主要包括以下策略:1)胺亲核试剂与α,β-不饱和羧酸衍生物的共轭加成(Fig. 1c, Path I);2)贵金属(Rh, Ir, Ru)催化β-胺基丙烯酸酯的氢化反应(Fig. 1c, Path II);3)烯醇硅醚与亚胺的Mannich类型反应(Fig. 1c, Path III);4)α-氨基酸与重氮甲烷的多步Arndt–Eistert同系化反应(Fig. 1c, Path IV)。尽管上述方法可以实现β-氨基酸的制备,但是这些方法通常需要通过多步操作对起始原料进行预官能团化,从而降低了反应的实用性。除此之外,刘国生小组(J. Am. Chem. Soc. 2015, 137, 2480)和Ruben Martin小组(J. Am. Chem. Soc. 2021, 143, 4949)分别利用CO和CO2作为羰基源实现了β-氨基酸的制备。但是也具有底物范围局限、原料需要多步制备、反应时间长、会产生金属催化剂残留等不足。近年来,可见光作为一种安全、可再生和廉价的化学能源可促进复杂有机分子的合成,目前已经成为有机合成中的重要手段。最近,德国明斯特大学Frank Glorius课题组发展了光催化,利用简单的烯烃或杂芳烃作为起始原料,高区域选择性的实现了分子间的胺基-羧基化反应,构建了一系列β-氨基酸衍生物(Fig. 1d)。反应中使用稳定的肟草酸酯作为双官能团化试剂,通过能量转移(EnT)策略一步实现了胺基-羧基化过程,从而发展了一种构建β-氨基酸衍生物的新策略(Fig. 1e)。
(图片来源:Nat. Chem.)
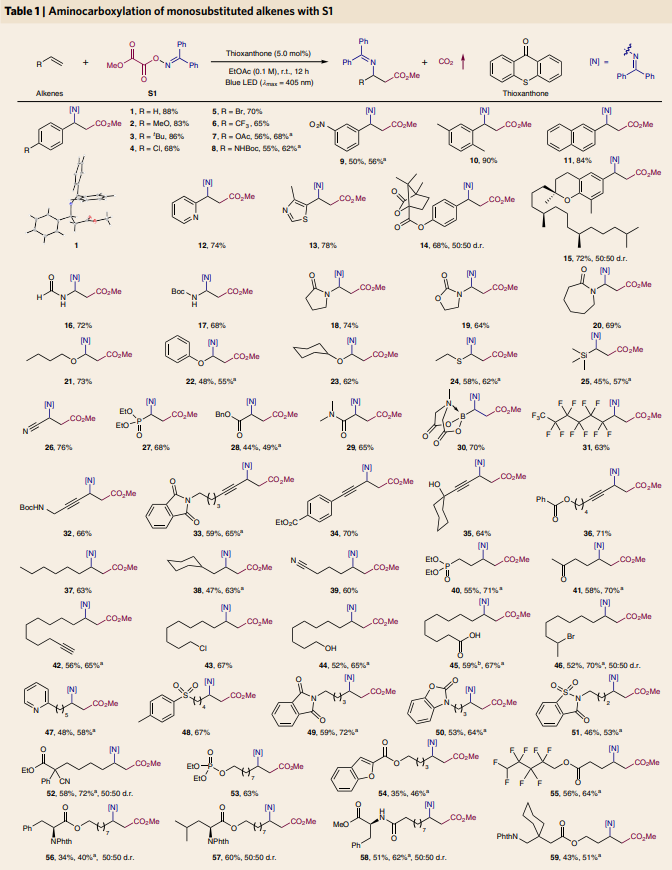
作者首先选用肟草酸酯S1和苯乙烯A1作为模板底物进行反应尝试和条件筛选,发现当使用A1 (0.2 mmol), S1 (0.3 mmol), 噻吨酮 (5.0 mol%), EtOAc (0.1 M), 18 W blue LED (λmax = 405 nm), 氩气氛围,室温下反应12小时可以以88%的分离产率得到β-氨基酸产物1。此外,作者在条件敏感性筛选中得出该反应相对比较稳定,只是在低光强度或高氧浓度下产率有所下降。随后,作者对此反应中单取代烯烃的底物范围进行探索。实验结果表明反应对富电子烯烃、贫电子烯烃、烯炔以及非活化的烯烃均可以兼容。此外,对于含有复杂分子结构的端烯同样具有良好的兼容性,以较高的产率得到相应的β-氨基酸产物47-59(Table 1)。
(图片来源:Nat. Chem.)
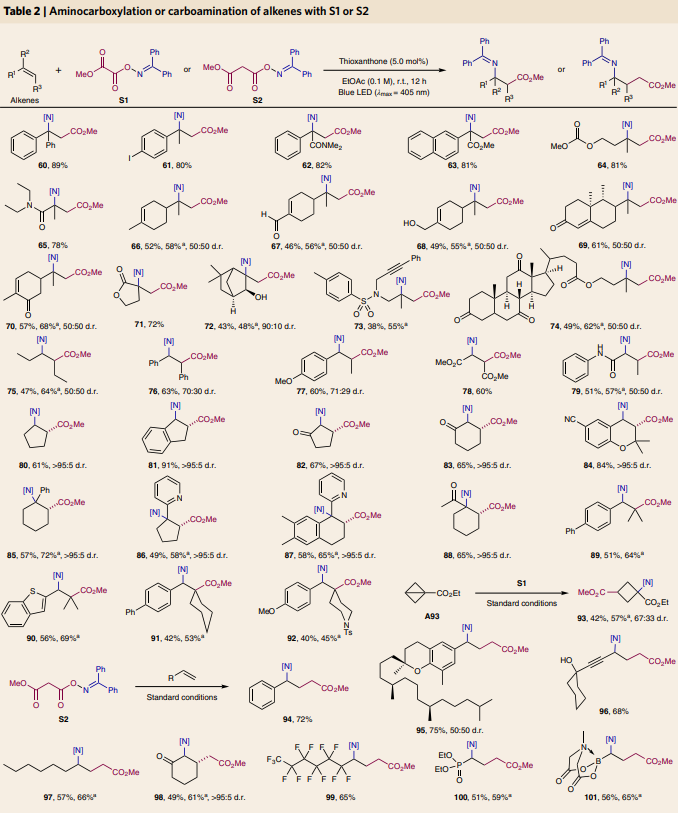
在对单取代烯烃的底物范围进行探索后,作者尝试对立体位阻更大的多取代烯烃的兼容性进行探索(Table 2)。实验结果表明,1,1-二取代烯烃、对称与非对称的1,2-二取代烯烃以及三取代烯烃均能顺利实现此转化。遗憾的是,可能是由于立体位阻过大,四取代烯烃不能兼容此反应。值得注意的是,具有较大环张力的三环底物A93也可作为合适的受体,以42%的产率实现四元环氨基酸衍生物93的合成。除此之外,当作者选取S2作为双官能团化试剂时,利用此方法在标准条件下还可以实现一系列γ-氨基丁酸(GABAs)衍生物94-101的合成。
(图片来源:Nat. Chem.)
在已报道自由基与不饱和键的加成反应中,通常选用烯烃或炔烃作为底物。而杂芳环中的不饱和键由于活性相对较低,通常应用在自由基加成反应中具有一定局限性。高兴的是,此反应体系对杂环(吲哚、苯并呋喃、苯并噻吩、菲、蒽)的加成过程同样具有良好的兼容性。值得注意的是,这些产物中的绝大多数利用已有文献报道的方法是很难合成的(Table 3)。
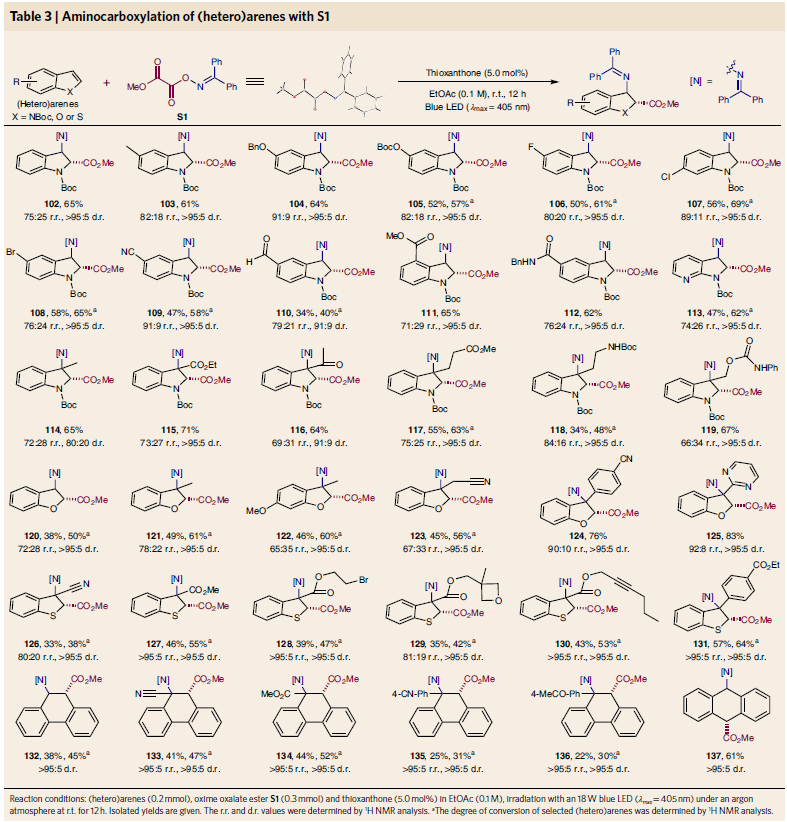
(图片来源:Nat. Chem.)
接下来,为了证明此转化的实用性,作者进行了一系列合成应用(Fig. 2)。首先,选用手性双官能团化试剂S3可以实现不对称胺基-羧基化过程,以56%的产率(d.r. = 75:25)实现138的合成(Fig. 2a)。随后,作者对合成出的β-氨基酸产物1, 26, 94进行了多种合成转化,证明了β-氨基酸产物的较高合成价值(Fig. 2b)。值得注意的是,利用S1(5.0 mmol)和乙烯(2.0 bar)作为原料,利用此方法可以以90%的产率直接一步合成β-丙氨酸衍生物147,随后经过简单的水解即可得到β-丙氨酸148。而148还可以通过四步转化以49%的总产率实现生物活性分子L-carnosine 152的合成(Fig. 2c)。除了生物活性分子外,利用β-丙氨酸还可以实现一系列药物核心结构的构建。例如,利用148可以通过三步,87%的总产率实现抗炎药balsalazide 155的合成(Fig. 2d)。此外,利用此方法使用A94和S1作为原料,可以通过五步高效合成出治疗2型糖尿病的口服药(±)-sitagliptin 160(Fig. 2e)。
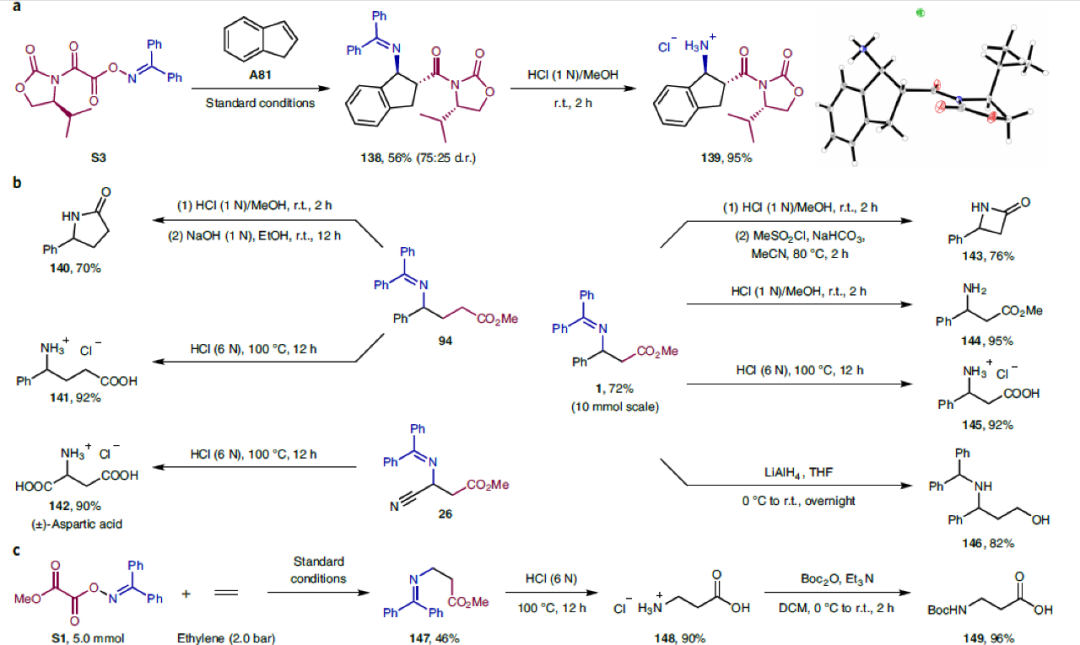
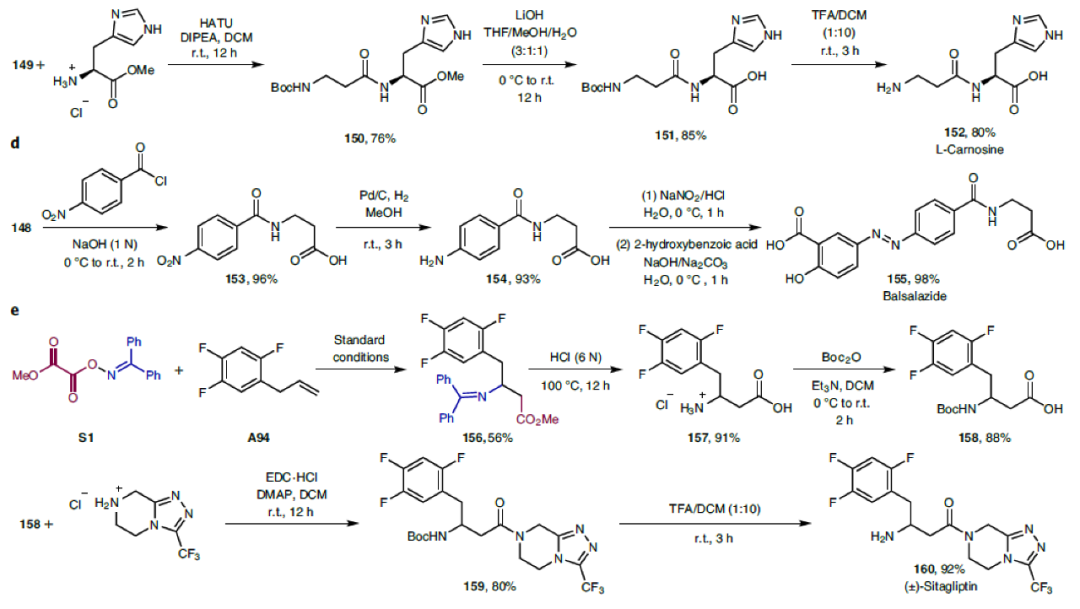

(图片来源:Nat. Chem.)
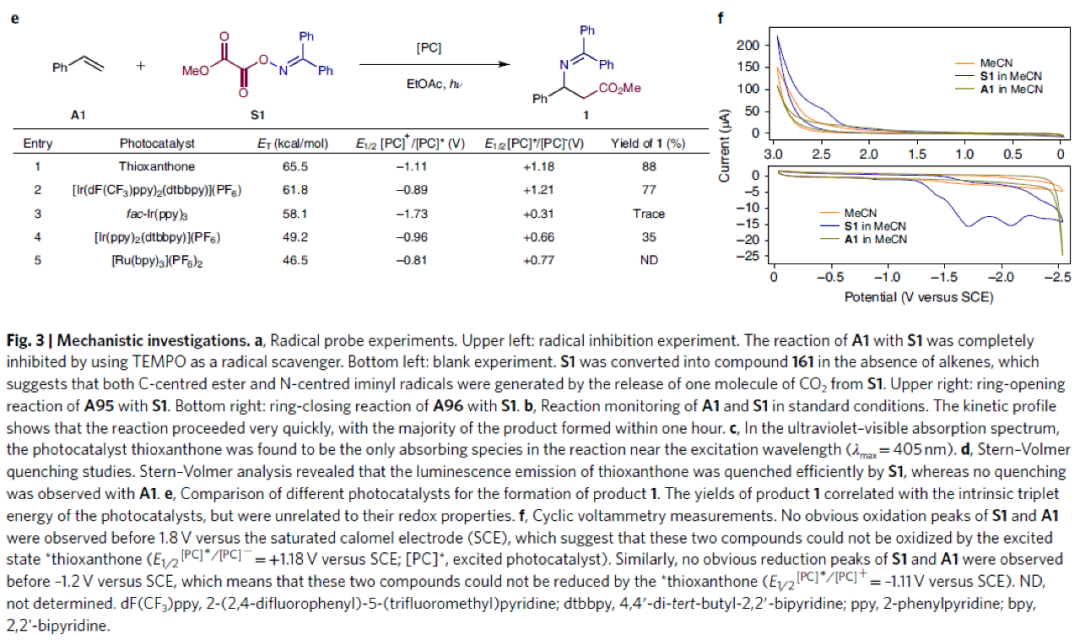
为了深入探索反应机理,作者进行了一系列控制实验(Fig. 3)。通过实验主要得出以下结论:1)反应中涉及氮自由基中间体(Fig. 3a);2)反应进行得很快,并没有明显的诱导期,大部分产物在1小时内形成(Fig. 3b);3)紫外可见吸收光谱表明在激发波长(λmax = 405 nm)附近,噻吨酮是唯一的吸收物种(Fig. 3c);4)S1能够有效淬灭噻吨酮发光,而A1不能淬灭,这表明反应中噻吨酮与S1之间存在相互作用(Fig. 3d);5)反应中可能存在Dexter型的三线态-三线态能量转移过程(Fig. 3e);6)利用循环伏安法排除了S1被激发态的噻吨酮单电子转移还原的可行性(Fig. 3f)。
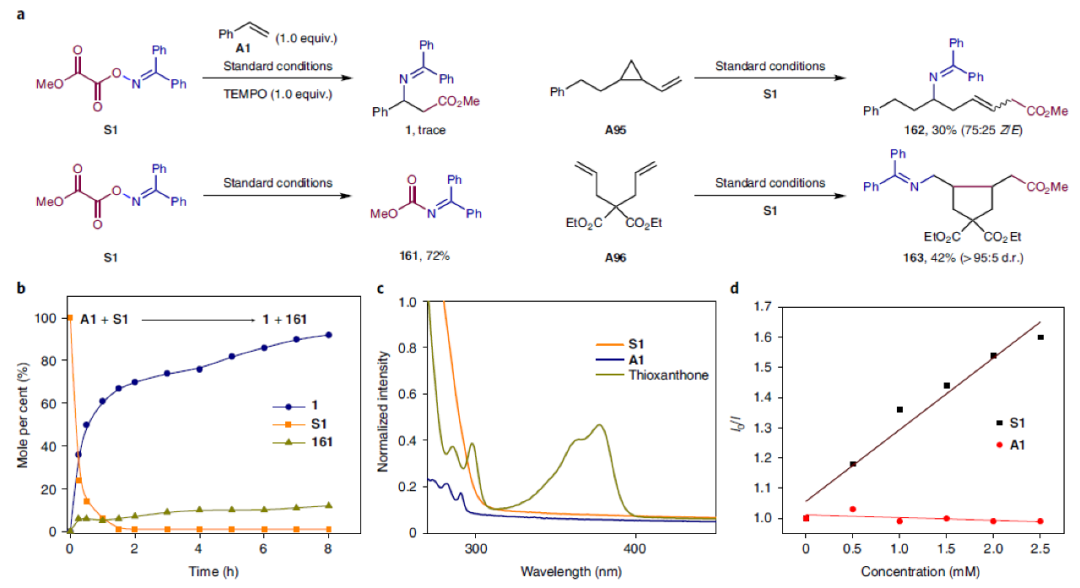
(图片来源:Nat. Chem.)
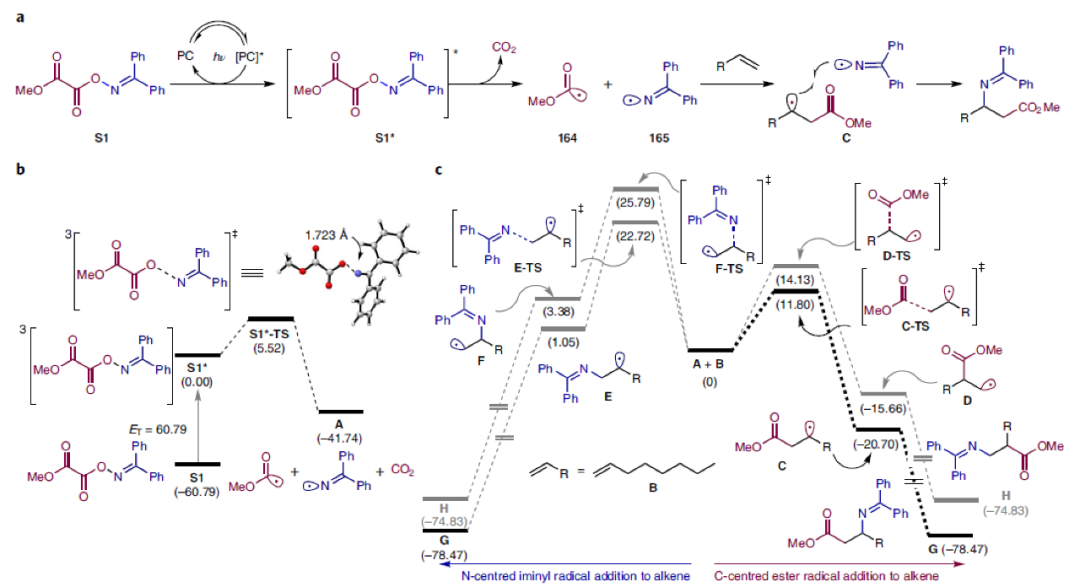
最后,作者通过DFT实验对机理进行进一步探索(Fig. 4)。S1的三线态能量(60.79 kcal mol–1)足够与激发态的噻吨酮(ET = 65.5 kcal mol–1)经历三线态-三线态能量转移(TTEnT)过程。接着S1*可以经历N-O键的断裂并释放CO2(5.5 kcal mol–1)形成碳自由基164和氮自由基165(Fig. 4a, b)。随后通过对164和165与烯烃自由基加成的四种可能路径进行比较,作者认为:通过自由基加成过程可以解释为什么反应具有高区域选择性(Fig. 4c)。

(图片来源:Nat. Chem.)
总结
德国明斯特大学Frank Glorius课题组发展了光催化,利用简单的烯烃或杂芳烃作为起始原料高区域选择性的实现了分子间的胺基-羧基化反应。此反应条件温和,无需金属参与,底物范围广,官能团兼容性好,为β-氨基酸和γ氨基酸衍生物的合成提供了新策略。
文献详情:

长按或扫码左侧二维码查看原文
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn