

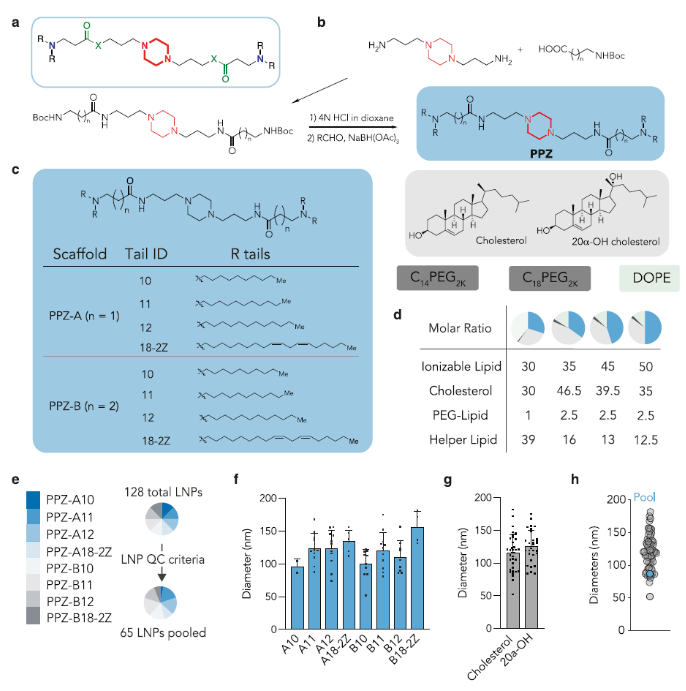
图1.哌嗪衍生的LNP的合成与表征(图片来源:Nat. Commun.)
研究背景
肝脏作为人体最大的代谢器官兼具储存糖原及造血功能,其中肝血窦(相邻肝板之间的腔隙,是一种特殊的毛细血管)包含不连续的脉管系统以及缓慢的血流,有利于肝细胞与血流之间进行物质交换,增加了纳米颗粒外渗和与肝细胞的相互作用,因此将RNA递送至非肝细胞成为亟待解决的问题。目前研究人员侧重于以下几个方面:1)对动物进行预处理,使肝细胞提前过载,从而改变LNP嗜性。然而,目前尚不清楚这种多步骤策略是否具有临床相关性;2)LNP偶联活性靶向配体。例如,DLin-MC3-DMA(一种经FDA批准用于肝细胞siRNA递送的可电离lipid)结合抗体可重新靶向免疫细胞。这种方法的潜在限制是——含有RNA药物的主动靶向纳米颗粒在临床试验中可引起不良事件。3)单个识别纳米颗粒体内代谢途径,实现内源性靶向。此方法需要高通量体内筛选,不适用于大型lipid库。因此目前大部分lipid高通量筛选处于在体外细胞水平。本文中,作者通过DNA序列“条形码”,筛选了65种不同的LNP,每个LNP均用独特的“条形码”标记。体内注射后,对从不同组织中提取的条码进行测序,通过检索14种细胞类型的DNA“条形码”,便可知其体内分布。
关键合成步骤
作者首先设计了由哌嗪核心和两个叔胺组成的可电离脂质体头部,其可与疏水碳链相连(Pi-Lipids)(图1a)。其中以哌嗪为核心,添加了从C10到C12的饱和烃链(之前研究表明C10到C12的烷烃长度有助于增强细胞膜穿透;ID:10-12)。此外,亚油酸链也被证实可增强LNP的胞内递送,因此作者也将其纳入体系(ID:18-2Z)(图 1b,c)。这八种新的基于哌嗪的可电离脂质体具体合成步骤如下:1,4-双(3-氨基丙基)哌嗪与Boc保护的β-丙氨酸或γ-氨基丁酸通过酰胺偶联反应12小时,产生哌嗪中间体,产率为50%。随后脱除Boc保护基,然后与不同疏水醛进行一锅法还原胺化反应,得到最终的哌嗪基脂质(PPZ),产率为32%至59%。作者改变了碳链键的长度并在两个骨架中合成了lipid,PPZ-A含两个碳,PPZ-B含三个碳。脂质结构通过核磁共振和高分辨率质谱分析确证。
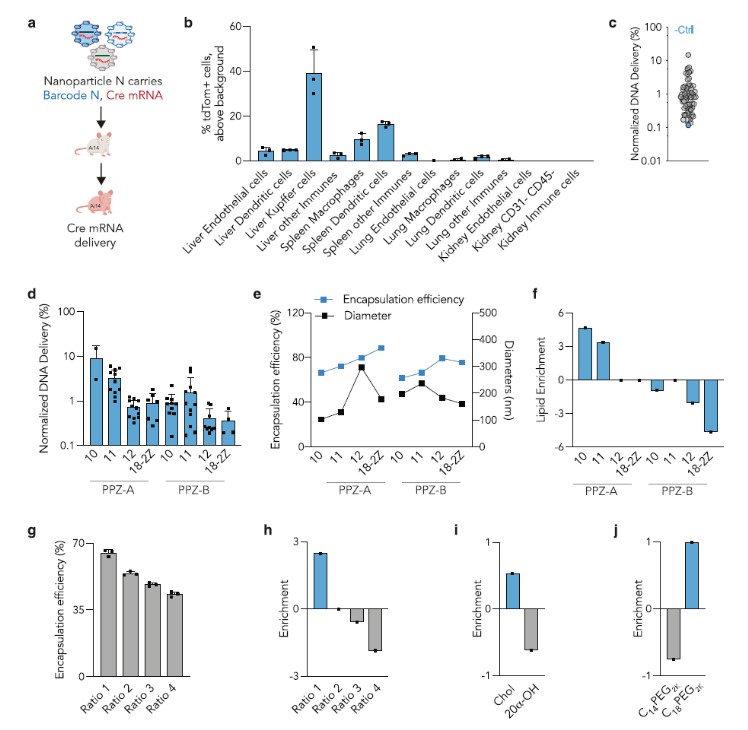
图2. 量化分析65种mRNA LNP体内递送以及结构分析(图片来源:Nat. Commun.)
PPZ lipid与mRNA形成脂质纳米颗粒
作者进一步研究了Pi-Lipids是否可制备为单分散LNP(Pi-LNP)。采用了(i)可电离阳离子lipid;(ii)两种具有不同碳链长度的PEG-lipid(C14PEG2K和C18PEG2K);(iii)两种胆固醇(胆固醇、20α-羟基胆固醇);(iv)磷酸乙醇胺(DOPE)。作者将Cre mRNA和DNA“条形码”以10比1的质量比进行混合。每个LNP都经过配制以携带其独特的DNA“条形码”,所有DNA“条形码”均为91nt长的单链DNA序列。用硫代磷酸酯修饰5'和3'末端以减少外切核酸酶降解,采用通用正向和反向引物区域以确保每个序列的相等扩增,包含7个随机核苷酸以监测PCR偏差。
在对65个Pi-LNP进行表征后,作者将其静脉注射入Ai14小鼠中(图 2a)。Ai14小鼠在CAG启动子下游有一个Lox-Stop-Lox-tdTomato构建体。因此,如果Cre mRNA被递送到靶细胞中并随后翻译成Cre蛋白,则细胞变为tdTomato+(图 2a)。通过荧光激活细胞分选分离tdTomato+细胞并对细胞进行测序,在tdTomato+细胞内分离与特定LNP相关的DNA 条形码。作者共量化了14个不同细胞群的tdTomato+细胞的百分比(图 2b)。在枯否细胞中观察到40%的tdTomato+细胞,在脾巨噬细胞中为10%,在脾树突细胞中为16%。在肝内皮细胞和树突细胞tdTomato+%<5%,肺和肾没有观察到tdTomato+细胞。之后,作者使用下一代DNA测序研究了65个LNP。然后,使用大型数据集对所有细胞类型进行全面结构分析。首先,分析了基于不同Pi-Lipid结构的LNP的平均归一化递送,发现含有PPZ-A10的Pi-LNP 表现出最高的递送,其次是PPZA11(图 2d)。作者假设在Pi-LNP之间观察到的标准化传递的差异可能是由于封装效率或LNP直径差造成的。为了验证这一假设,配制了八个LNP,仅改变可电离脂质结构,同时保持相同的摩尔比和化合物组成,并测量每个LNP的直径和封装效率(图 2e)。作者观察到分别用PPZ-A10到PPZ-A18-2Z配制的Pi-LNPs的封装效率从66%增加到88%,这表明封装效率随着碳链越长而增加。然而,具有较长碳链的Pi-LNP也显示出150到300 nm大直径,不利于LNP的体内递送。用PPZ-A和PPZ-B脂质配制的Pi-LNP之间的封装效率相当,但含有PPZ-B脂质的Pi-LNP 比PPZ-A的尺寸大,因此体内递送量降低(图 2d)。
总结
本文中,作者通过设计、合成和表征128种新型Pi-LNP,并将核酸递送到体内的非肝细胞。其中LNP-A10,以低至0.3mg/kg的剂量优先向肝脏和脾脏免疫细胞递送mRNA。作者将PPZ脂质的结构与包含哌嗪基序的商业脂质(C12-20039)进行比较,其添加了酰胺键并去除了羟基。羟基会产生立体异构体,使纯化变得困难。相比之下,PPZ脂质是手性纯的,这使得它们更容易纯化。作者发现与之前报道的C12-20039相比,Pi-LNP对脾巨噬细胞和树突状细胞的递送增加。
文献详情:

长按或扫码左侧二维码查看原文
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn