- 首页
- 资讯
JACS:可见光光催化喹啉与炔烃的peri-(3+2)环加成反应
来源:化学加网原创 2022-09-09
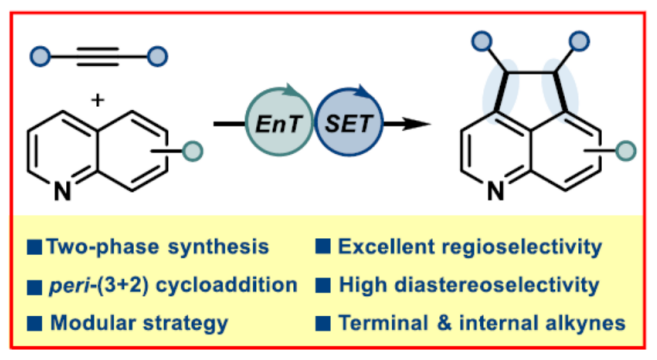
导读:近日,德国明斯特大学Frank Glorius课题组报道了一种喹啉与炔烃的形式peri-(3+2)环加成反应,合成了一系列氮杂苊(aza-acenaphthenes)衍生物。其中,市售的铱配合物具有光敏剂和光氧化还原催化剂的双重作用,可促进环化/重芳构化的串联过程。最初的能量转移生成苊骨架,而随后的氧化还原穿梭步骤(shuttling step)实现了相应的芳构化。当以8-取代的喹啉和菲咯啉为底物时,可与末端和内炔烃顺利反应,且具有出色的区域和非对映选择性。此外,美国加州大学洛杉矶分校K. N. Houk课题组还对EnT/SET过程进行了相关的理论计算。文章链接DOI:10.1021/jacs.2c05687
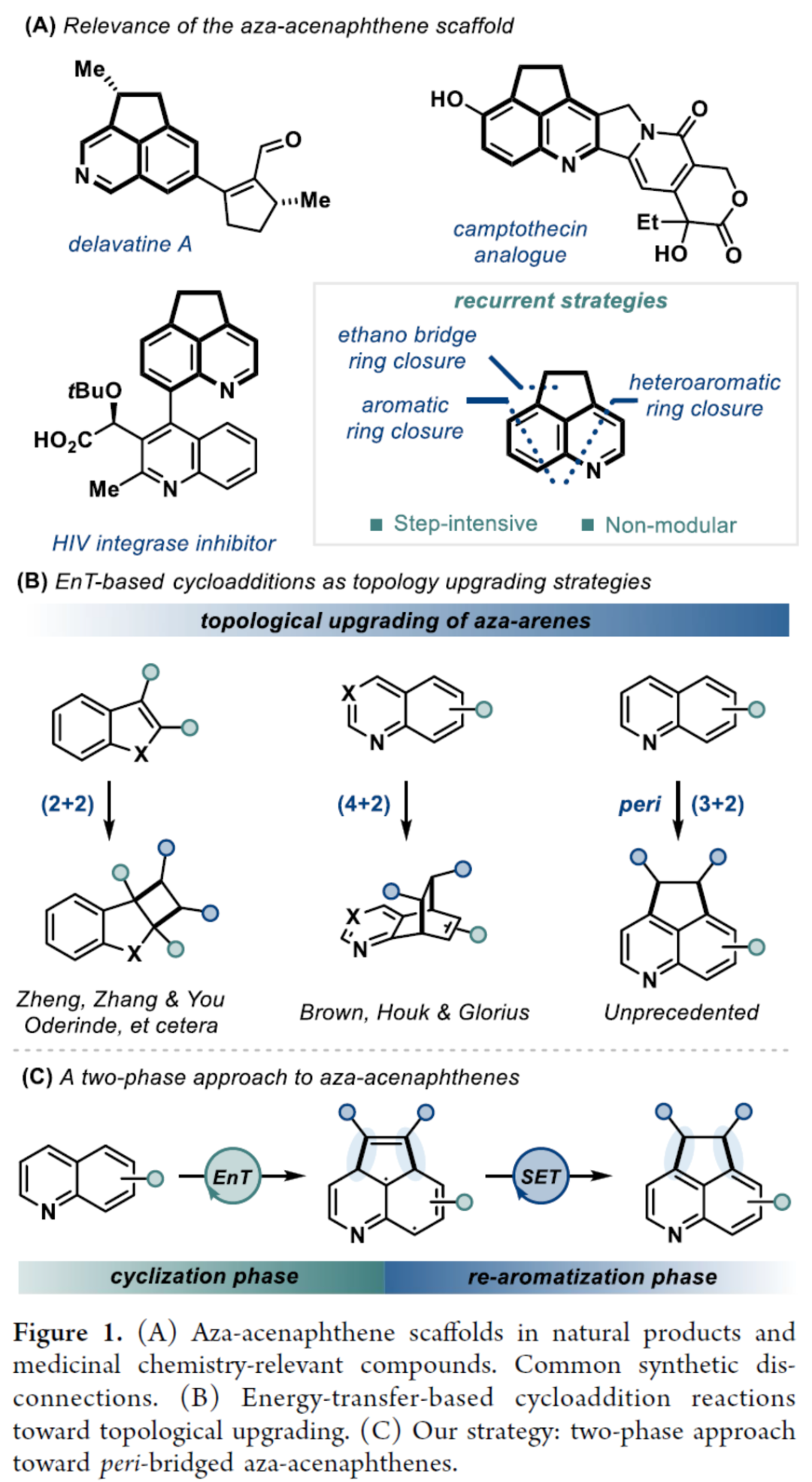
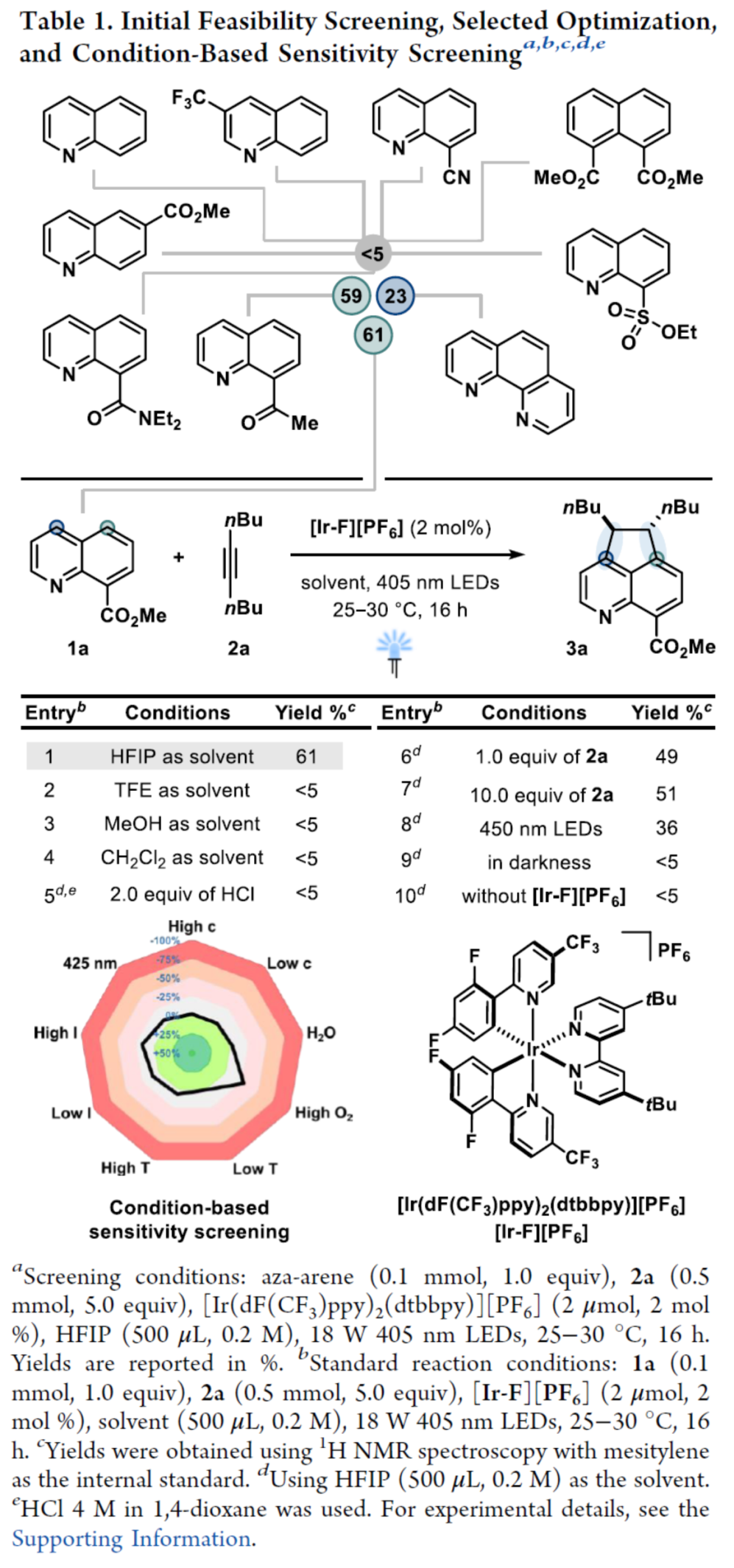
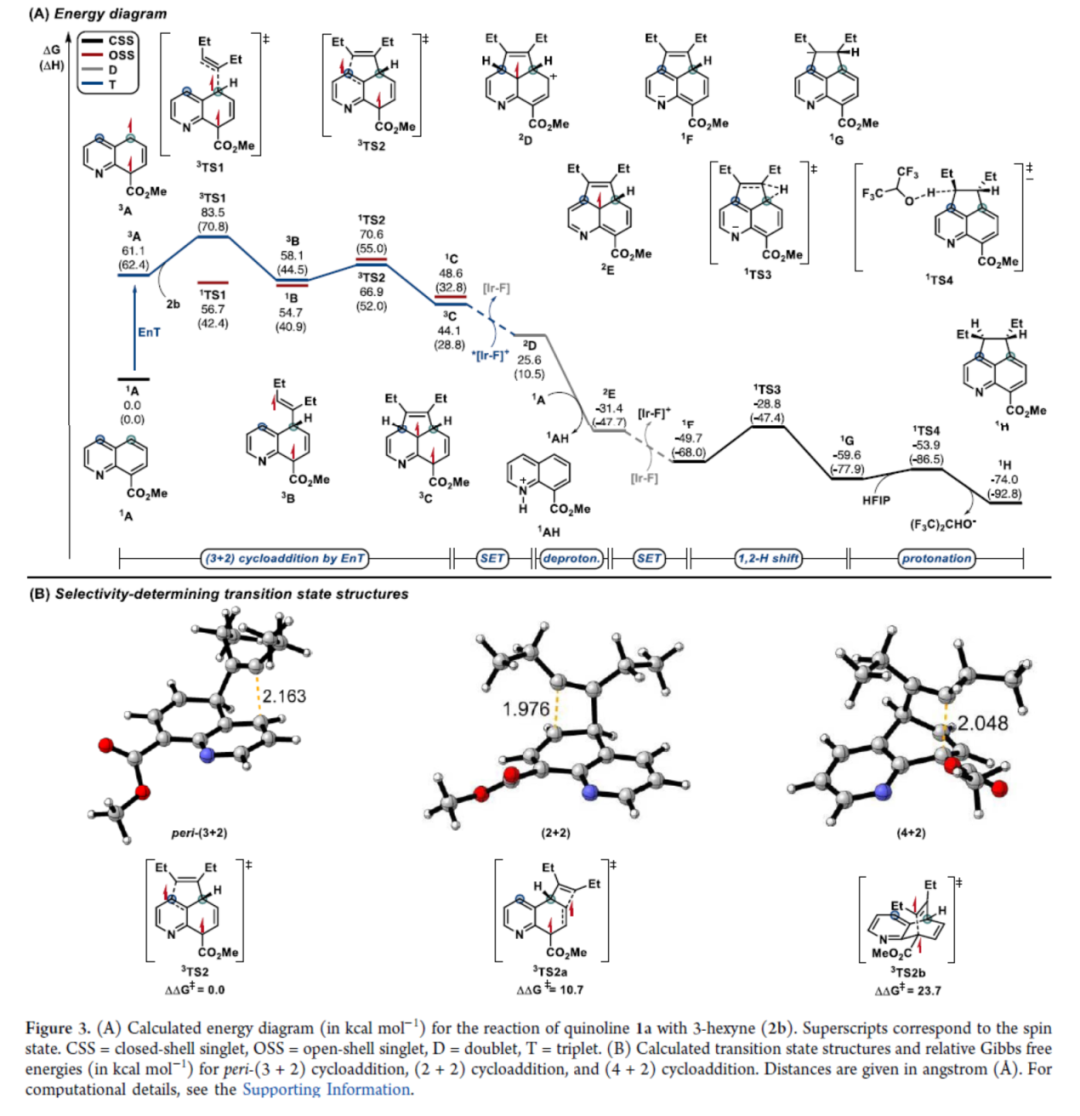
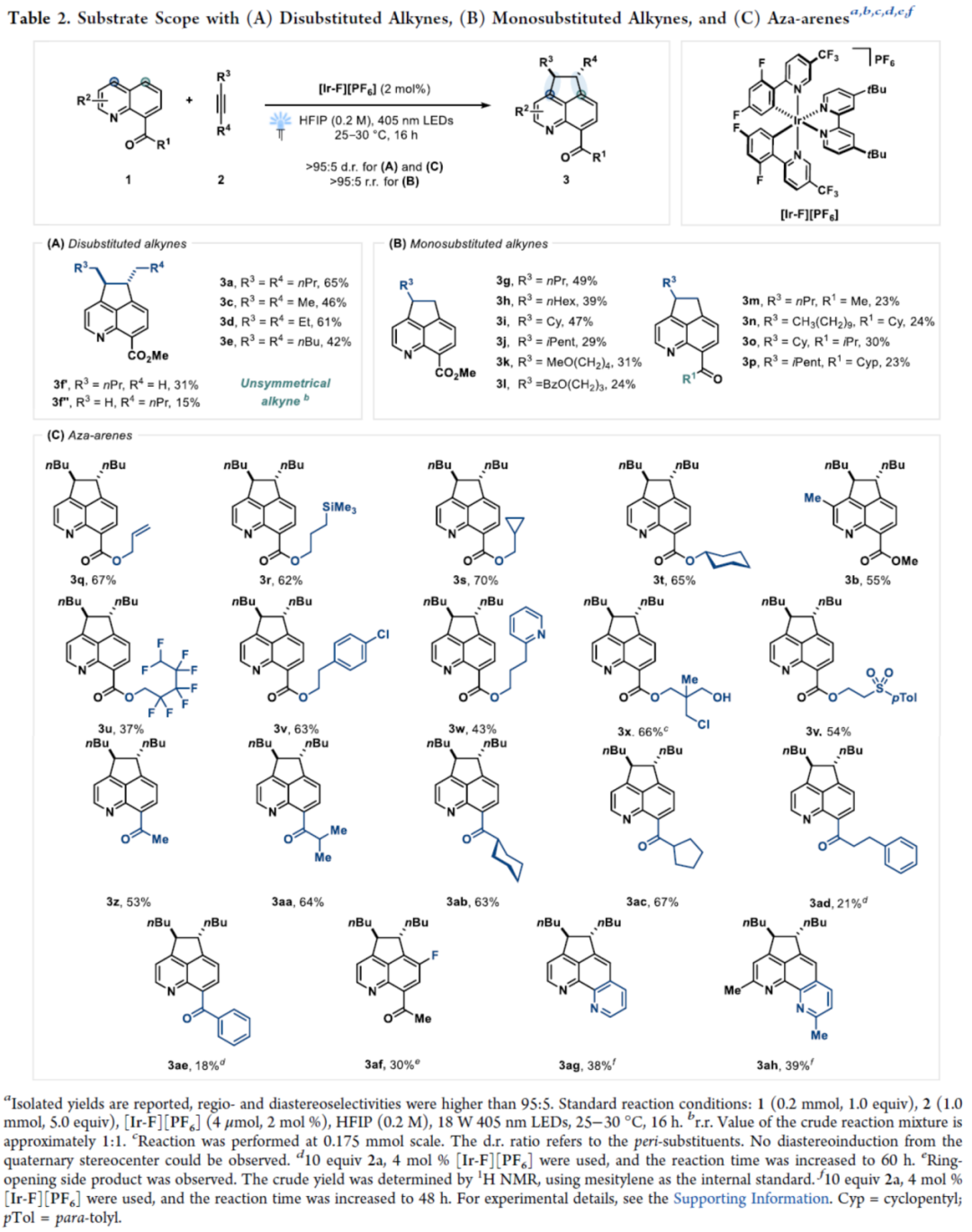
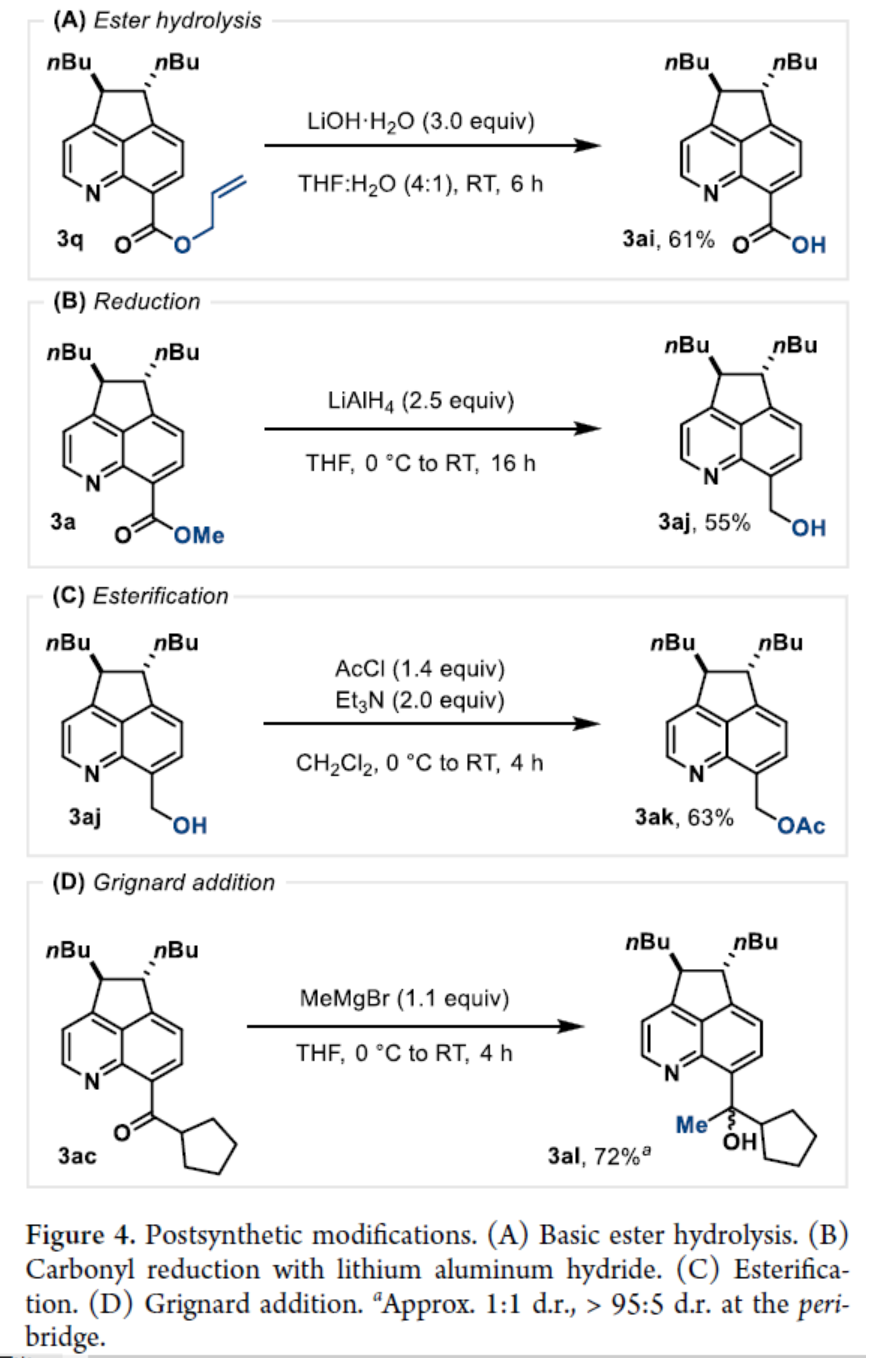
环加成反应是实现分子复杂性以及构建具有价值分子的有效策略。同时,氮杂苊骨架广泛存在于各类天然产物(如delavatine A)和候选药物(如喜树碱类似物和HIV整合酶抑制剂)中(Figure 1A)。然而,对于氮杂苊骨架的构建则具有一定的难度。近年来,能量转移光催化(EnT)策略广泛用于去芳构化环加成反应中(Figure 1B)。化学家们已开发了一些富电子苯并缩合(杂)芳烃的分子内/间的(2+2)去芳构化环加成反应以及缺电子氮杂芳烃的(4+2)去芳构化环加成反应。然而,利用能量转移策略,通过简单的氮杂芳烃经peri-(3+2)环加成反应,实现从头合成氮杂苊衍生物仍有待进一步的研究。同时,此类反应存在以下挑战:(a)将通常的单环反应性转移到位于不同环上的位置;(b)反应可逆性;(c)重芳构化的要求。近日,德国明斯特大学Frank Glorius课题组报道了一种将EnT(环化)/SET(重芳构化)相结合的策略,实现了喹啉与炔烃的形式peri-(3+2)环加成反应,合成了一系列氮杂苊衍生物(Figure 1C)。首先,作者对反应条件进行了筛选(Table 1)。当使用喹啉-8-甲酸甲酯1a与5-癸炔2a作为底物,[Ir(dF(CF3)ppy)2(dtbbpy)][PF6]作为光催化剂,六氟异丙醇(HFIP)作为溶剂,在405 nm LEDs辐射下于25-30 oC中反应16 h,可以61%的收率得到氮杂苊产物3a。紧接着,作者对双重EnT/SET反应的机理进行了研究(Figure 2)。首先,通过Stern-Volmer发光淬灭表明,尽管效率不同,但两种杂芳基化合物(1b和1a)都可以淬灭[Ir-F][PF6](Figure 2A)。同时,由于喹啉(1b)在反应中不会有效的反应,从而表明有效的光催化剂淬灭并不是决定所需反应性的唯一参数。其次,通过对光催化剂筛选时发现,仅有[Ir(dF(CF3)ppy)2(dtbbpy)][PF6]具有良好的反应结果(Figure 2B)。通过反应的动力学实验表明,反应在6 h内结束,符合一级动力学要求(Figure 2C)。CV实验表明,*[Ir-F][PF6]不能与底物1a发生氧化淬灭。当使用HFIP-d1作为溶剂时,产物3b的peri-桥联处有显著的氘掺入(38%),从而表明了溶剂辅助质子转移的过程(Figure 2D)。此外,随着光照强度的增加,初始速率呈线性增长(Figure 2E)。同时,线性速率增长表明反应速率确定步骤涉及单光子过程。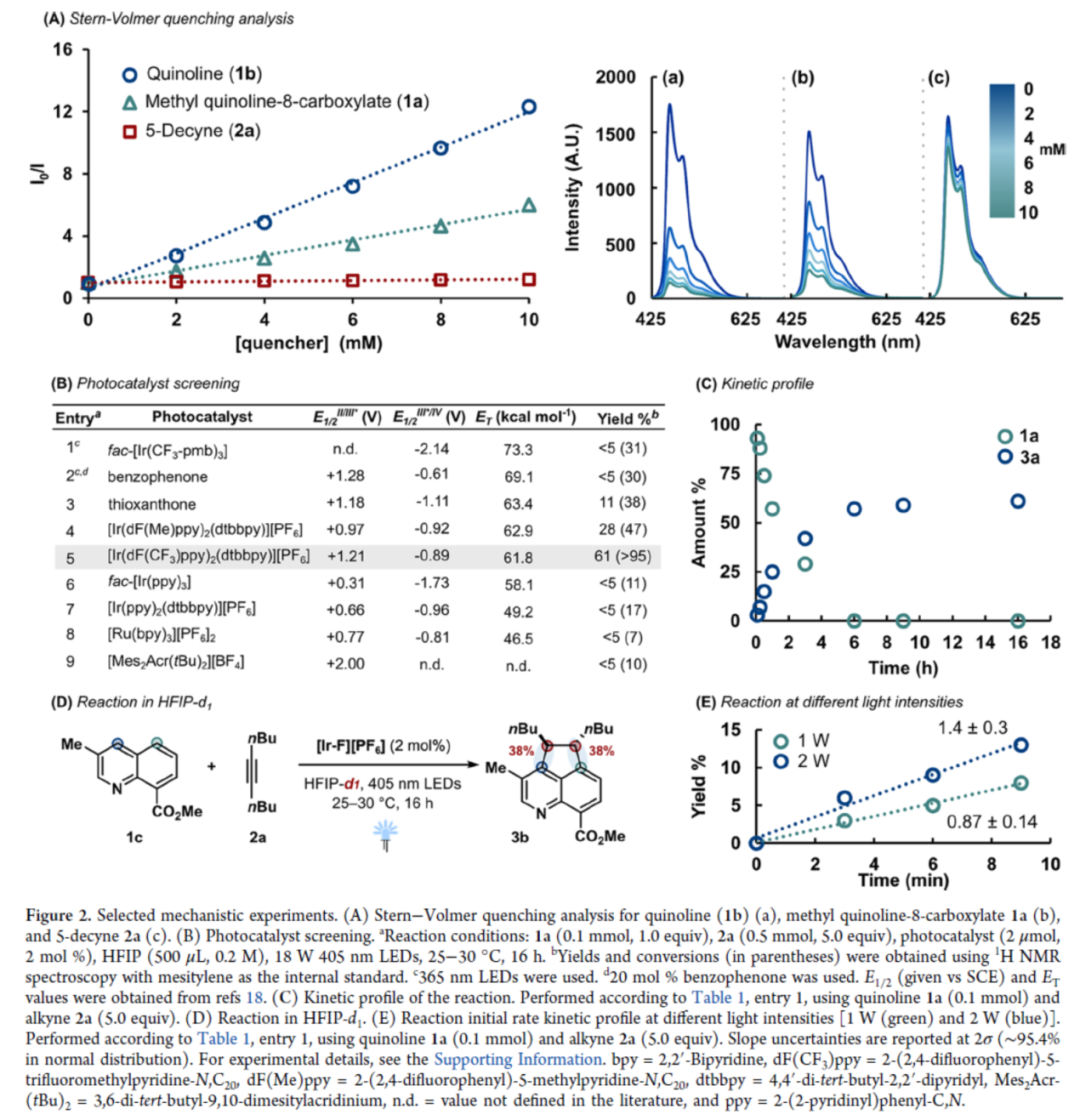 为了进一步了解非对映选择性(3+2)环加成的机理,美国加州大学洛杉矶分校K. N. Houk课题组对喹啉1a与3-己炔(2b)的反应进行了相应的DFT计算(Figure 3A)。首先,通过激发的光敏剂*[Ir-F]+到8-酯基取代喹啉1A的能量转移生成三重态喹啉3A。3A很容易与炔烃2b反应,可能通过从三重态到较低的开壳(open-shell)单重态过渡态1TS1的自旋交叉生成中间体1B或3B。随后,通过过渡态TS2在喹啉4-位选择性形成C-C键,生成双自由基中间体C。相比之下,对6-位或8-位的自由基进攻分别需要更高的活化自由能,由于形成环丁烯和双环[2.2.2]辛二烯骨架,3TS2a和3TS2b中的环张力显著增加,从而使其合理化(Figure 3B)。中间体C很可能在还原淬灭循环中被激发的*[Ir-F]+氧化,生成自由基阳离子2D。在4-位使用1A或HFIP阴离子((F3C)2CHO-)进行热力学有利的去质子化,生成中间体2E。此后,2E被[Ir-F]还原,从而再生活性光氧化还原催化剂[Ir-F]+并形成阴离子中间体1F,其随后通过1TS3进行1,2-氢转移。最后,1G与HFIP通过1TS4的简单质子化,从而生成热力学有利的反式产物1H。相比之下,由于两个乙基取代基之间的不稳定空间相互作用增加,顺式构型产物的稳定性比反式非对映异构体的能量低。随后,作者对底物范围进行了扩展(Table 2)。首先,一系列对称的双取代炔烃,均可与喹啉-8-甲酸甲酯1a顺利反应,获得相应的产物3a和3d-3e,收率为42-65%。对于非对称的双取代炔烃,仅获得不可分离的区域异构体混合物3f,总收率为46%。其次,一系列不同取代的单取代炔烃,均可与1a顺利反应,获得相应的产物3g-3p,收率为23-49%。此外,一系列喹啉衍生物,均可与5-癸炔2a顺利反应,获得相应的产物3b、3q-3z和3aa-3ah,收率为18-70%。值得注意的是,上述所有过程,均具有出色的非对映/区域选择性,即dr > 95:5或rr > 95:5。最后,作者对反应的实用性进行了研究(Figure 4)。首先,3q中的酯基在碱性条件下水解,可以61%的收率获得喹啉羧酸衍生物3ai。其次,使用LiAlH4可将3a中的酯基进行还原,可以55%的收率获得苯甲醇衍生物3aj。3aj经进一步的酯化,可以63%的收率获得化合物3ak。此外,3ac与MeMgBr经Grignard加成反应后,可以72%的收率获得三级醇化合物3al。
为了进一步了解非对映选择性(3+2)环加成的机理,美国加州大学洛杉矶分校K. N. Houk课题组对喹啉1a与3-己炔(2b)的反应进行了相应的DFT计算(Figure 3A)。首先,通过激发的光敏剂*[Ir-F]+到8-酯基取代喹啉1A的能量转移生成三重态喹啉3A。3A很容易与炔烃2b反应,可能通过从三重态到较低的开壳(open-shell)单重态过渡态1TS1的自旋交叉生成中间体1B或3B。随后,通过过渡态TS2在喹啉4-位选择性形成C-C键,生成双自由基中间体C。相比之下,对6-位或8-位的自由基进攻分别需要更高的活化自由能,由于形成环丁烯和双环[2.2.2]辛二烯骨架,3TS2a和3TS2b中的环张力显著增加,从而使其合理化(Figure 3B)。中间体C很可能在还原淬灭循环中被激发的*[Ir-F]+氧化,生成自由基阳离子2D。在4-位使用1A或HFIP阴离子((F3C)2CHO-)进行热力学有利的去质子化,生成中间体2E。此后,2E被[Ir-F]还原,从而再生活性光氧化还原催化剂[Ir-F]+并形成阴离子中间体1F,其随后通过1TS3进行1,2-氢转移。最后,1G与HFIP通过1TS4的简单质子化,从而生成热力学有利的反式产物1H。相比之下,由于两个乙基取代基之间的不稳定空间相互作用增加,顺式构型产物的稳定性比反式非对映异构体的能量低。随后,作者对底物范围进行了扩展(Table 2)。首先,一系列对称的双取代炔烃,均可与喹啉-8-甲酸甲酯1a顺利反应,获得相应的产物3a和3d-3e,收率为42-65%。对于非对称的双取代炔烃,仅获得不可分离的区域异构体混合物3f,总收率为46%。其次,一系列不同取代的单取代炔烃,均可与1a顺利反应,获得相应的产物3g-3p,收率为23-49%。此外,一系列喹啉衍生物,均可与5-癸炔2a顺利反应,获得相应的产物3b、3q-3z和3aa-3ah,收率为18-70%。值得注意的是,上述所有过程,均具有出色的非对映/区域选择性,即dr > 95:5或rr > 95:5。最后,作者对反应的实用性进行了研究(Figure 4)。首先,3q中的酯基在碱性条件下水解,可以61%的收率获得喹啉羧酸衍生物3ai。其次,使用LiAlH4可将3a中的酯基进行还原,可以55%的收率获得苯甲醇衍生物3aj。3aj经进一步的酯化,可以63%的收率获得化合物3ak。此外,3ac与MeMgBr经Grignard加成反应后,可以72%的收率获得三级醇化合物3al。德国明斯特大学Frank Glorius课题组开发了一种将EnT(环化)/SET(重芳构化)相结合的策略,实现了喹啉与炔烃的形式peri-(3+2)环加成反应,合成了一系列氮杂苊衍生物。其中,市售的铱配合物具有光敏剂和光氧化还原催化剂的双重作用,可促进环化/重芳构化串联过程。同时,该反应具有底物范围广泛、反应条件温和、官能团兼容性高、非对映选择性出色、区域选择性出色等特点。该反应结果将推动基于混合EnT/SET事件的创新芳香环加成技术的进一步发展。
文献详情:
Peter Bellotti, Torben Rogge, Fritz Paulus, Ranjini Laskar, Nils Rendel, Jiajia Ma, K. N. Houk,* Frank Glorius*. Visible-Light Photocatalyzed peri-(3+2) Cycloadditions of Quinolines. J. Am. Chem. Soc.2022, https://doi.org/10.1021/jacs.2c05687
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn