

正文
(图片来源:Angew. Chem. Int. Ed.)
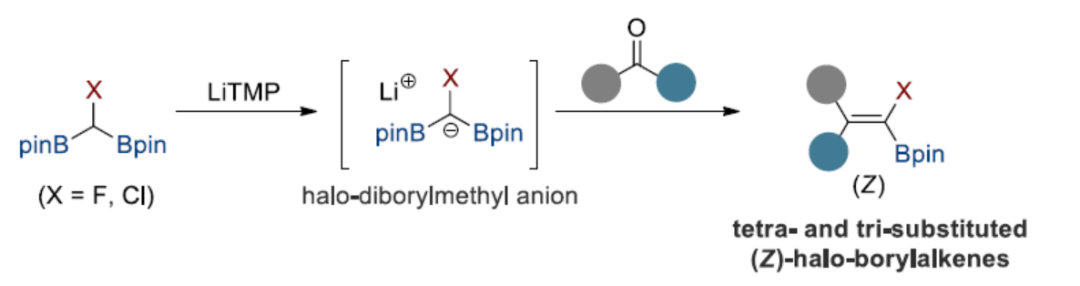
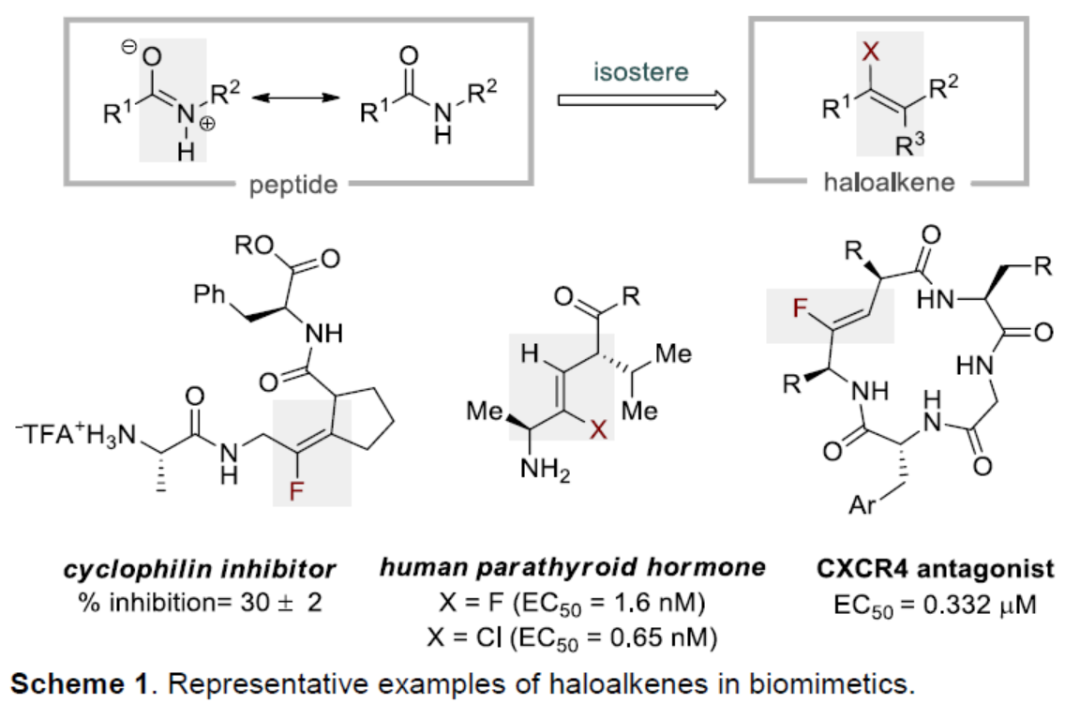
卤代烯烃是药物化学和化学生物学中的重要结构单元,具有独特的生物学和物理性质,如代谢稳定性和亲脂性。特别是,由于具有相似的键长以及与酰胺的电荷分布相似,因此氟代或氯代烯烃是肽的电子等排体(Scheme 1)。除了其生物应用外,卤代烯烃还被用作化学转化中的通用中间体,以生成具有价值的有机化合物。因此,开发一种高效合成卤代烯烃或其类似物的策略,具有重要的意义。
(图片来源:Angew. Chem. Int. Ed.)
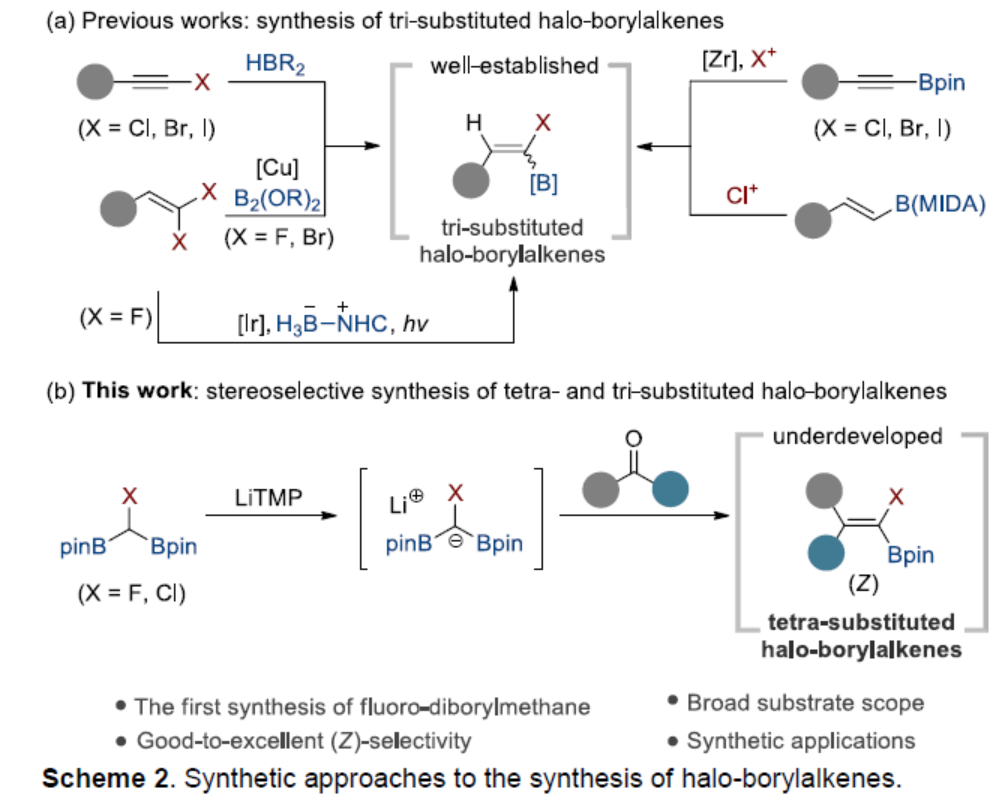
目前,化学家们已开发了一些合成卤代硼基烯烃的代表性策略,如炔基卤化物的硼氢化反应和烯基或炔基硼酸酯的亲电卤化反应。然而,上述策略仅生成氯代、溴代和碘代硼基烯烃。为了合成氟代硼基烯烃,化学家们也开发了铜催化偕-二氟烯烃的单脱氟硼基化反应。2020年,新加坡国立大学吴杰课题组报道了一种可见光诱导NHC-硼烷与偕-二氟烯烃的脱氟硼基化反应。尽管已取得了一定地进展,但现有的方法主要集中于三取代的卤代硼基烯烃的合成上,对于四取代的卤代硼基烯烃的合成却较少有相关的研究,且存在一定的挑战(Scheme 2a)。近日,韩国浦项科技大学的Seung Hwan Cho课题组报道了一种酮/醛与卤代二硼基甲烷的Boron-Wittig反应,合成了一系列三/四取代的(Z)-氟/氯代硼基烯烃衍生物(Scheme 2b)。
(图片来源:Angew. Chem. Int. Ed.)
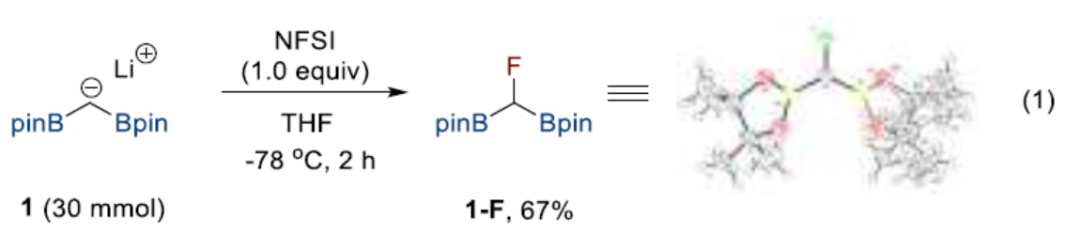
最初,通过(二硼甲基)锂1与亲电氟化试剂(NFSI,N-氟代双苯磺酰胺)在THF溶剂中反应,合成了氟代二硼基甲烷1-F,收率为67%。同时,1-F可用作与酮/醛进行Boron-Wittig反应的偶联试剂。
(图片来源:Angew. Chem. Int. Ed.)
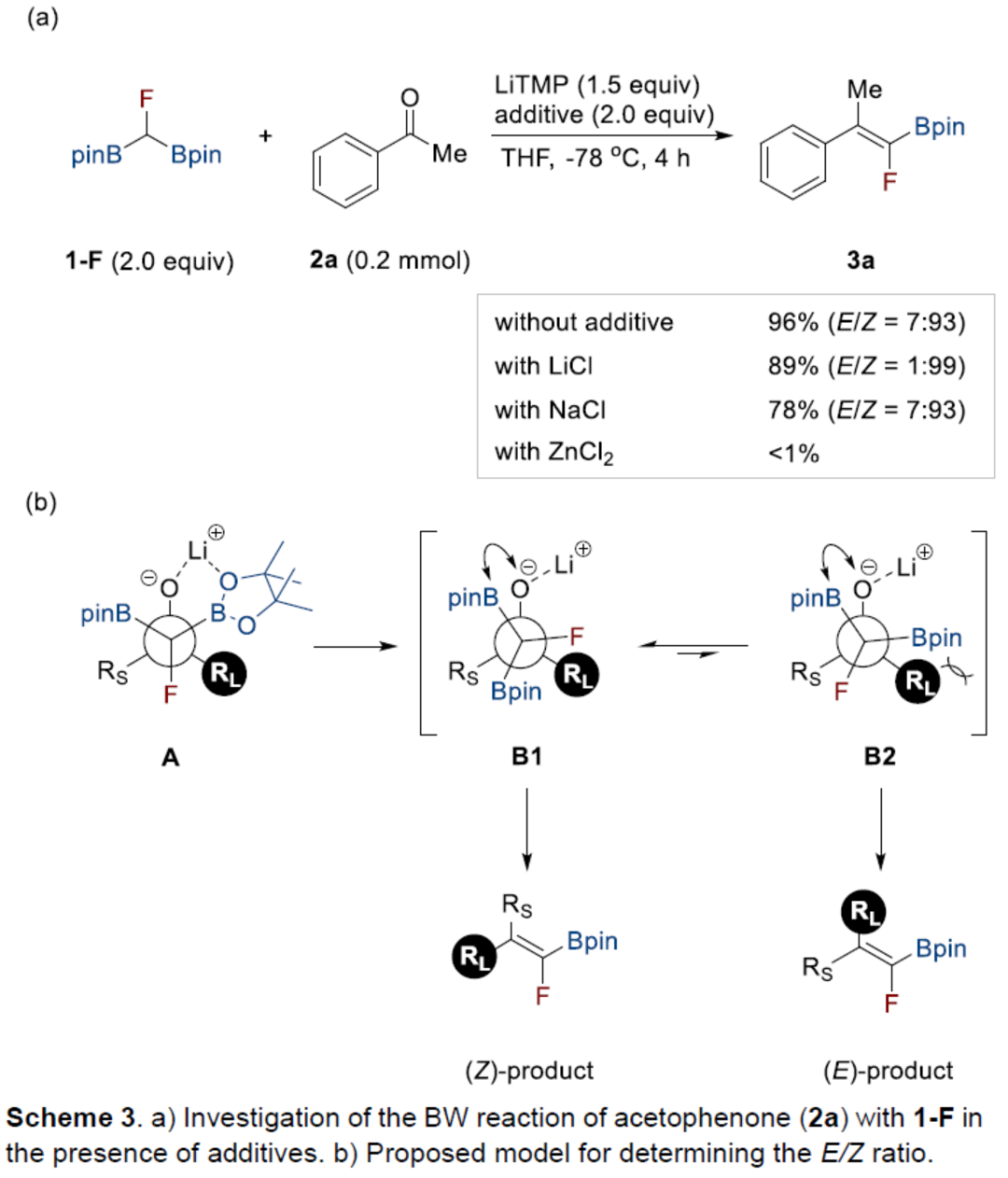
同时,作者以氟代二硼基甲烷1-F与苯乙酮2a作为模型底物,进行了相关Boron-Wittig反应条件的筛选(Scheme 3a)。当以LiTMP(四甲基哌啶锂)作为碱,LiCl作为添加剂,在THF溶剂中-78 oC反应4 h,可以89%的收率得到四取代的氟代硼基烯烃产物3a,E/Z = 1:99。
为了解释反应中高(Z)-选择性的原因,作者提出了一个合理的立体化学模型(Scheme 3b)。首先,通过LiTMP攫取酸性α-C-H键生成氟代二硼甲基阴离子。随后,将该阴离子加成至酮中,生成高度稳定的中间体A。两个中间体B1和B2 可能在通过C-C键旋转消除B-O之前形成。为了最大限度地减少空间排斥,B-O 消除应优先从B1发生,其中小位阻的氟原子靠近位阻较大的羰基(RL),生成(Z)-氟代硼基烯烃作为主要异构体。当B1中的B-O消除减慢时,很可能是由于二聚锂配合物的形成,键旋转可以将B1转化为B2。随后,从B2中消除B-O生成(E)-氟代硼基烯烃。作者认为,氯化锂可促进B1中的B-O消除。
(图片来源:Angew. Chem. Int. Ed.)
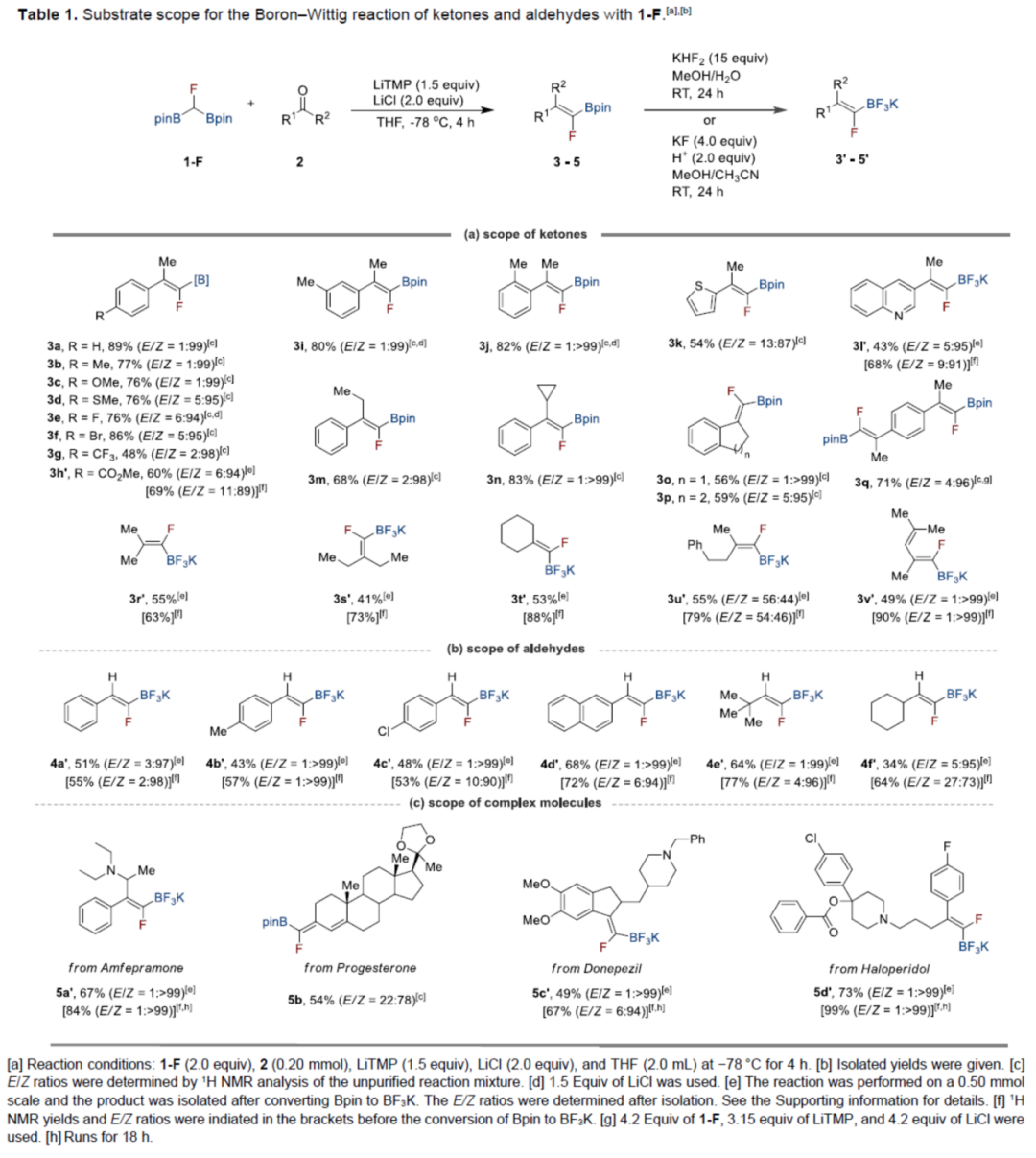
在获得上述最佳反应条件后,作者对底物范围进行了扩展(Table 1)。首先,苯乙酮的芳基上含有不同电性的取代基时,均可顺利反应,获得相应的产物3a-3j,收率为48-89%,E/Z为11:89->1:99。2-乙酰噻吩和3-乙酰喹啉也是合适的底物,以中等收率的获得相应的产物3k和3l'。值得注意的是,由于在硅胶分离过程中不稳定,产物3h'和3l'在-Bpin转化为-BF3K后被分离出来。同时,一系列脂肪族酮,也能够顺利反应,获得相应的产物3m-3v',收率为41-90%,E/Z为54:46->1:99。其次,一系列苯甲醛衍生物以及脂肪醛,均与体系兼容,获得相应的产物4a'-4f',收率为34-77%,E/Z为27:73->1:99。此外,该策略还可用于一系列复杂的分子的后期修饰,如5a'-5f'。
(图片来源:Angew. Chem. Int. Ed.)
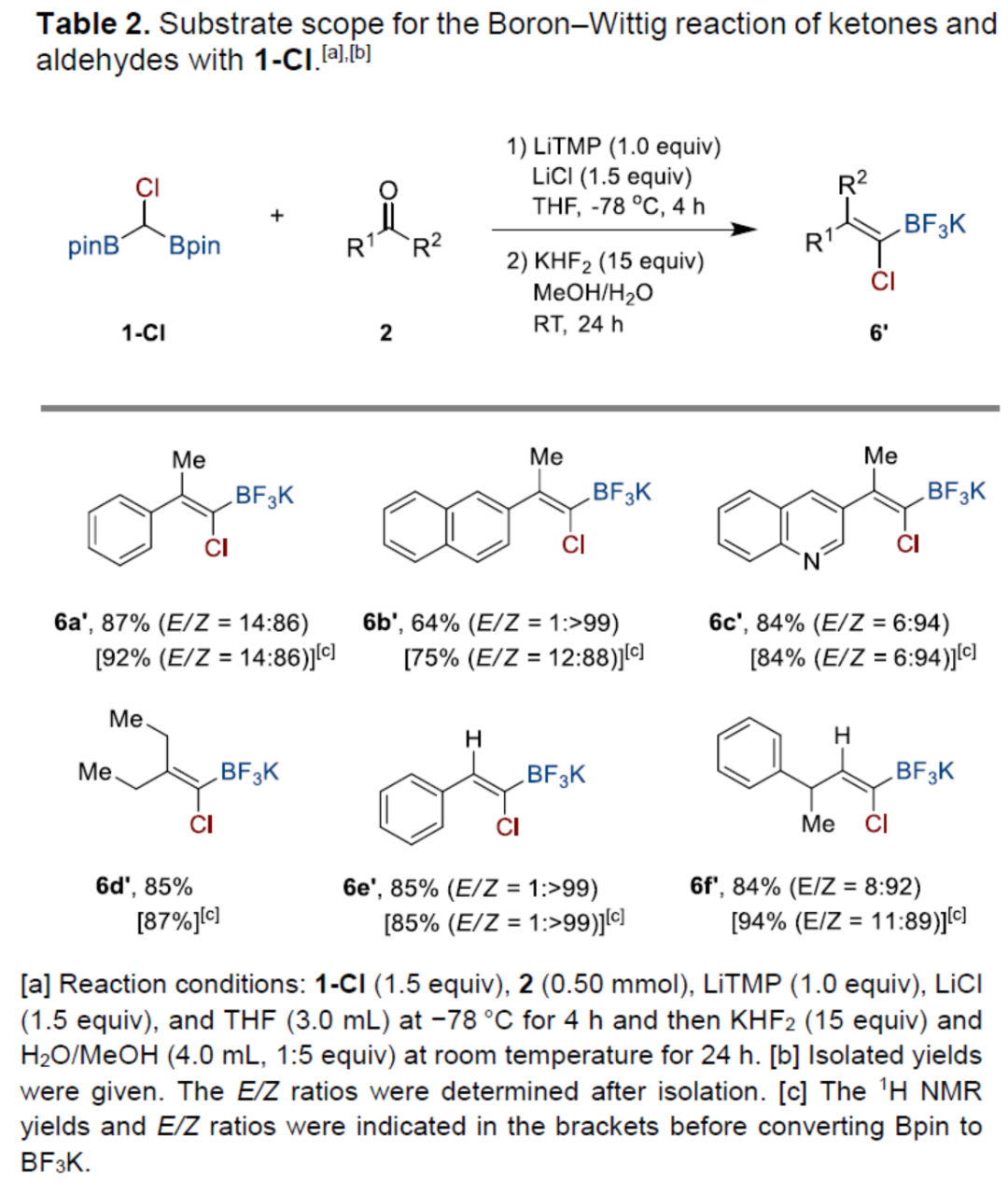
紧接着,作者发现,当使用氯代二硼基甲烷1-Cl作为底物时,一系列芳基甲基酮和脂肪族酮,均可顺利反应,获得相应的氯代产物6a'-6f',收率为64-94%,E/Z为14:86->1:99(Table 2)。值得注意是,由于带有-Bpin的氯代硼基烯烃通常在硅胶分离中不稳定,因此在将-Bpin转化为-BF3K盐后再进行分离。
(图片来源:Angew. Chem. Int. Ed.)
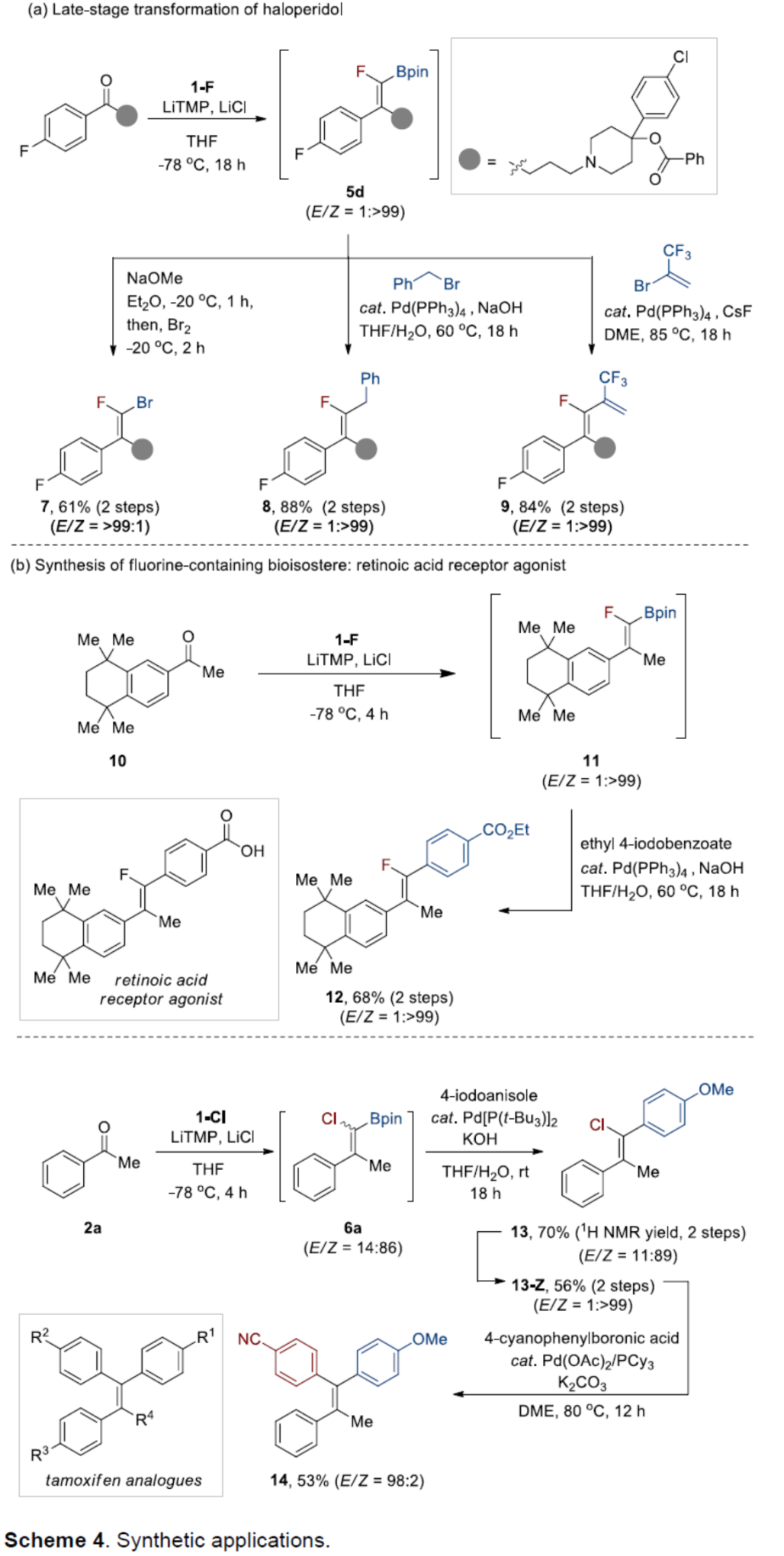
最后,作者对反应的实用性进行了研究(Scheme 4)。首先,5d在NaOMe/Br2条件下反应,可以61%的收率得到(E)-溴代氟代烯烃7。5d通过钯催化 Suzuki-Miyaura交叉偶联,可获得相应的(Z)-氟代硼基烯烃8(收率为88%)和9(收率为84%)(Scheme 4a)。其中,上述产物的E/Z => 1:99。其次,10与1-F进行BW反应后,生成氟代硼基烯烃11(无需分离与纯化)。将粗品11直接用于钯催化的Suzuki-Miyaura偶联反应,可以两步68%的总收率得到化合物12(一种视黄酸受体激动剂类似物),E/Z => 1:99(Scheme 4b)。此外,2a与1-Cl进行BW反应,生成氯代硼基烯烃6a(E/Z = 14:86)。将粗品6a直接用于钯催化的Suzuki-Miyaura反应,通过硅胶色谱分离,可以两步56%的收率生成氯代烯烃13-Z,E/Z => 1:99。13-Z可与4-氰基苯基硼酸再次进行钯催化Suzuki-Miyaura交叉偶联反应,可以53%的收率得到全碳四取代烯烃化合物14(他莫昔芬类似物),E/Z = 98:2。
(图片来源:Angew. Chem. Int. Ed.)
总结
韩国浦项科技大学的Seung Hwan Cho课题组报道了一种酮/醛与卤代二硼基甲烷的Boron-Wittig反应,合成了一系列三/四取代的(Z)-氟/氯代硼基烯烃。同时,该策略具有底物范围广泛、收率高、立体选择性高等特点。此外,通过后期的衍生化实验,从而进一步证明了反应的实用性。
文献详情:

长按或扫码左侧二维码查看原文
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn