- 首页
- 资讯
JACS:Aza-Heck-引发C(sp3)-H键的官能团化串联反应
来源:化学加原创 2022-10-03
导读:近日,英国利物浦大学John F. Bower课题组报道了一种基于aza-Heck的 C(sp3)-H键的官能团化串联反应。其中,在Pd(0)催化下,N-(五氟苯甲酰氧基)氨基甲酸酯的aza-Heck型环化可生成烷基-Pd(II)中间体,该中间体在生成环丙烷产物过程中影响C(sp3)-H键的钯化过程。此外,作者还阐明了控制环丙烷化过程中位点选择性的关键因素,从而实现了环-或螺-稠合体系的构建。
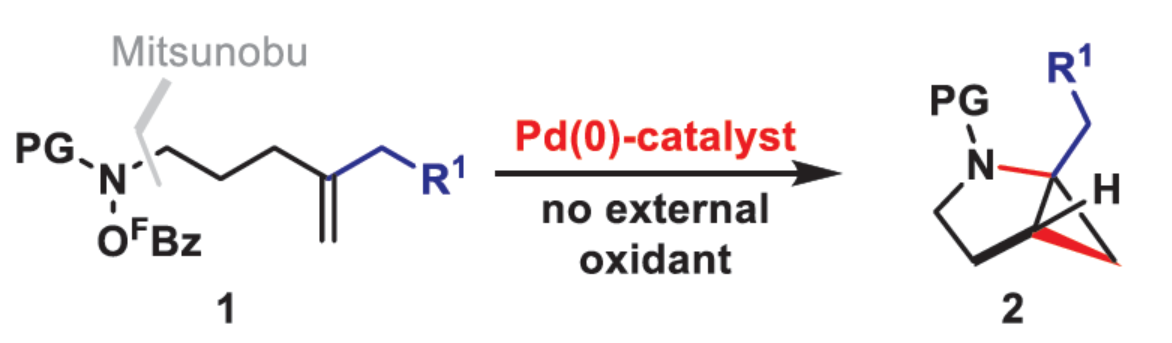
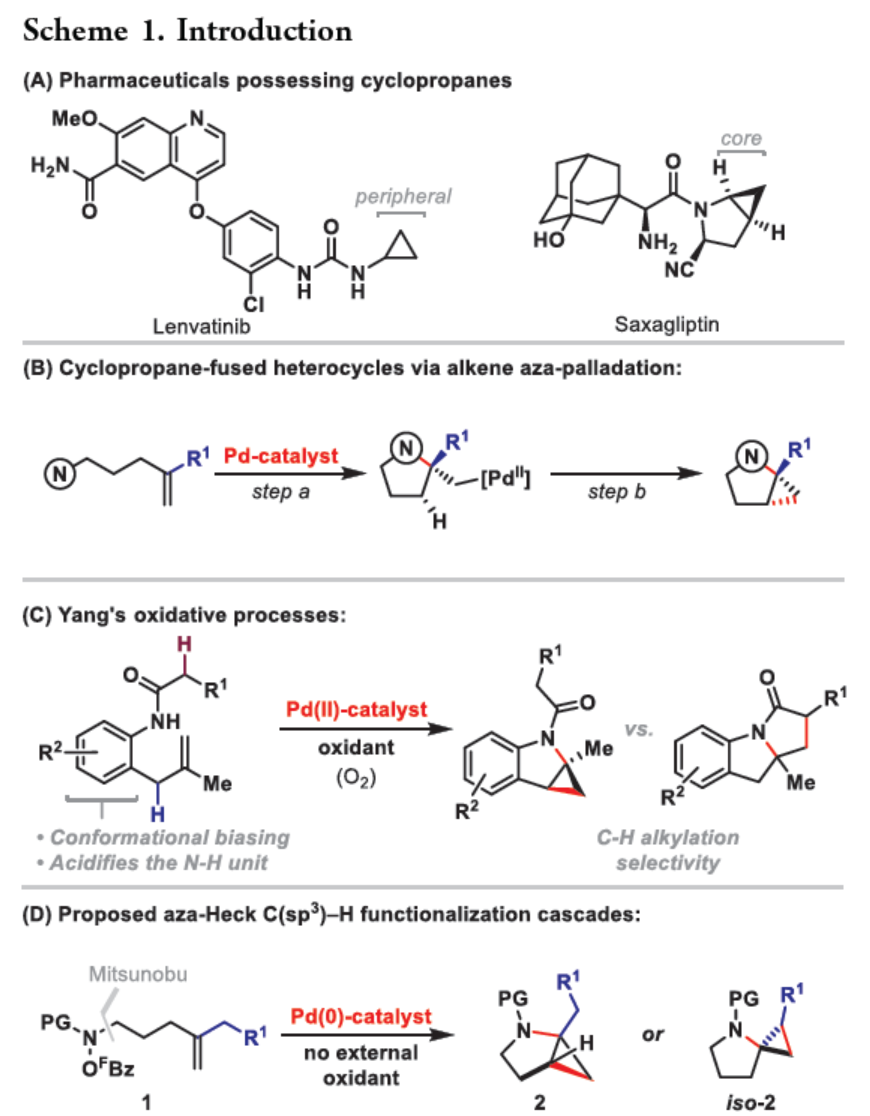
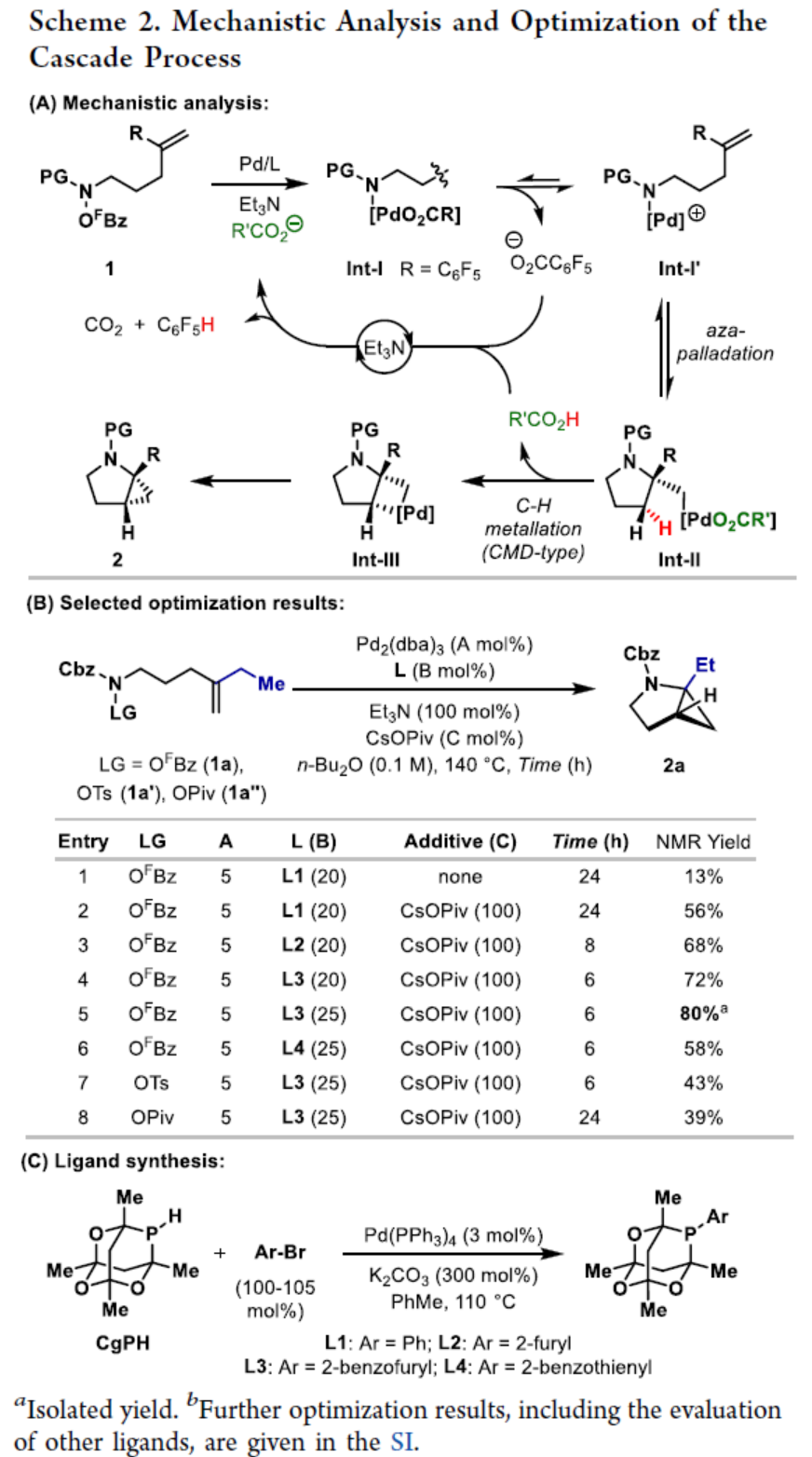
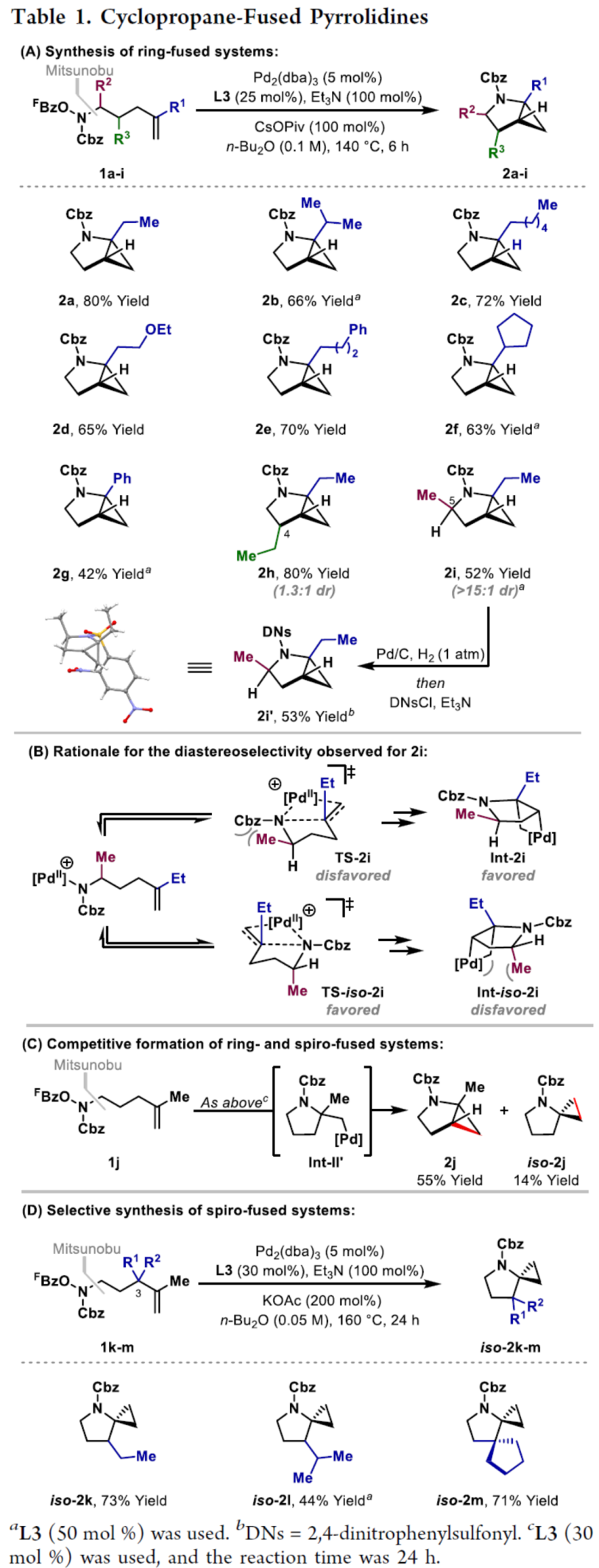
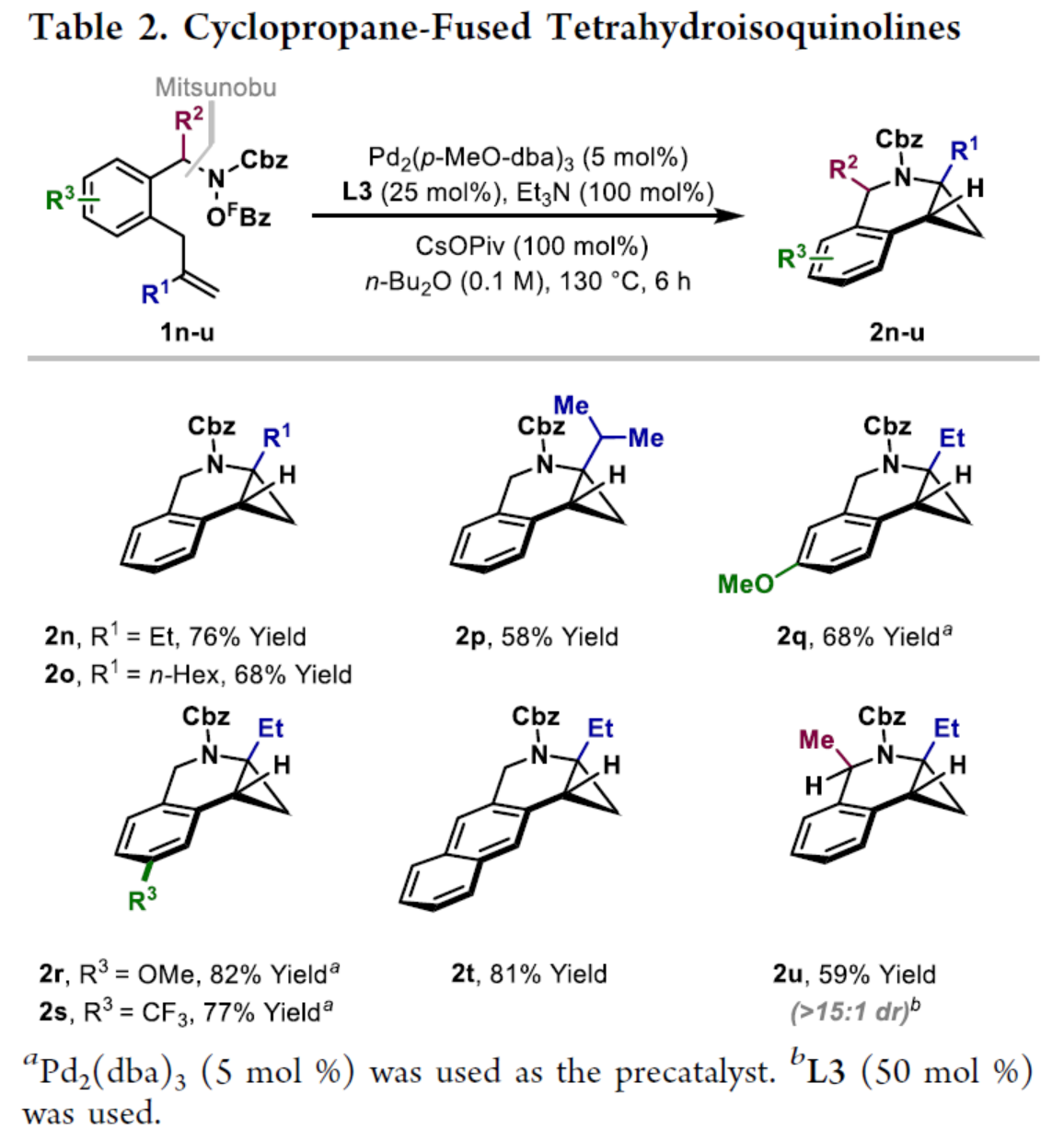
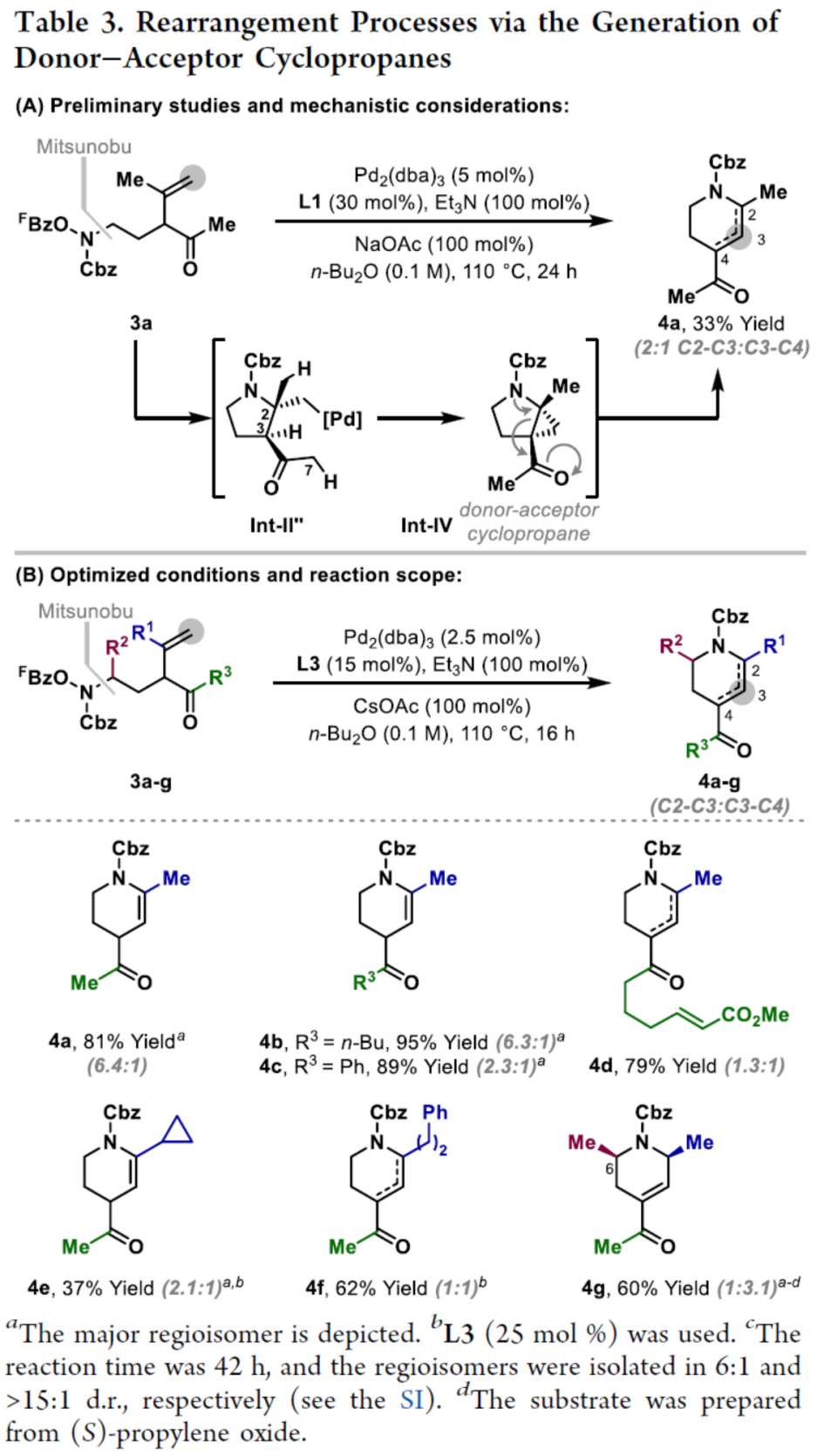
环丙烷单元通常用于药物设计以缓和化合物的亲脂性或N-中心的碱度。同时,外围环丙烷单元出现在许多已上市药物中,而母核环丙烷单元较少遇到(Scheme 1A)。例如,DPP-4抑制剂沙格列汀具有环丙烷稠合的吡咯烷骨架。目前,化学家们开发了一种烯烃的氮杂-钯化用于构建环丙烷稠合的杂环化合物,即在C-H钯化引发环丙烷化(step b)之前,烯烃首先进行分子内的氮杂-钯化(step a)(Scheme 1B)。2015年,杨丹课题组开发了一种钯催化氧化的条件,实现了环丙烷稠合吡咯烷的合成(Scheme 1C)。然而,此类反应存在一定的限制,如在step a中需一个构象偏差(conformationally biasing)和酸化的苯胺单元,从而不适合六环环化,而在step b中的存在底物范围以及选择性有限。作者发现,使用N-O键代替外部氧化剂(如O2)可显著提高基于烯烃氮杂钯化工艺的效率。在该方法中,N-O氧化加成是底物结合和催化剂氧化的关键过程。同时,非氧化条件还意味着高度可调的P-基配体可用于调节钯中心的性质。事实上,这种基于aza-Heck的方法可扩大非构象偏差环化和串联的范围,涉及空间和电子多样化的烯烃。此类反应包括不对称aza-Heck环化和涉及芳基C(sp2)-H钯化的串联反应。近日,英国利物浦大学John F. Bower课题组报道了一种基于aza-Heck引发的环丙烷化过程,涉及C(sp3)-H键的钯化步骤(Scheme 1D)。值得注意的是,这是C(sp3)-H键官能团化串联的第一个例子,涉及使用含有N-O单元的底物。同时,该策略具有如下特点:(a)具有空间位阻的烯烃均可有效的反应。(b)在无构象偏差和酸化苯胺单元的情况下可有效进行5-exo环化或6-exo环化。(c)无需目标C(sp3)-H键的苄基活化。此外,通过控制反应的空间以及电子性质,可增强环丙烷化反应的区域选择性,从而合成了一系列环-或螺-稠合化合物。首先,作者提出了一种合理的反应机理(Scheme 2A)。1中N-O键的氧化加成可生成aza-Pd(II)中间体Int-I。前期的工作表明,有效的烯烃氮杂钯化需要五氟苯甲酸甲酯从Int-I解离以得到Int-I'。Int-I'经环化和羧酸盐缔合生成烷基-Pd(II)中间体Int-II,它可通过协同的金属化/去质子化型(concerted metalation deprotonation-type)金属化生成钯环丁烷Int-III。Int-III经还原消除后,可获得目标环丙烷产物2。在环丙烷化过程中释放的羧酸预计会被三乙胺去质子化,生成的三乙铵盐将引发五氟苯甲酸酯的简单脱羧反应以释放C6F5H。前期的研究表明,烯烃氮杂钯化在阳离子条件下是可逆的,因此该过程的成功可能取决于羧酸盐介导的 C(sp3)-H键金属化步骤的效率(Int-II到Int-III)。因此,可能需要外部羧酸盐添加剂(R'CO2M),因为在N-O氧化加成过程中释放的五氟苯甲酸盐具有高度离解性和相对较弱的碱。因此,最佳机理方案需要用于氮杂钯化(Int-I')的阳离子配合物和用于C(sp3)-H键金属化(Int-II)的中性中间体。紧接着,作者对反应条件进行了筛选(Scheme 2B)。当以1a作为底物,Pd2(dba)3作为催化剂,L3作为配体,Et3N作为碱,CsOPiv作为添加剂,在n-Bu2O溶剂中140 oC反应6 h,可以80%的收率得到产物2a。同时,作者还对相关配体的合成进行了研究(Scheme 2C)。在获得上述最佳反应条件后,作者对底物范围进行了扩展(Table 1A)。研究表明,当底物1中的R1为各种烷基或芳基时,均可顺利进行反应,获得相应的产物2a-2g,收率为42-80%。当底物1中的R3为乙基或R2为甲基时,反应也与体系兼容,获得相应的产物2h-2i,收率为52-80%。其中,2i经进一步的脱保护后,可与DNsCl反应,可以53%的收率得到N-DNs衍生物2i'。同时,2i'的单晶X-射线衍射表征揭示了甲基和乙基取代基之间的syn-relationship。该结果与可逆的烯烃氮杂钯化步骤一致,因为生成的钯环丁烷Int-2i是通过不利的环化模式 (TS-2i)形成的(Table 1B)。当以1j为底物时,可以55%的收率得到预期的产物2j以及以14%的收率得到螺稠环丙烷产物iso-2j(Table 1C)。后者的形成可能是由Int-II'的空间上更易接近的甲基的C(sp3)-H键金属化促进的。因此,作者对选择性合成螺稠合的体系进行了研究(Table 1D)。通过反应条件的优化后,可获得一系列螺稠合产物iso-2k-2m,收率为44-73%。同时,作者发现,当以Pd2(p-MeO-dba)3作为催化剂时,在R1、R2或R3处具有不同取代基的底物1n-1u,均可顺利进行反应,获得相应的环丙烷稠合的四氢异喹啉产物2n-2u,收率为58-82%(Table 2)。此外,当以3a作为底物可合成哌啶化合物4a,涉及初始(非构象偏差)5-exo aza-钯化的过程(Table 3A)。在该过程中,可生成Int-II”,其中可以选择进行三种不同的C(sp3)-H键进行金属化,形成四元或六元钯环。在反应过程中,通过C3-位的金属化,涉及供体-受体环丙烷中间体Int-IV,经热促进开环可生成哌啶化合物4a。因此,重排过程将3a中的亚甲基CH2单元转移到目标的C3-位。为了进一步提高反应的效率,作者进行了相关条件的优化研究(Table 3B)。在R1、R2或R3处具有不同取代基的底物3a-3g,均可有效的反应,获得相应的烯烃区域异构体的混合物4a-4g。迄今为止,使用内部(4d)或外部π-不饱和物(例如活化酮)在环加成过程中拦截供体-受体环丙烷中间体(Int-IV)的尝试均未成功。英国利物浦大学John F. Bower课题组报道了首例aza-Heck引发的C(sp3)-H官能团化串联反应,合成了一系列环-或螺环-稠合的环丙烷衍生物。为了实现该过程,作者设计和评估了一系列新型P-配体,其中L3是最佳的配体。此外,作者还阐明了如何使用空间位阻或电性控制来主导C(sp3)-H键金属化的选择性。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn