

(图片来源:Nat. Chem.)
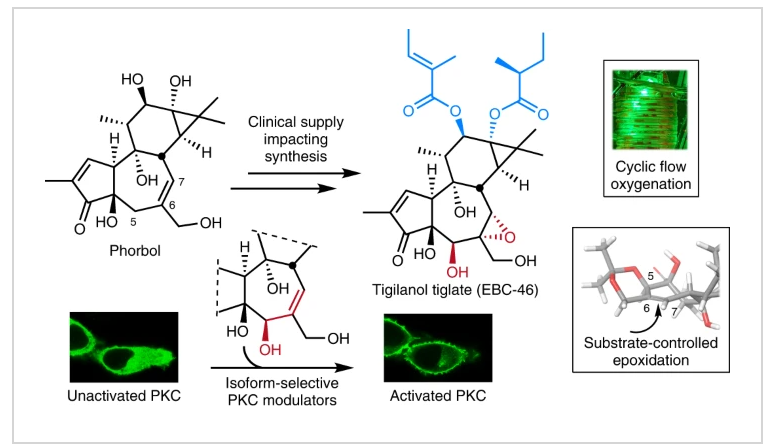
Tigilanol Tiglate (1,EBC-46)是一种二萜类天然产物,其在临床上可以用于治疗多种癌症。由于EBC-46对蛋白激酶C(PKC)亚型具有显著的识别性,使得EBC-46及其类似物成在PKC相关的临床适应症(人类免疫缺陷病毒和艾滋病的根除、抗原增强癌症免疫治疗、阿尔茨海默症和多发性硬化症)的治疗上具有很大的优势。目前,EBC-46的唯一来源是一种热带雨林树木—Fontainea picrosperma。由于此种树木的数量和分布极其有限(主要分布在澳大利亚东北部),且从其种子中提取EBC-46的产率非常低(5%),这促使人们考虑在树木种植园中对其进行培育以满足供应需求。然而,尽管这一做法避免了热带雨林的采伐,但由于传粉昆虫有限,且具有被气候变化和被入侵病原体破坏的风险而具有众多不确定性。因此,探索发展更多样化的EBC-46来源将为科学研究和临床需求提供更可持续的供应。鉴于EBC-46及其类似物具有重要的临床应用和研究价值,发展利用简单易得的起始原料实现其快速高效的半合成过程即可解决其可持续供应问题,具有重要意义。最近,斯坦福大学Paul A. Wender课题组发展了利用简单易得的phorbol作为起始原料,通过12步(总收率12%,平均每步收率 > 80%)高效实现了Tigilanol Tiglate及其类似物的合成。
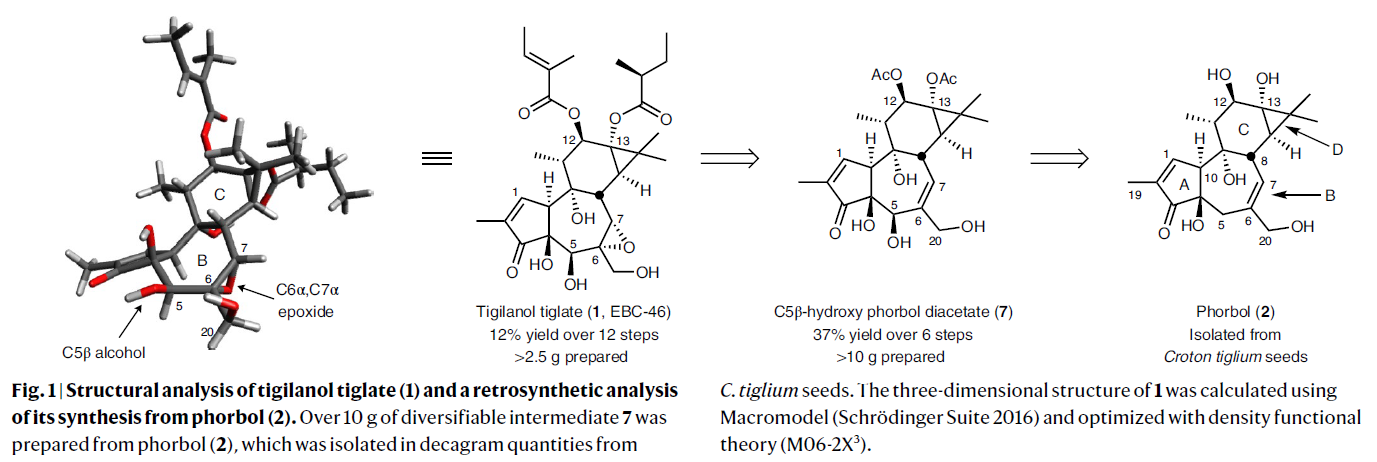
Phorbol(2)是一种可以从巴豆属植物的种子中提取出来的化合物。作者通过逆合成分析得出其可以作为简单易得的起始原料实现Tigilanol Tiglate的合成(Fig. 1)。为了更高效的获取起始原料,作者基于文献报道发展了更高效的提取策略,其通过研磨种子以及碱参与的酯水解过程(C20、C12和C13),并利用柱层析纯化可以以>10 g phorbol/3 Kg种子的规模实现起始原料2的提取。
(图片来源:Nat. Chem.)
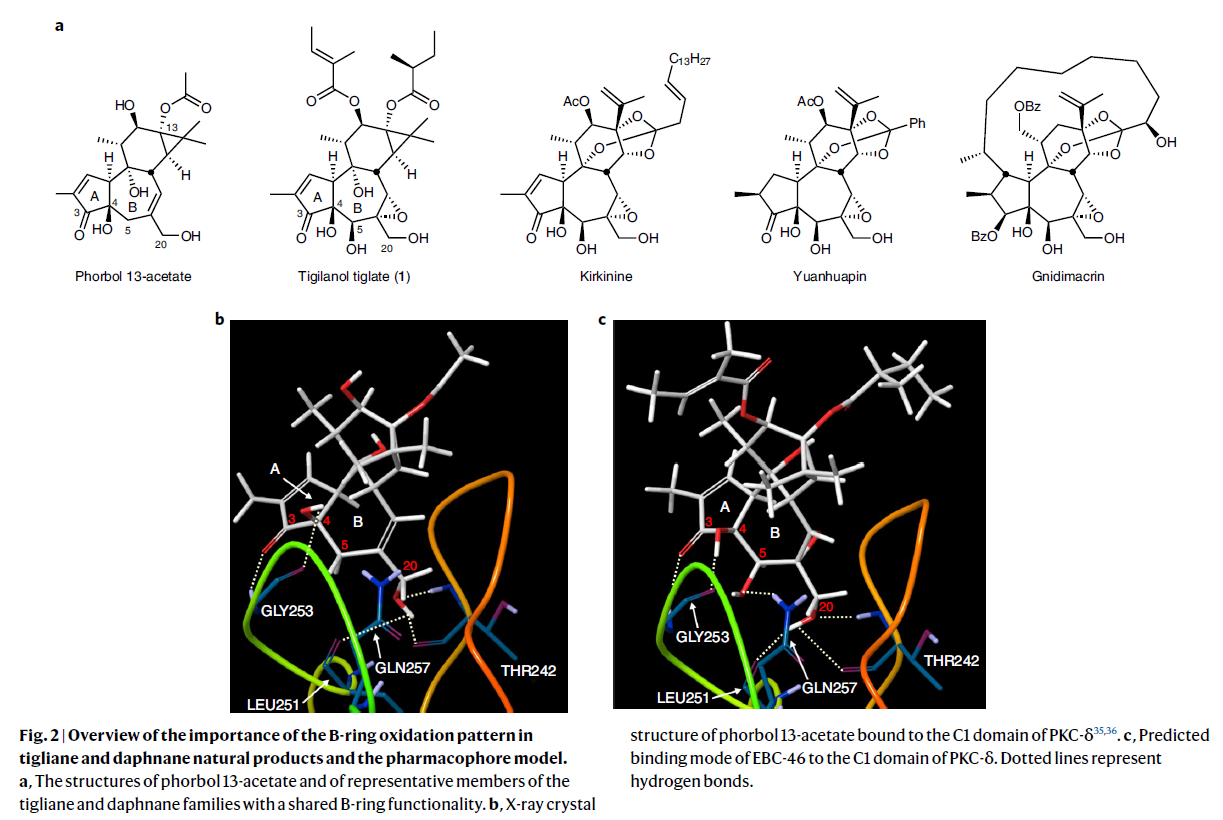
实现EBC-46和与其相关的tigliane和daphnane天然产物合成的关键挑战是它们共同具有的B环5β-羟基-6α,7α-环氧骨架的构建(Fig. 2a)。基于此类化合物最初的药效团模型,作者预计此官能团会影响蛋白激酶C(PKC)的亲和力、选择性和功能(Fig. 2b)。因此,解决此问题的核心在于在C8, C20, C10, C19上存在其它烯丙位氢的情况下,要选择性的实现β-C5烯丙位氢的氧官能团化过程。而又由于phorbol(2)对热、光、酸、碱以及空气均较为敏感,化学家们尝试实现其C5直接C-H活化过程也以失败告终。而作者利用发展出的方法可以解决此问题,并通过6步可规模化的合成过程实现关键中间体7的构建,且7可以进一步衍生实现EBC-46及其类似物的合成(Fig. 2)。
(图片来源:Nat. Chem.)
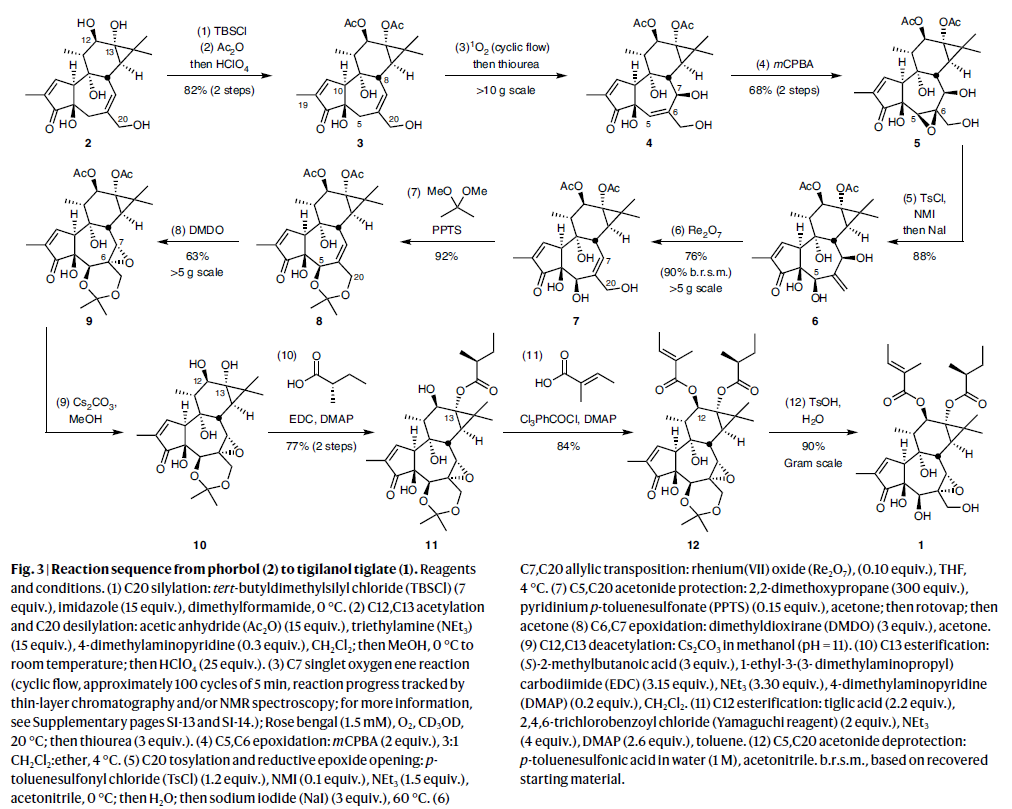
作者利用2作为起始原料,通过对C20羟基进行硅基保护和C12和C13羟基的乙酰化以及脱硅基过程,两步以82%的产率实现3的合成。随后,作者利用光激发单线态氧的ene反应并原位过氧化氢还原以66%的产率实现烯丙基醇4的合成(< 500 mg规模)。为了实现规模化的合成过程,作者利用蠕动泵和聚乙烯管组装了一个循环流光反应器。使用此设备可以以十克规模(19克),88%的产率实现4的合成,并且4的纯度可以达到不通过柱层析纯化即可直接应用于下一步的合成中。接下来,作者利用mCPBA与4的C5,C6烯烃反应,优先从空间上更容易接近的β-面实现了4的环氧化过程,从而构建目标C5β-O键,以77%的产率实现环氧化物5的合成。随后5通过NMI(N-甲基咪唑)催化实现C20醇羟基的对甲苯磺酰化并在NaI作用下可以以88%的产率专一性的得到目标β-C5醇类产物6。随后在Re2O7催化下,双烯丙基醇6可以经历高化学选择性的1,3-烯丙基醇的迁移以76%的产率得到7。而7可以作为重要中间产物实现多种1的B环类似物的合成(Fig. 3)。
接下来,作者要实现7的C6,C7烯烃的环氧化过程。正如文献所示,此环氧化过程会选择性的发生在立体位阻小的一侧(β-侧),而这并非作者所需的产物。尽管利用手性催化剂控制的环氧化过程可以解决这个问题,但是作者提出了更有效的解决方案。即7在反应中所展示的面选择性可通过将7转化为缩酮8(92%)后而得到显著改变。模型表明,C5和C20醇羟基所构建的缩酮结构会引起B环的构象变化,使其β-面空间位阻变大,从而可以在α-面实现环氧化。随后作者发现使用小立体位阻的高活性环氧化试剂DMDO(二甲基过氧化酮)时,可以高立体选择性实现环氧化物9的合成(63%)。在此类化合物的合成中,作者首次利用底物控制的策略高选择性的实现了环氧化过程,这为其它结构类似的生物活性tigliane和daphnane二萜类化合物的合成提供了潜在的方法。接下来,作者在碱性条件下(Cs2CO3)脱除了C12和C13上羟基的乙酰基保护基得到二羟基化合物10。随后10经历空间位阻调控的选择性二酯化过程得到12(J. Am. Chem. Soc. 2016, 138, 6068)。最后12在酸性条件(TsOH)下脱保护即可得到最终产物EBC-46(1)(Fig. 3)。
(图片来源:Nat. Chem.)
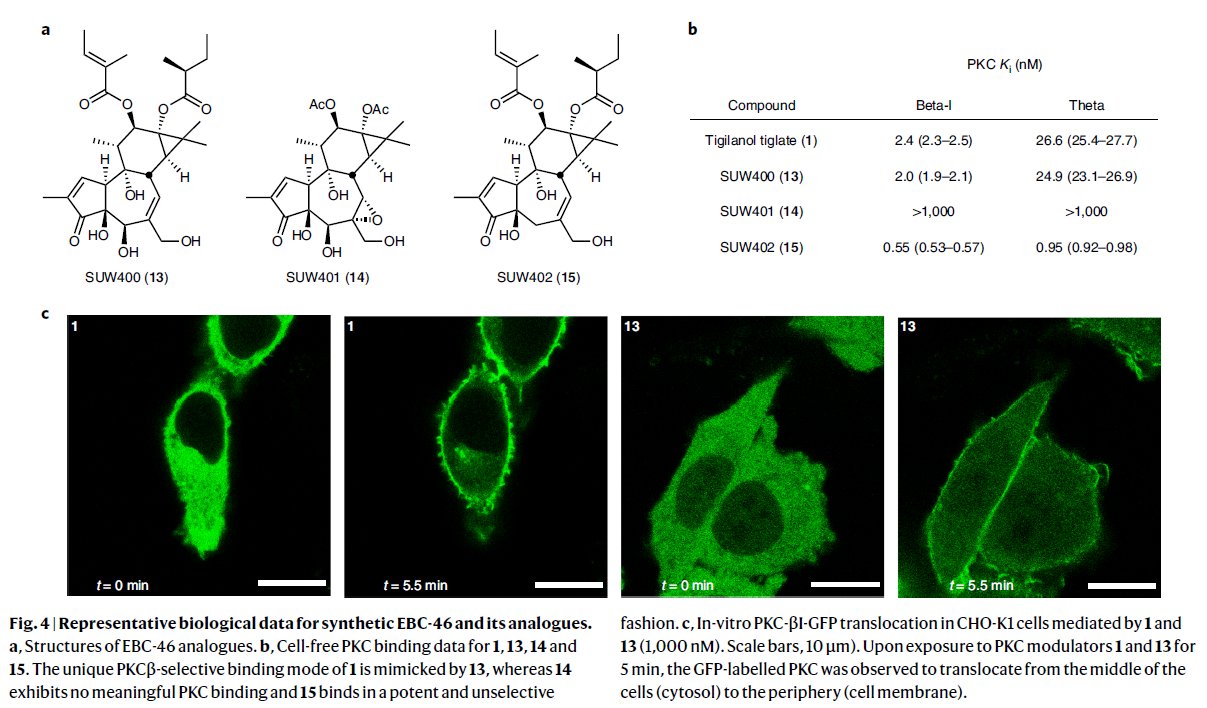
为了深入理解适度的结构变化即会显著影响此类化合物PKC的亲和力和选择性这一现象,作者制备了一系列EBC-46类似物13, 14和15(Fig. 4a)。随后作者分别对13, 14和15与PKC的传统亚型PKC-β1和新型亚型PKC-θ的亲和力进行测试并得出以下结论:1)C6α, C7α-环氧并不是EBC-46所展现的亚型选择性结合过程所必需的;2)C5β-醇在亚型选择性结合过程中起着重要作用;3)C12, C13酯在PKC结合过程中起到重要作用(Fig. 4b)。此外,作者通过体外实验发现EBC-46在低浓度(200 nM)下展现出适度的PKC-β1-GFP易位,而在高浓度(1000 nM)下展现出很强的易位(Fig. 4c)。
(图片来源:Nat. Chem.)
总结 斯坦福大学Paul A. Wender课题组利用简单易得的phorbol作为起始原料,通过12步(总收率12%)高效实现了抗癌药Tigilanol Tiglate(1,EBC-46)及其类似物的合成。值得注意的是,利用此策略可以在实验室实现规模化制备,具有良好的实用性。此合成方法的发展将加速未来针对PKC亚型选择性的结构基础及其作用模式的研究。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn