

(图片来源:Nat. Commun.)
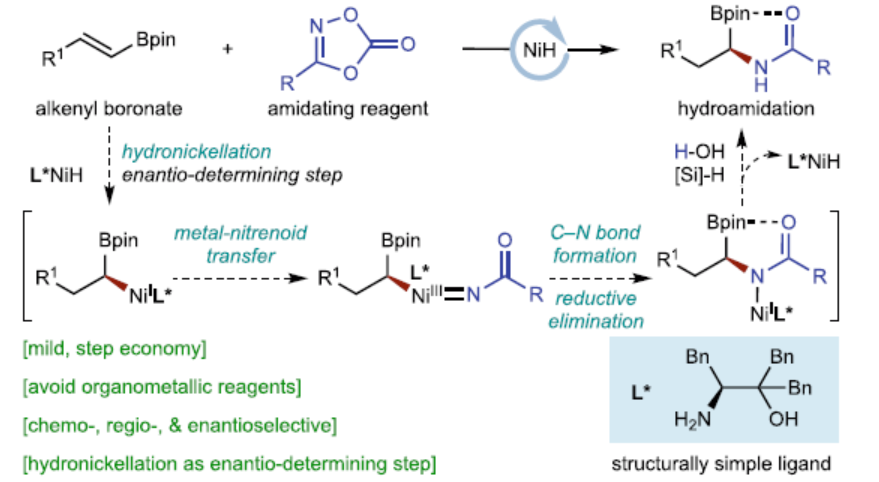
高光学纯的手性α-氨基硼酸酯及其衍生物是一类重要的结构单元,广泛存在于材料和药物分子结构中(Fig. 1a),同时也是偶联化学中常用的手性砌块。因此,通过简单易得的起始原料,直接高效地合成含该结构单元的分子,一直备受合成化学家的关注。除了传统的手性辅基方法外,化学家们还开发了一系列不对称催化合成手性α-氨基硼酸酯的方法,如芳香醛亚胺的硼化、烯酰胺的硼氢化和氢化反应(Fig. 1b)。2015年,Hirano和Miura课题组报道了一种CuH催化烯基Bdan(dan,1,8-二氨基萘)的氢胺化反应;2020年,Liu与Engle报道了一种CuH-催化炔烃的氢硼化/氢胺化的串联反应,合成了一系列手性α-氨基硼酸酯。然而,此类反应得到的烷基胺产物转化为上述药物分子的酰胺结构过程较为繁琐,一定程度上降低了该类反应的实用性。因此,仍需开发一种更为高效的手性α-酰胺基硼酸骨架的合成方法。
朱少林课题组利用镍氢催化策略,使用手性NiH催化剂,烯烃作为亲核试剂,开发了烯烃的系列不对称氢官能团化反应。在该策略中,可使用多种亲电试剂作为偶联底物,从而立体化学可控的构建了各种碳–碳和碳–杂原子键。最近,化学家们还证明二噁唑酮是NiH催化还原氢酰胺化反应中合适的亲电酰胺化试剂。近日,南京大学朱少林团队报道了一种NiH催化烯基硼酸酯与二噁唑酮的不对称氢酰胺化反应,直接合成了一系列高光学纯的手性α-氨基硼酸酯(Fig. 1c)。
(图片来源:Nat. Commun.)
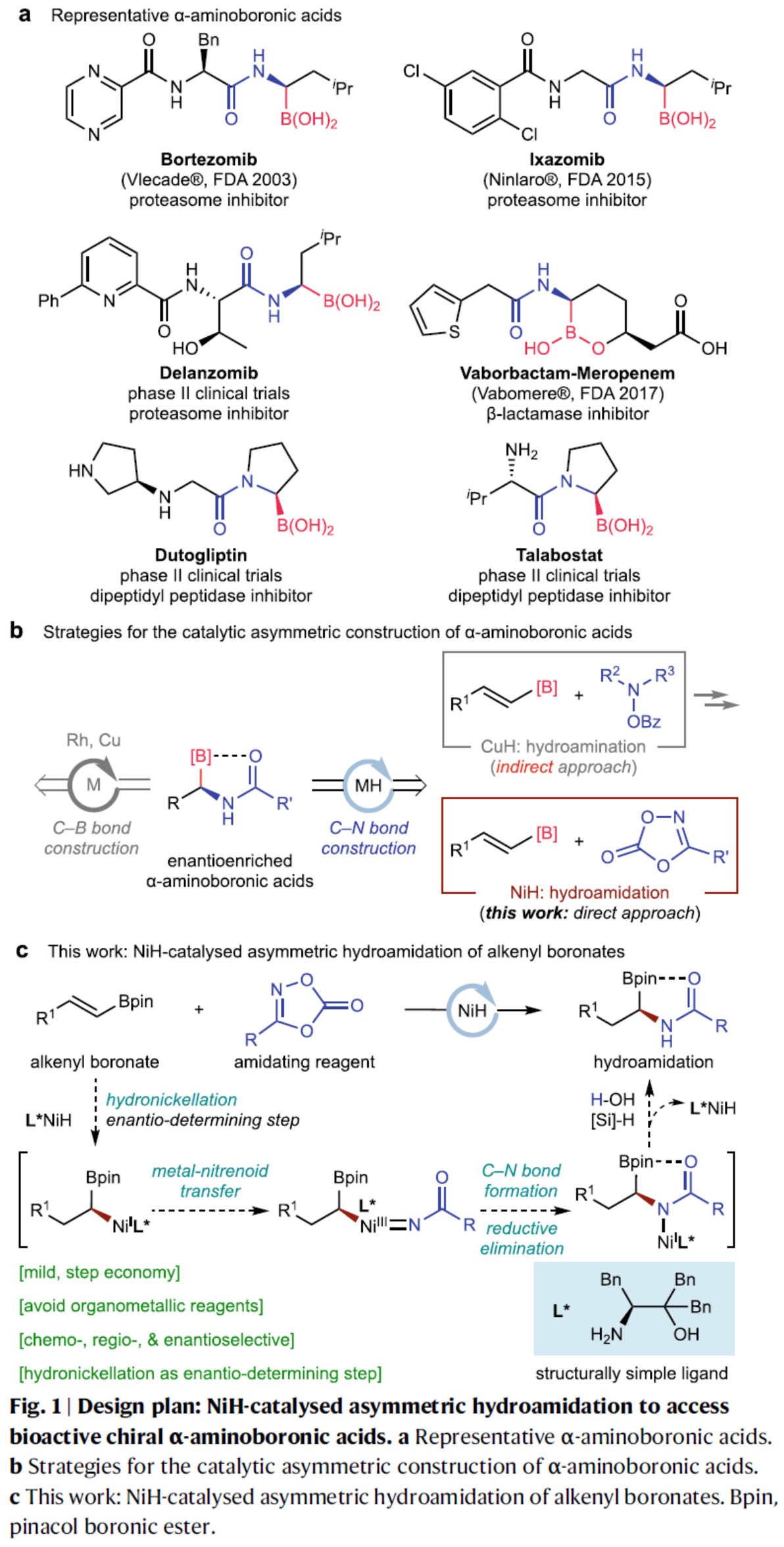
首先,作者以烯基硼酸酯1a与3-苯基-1,4,2-二噁唑-5-酮2a作为模型底物,进行了相关不对称氢酰胺化反应条件的筛选(Fig. 2)。当以NiCl2∙6H2O作为催化剂,氨基醇L*作为手性配体,(EtO)3SiH作氢源,LiI与H2O作为添加剂,在DMA溶剂中25 oC反应20 h,可以75%的收率得到产物3a,ee为95%。
(图片来源:Nat. Commun.)
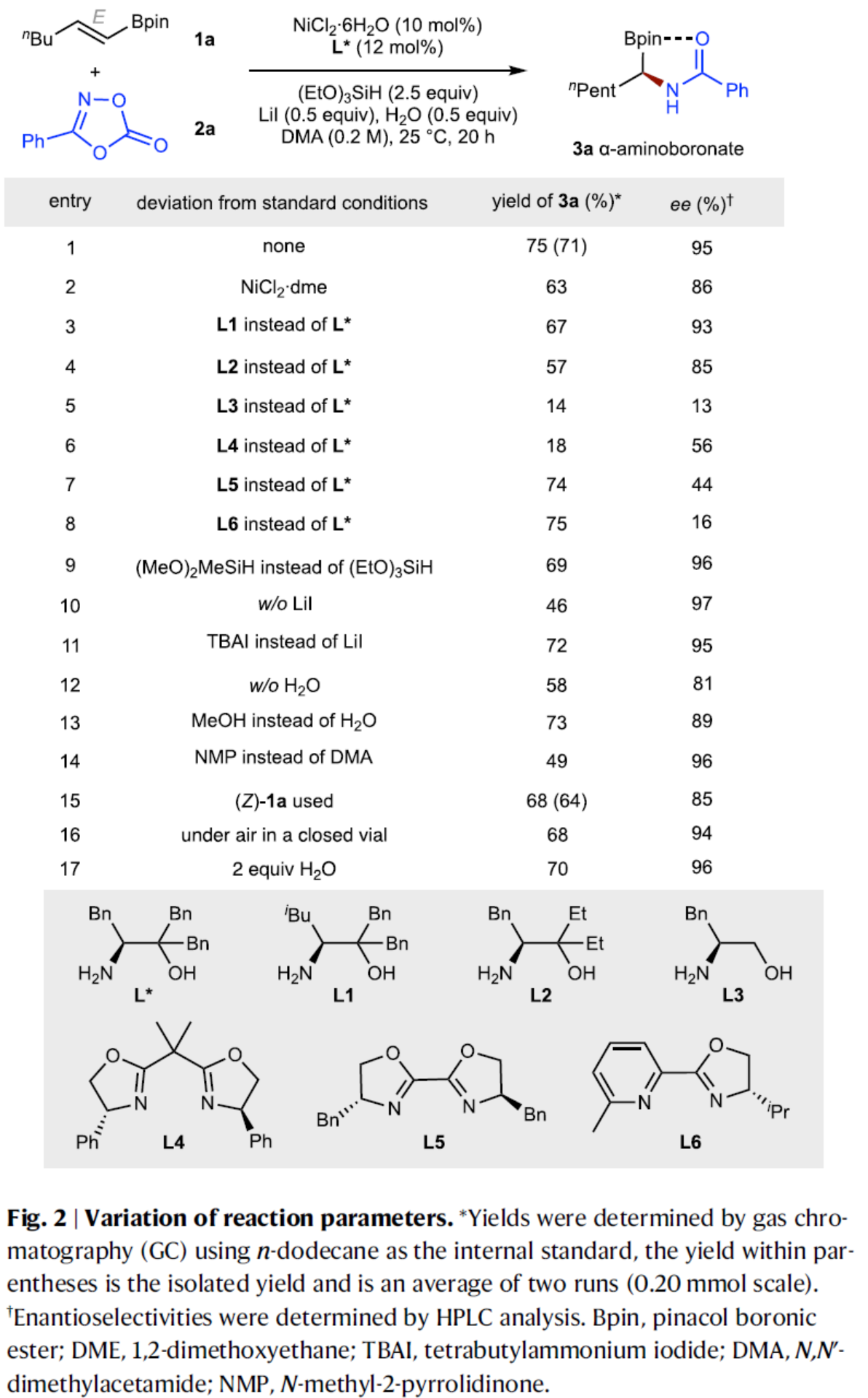
在获得上述最佳反应条件后,作者对烯基硼酸酯底物1的范围进行了扩展(Fig. 3)。首先,一系列烷基取代的烯基硼酸酯,均可顺利与2a进行反应,获得相应的产物3a–3k,收率为55–76%,ee为92–97%。其次,该策略还可用于一些生物活性和药物分子的后期修饰,如吉非贝齐(3l),丙磺舒(3m),薄荷醇(3n),葡萄糖(3o)和维生素E(3p)。然而,对于β,β-二取代的和α,β-二取代的烯基硼酸酯,反应性极低,如3q和3r。当使用β-芳基取代的烯基硼酸酯(3s)时,在硼酸酯的α-位和苄位都发生了酰胺化,获得2.3:1的混合物。
(图片来源:Nat. Commun.)
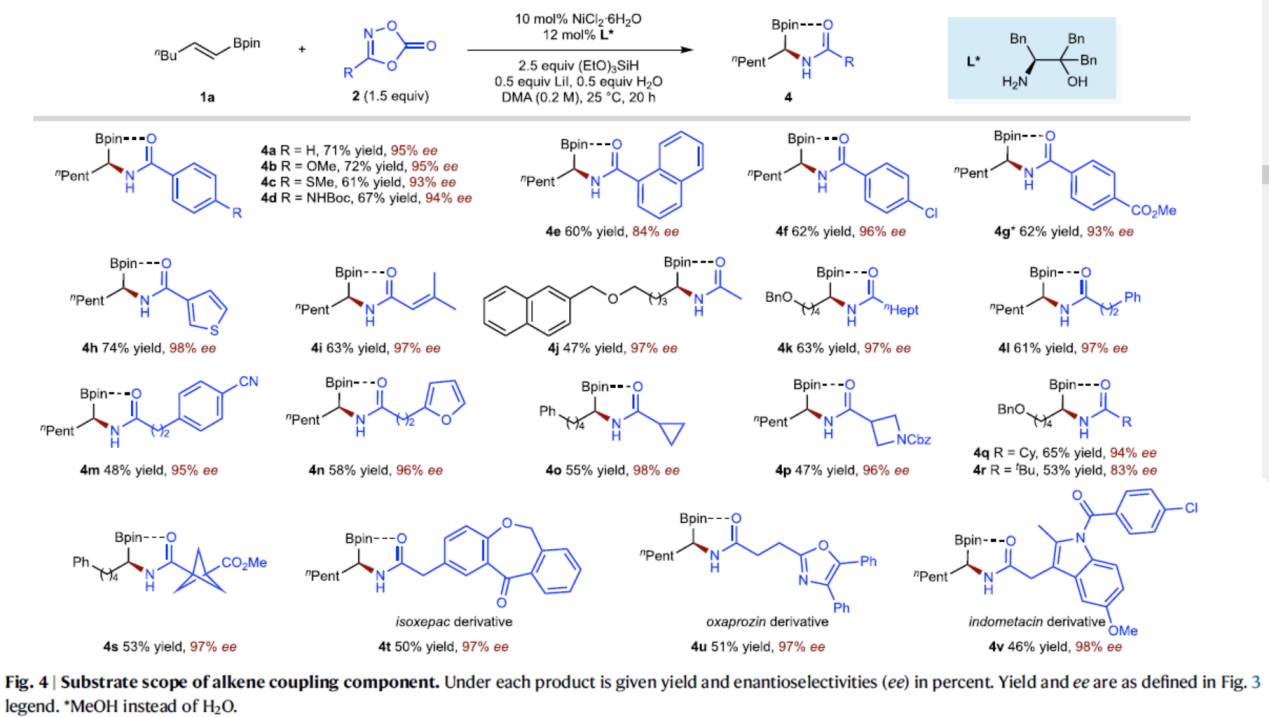
紧接着,作者对二噁唑酮底物2的底物范围进行了扩展(Fig. 4)。首先,当底物2中的R为一系列不同电性取代的芳基以及杂芳基时,均可顺利与1a反应,获得相应的产物4a–4h,收率为60–74%,ee为84–98%。其次,当底物2中的R为一系列一级、二级和三级烷基取代时,均可顺利与1a反应,获得相应的产物4i–4s,收率为47–63%,ee为83–98%。此外,该策略还可用于复杂分子的后期衍生化实验,如伊索克酸(4t)、奥沙普秦(4u)和吲哚美辛(4v)。
(图片来源:Nat. Commun.)
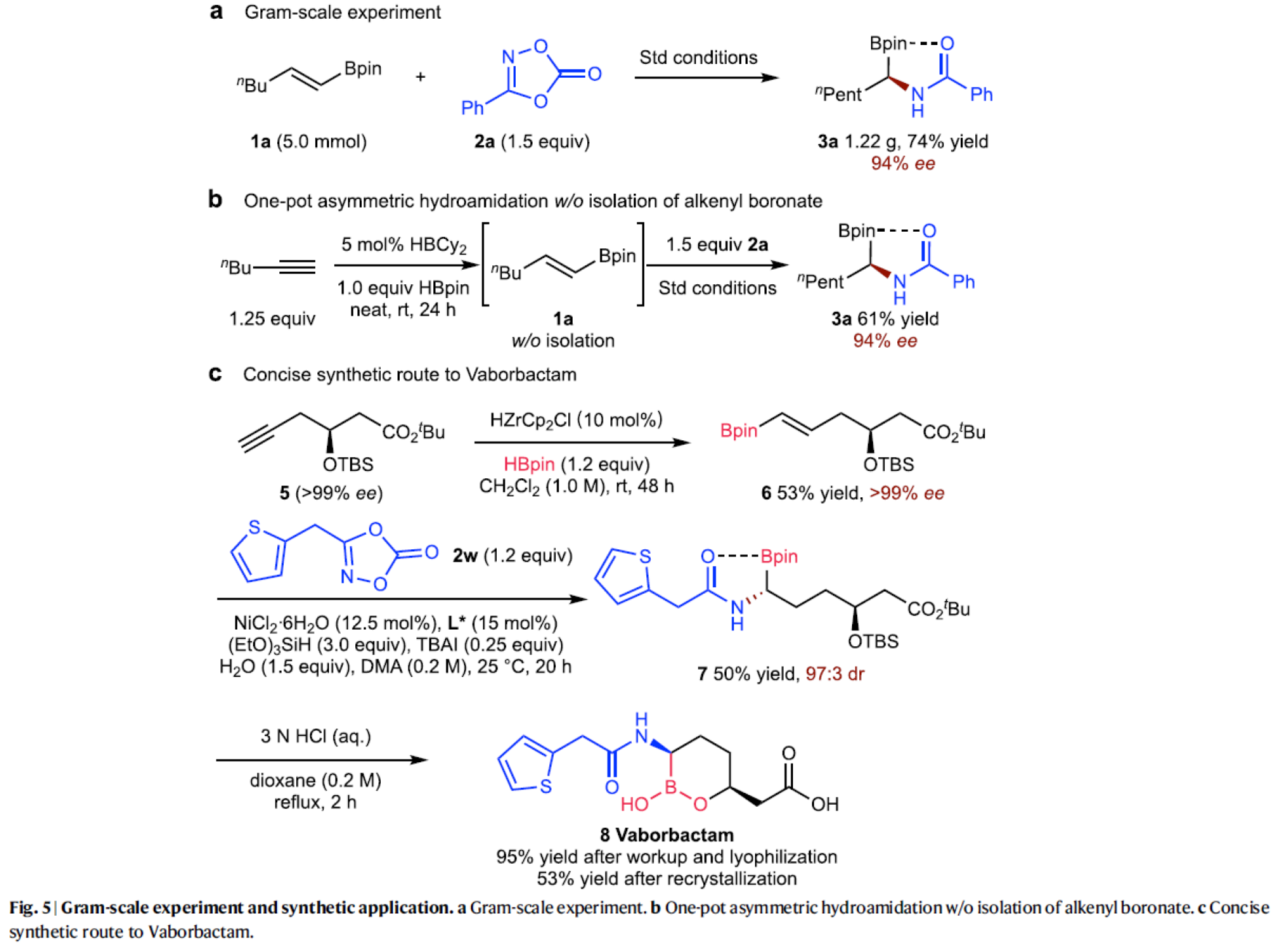
随后,作者还对反应的实用性进行了研究(Fig. 5)。首先,克级规模实验同样能够以74%收率和94%ee得到产物3a。其次,以炔烃为底物,通过一锅法反应,可直接合成最终的氢化酰胺化产物3a,收率为61%,ee为94%,且无需分离氢硼化中间体1a。此外,以炔烃衍生物5为底物,经三步反应(Zr催化氢硼化反应、NiH催化的不对称氢酰胺化反应以及HCl介导的脱保护过程),可合成β-内酰胺酶抑制剂法硼巴坦(Vaborbactam)。
(图片来源:Nat. Commun.)
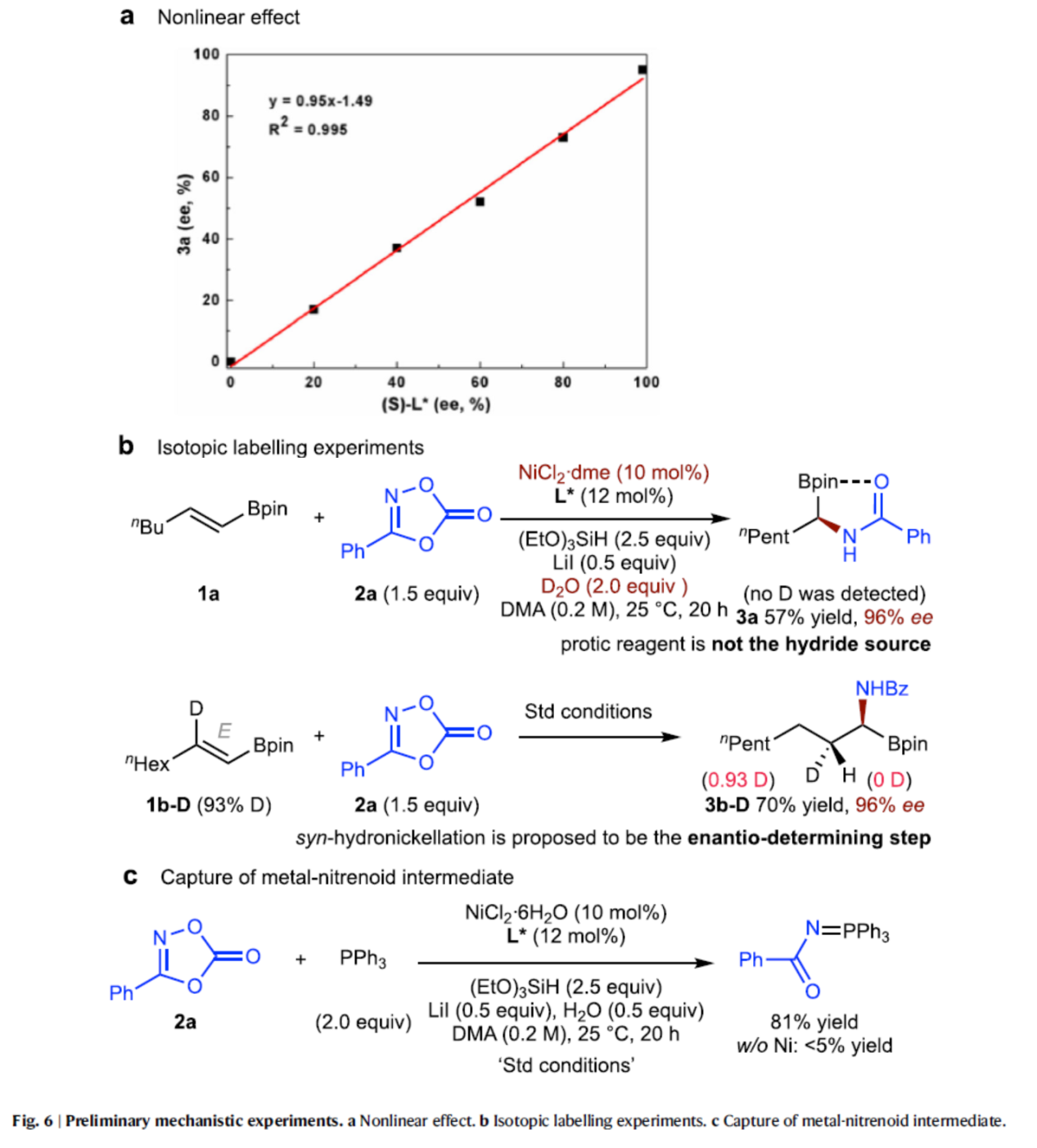
最后,作者对反应机理进行了研究(Fig. 6)。首先,氨基醇配体L*与产物3a中的ee值之间存在一定的线性相关性,这一观察结果和反应过程中单个活性镍催化剂形式上只配一个手性配体一致(Fig. 6a)。由于H2O和氢硅烷都可以作为氢源,因此作者使用D2O进行同位素标记实验(Fig. 6b,top)。在产物(3a)中未观察到氘掺入,排除了水作为镍氢物种氢源的可能性。同时,使用1b-D进行同位素标记实验,可获得非对映异构体纯的3b-D,从而表明顺式氢镍化(syn-hydronickellation)是反应的对映选择性决定步骤。因此,烯基硼酸酯的E-或Z-构型对于产物对映选择性具有显著的影响(cf. Fig. 2, entry 1 vs. entry 15)。为了进一步了解随后的酰胺化过程,作者将三苯基膦(PPh3)与二噁唑酮(2a)在标准条件下进行反应,可以捕获到氮宾中间体,不加镍则几乎不生成产物,从而表明镍-氮宾配合物的形成可能是酰胺化过程的一种可能途径(Fig. 6c)。
(图片来源:Nat. Commun.)
总结 南京大学朱少林团队报道了一种NiH催化烯基硼酸酯与二噁唑酮的不对称氢酰胺化反应,使用简单的手性氨基醇作配体,合成了一系列高光学纯的手性α-氨基硼酸酯。该反应条件温和,底物范围广泛,作者通过对药物分子法硼巴坦(Vaborbatam)的高效合成,进一步证明了反应的实用性。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn