

(图片来源:Angew. Chem. Int. Ed.)
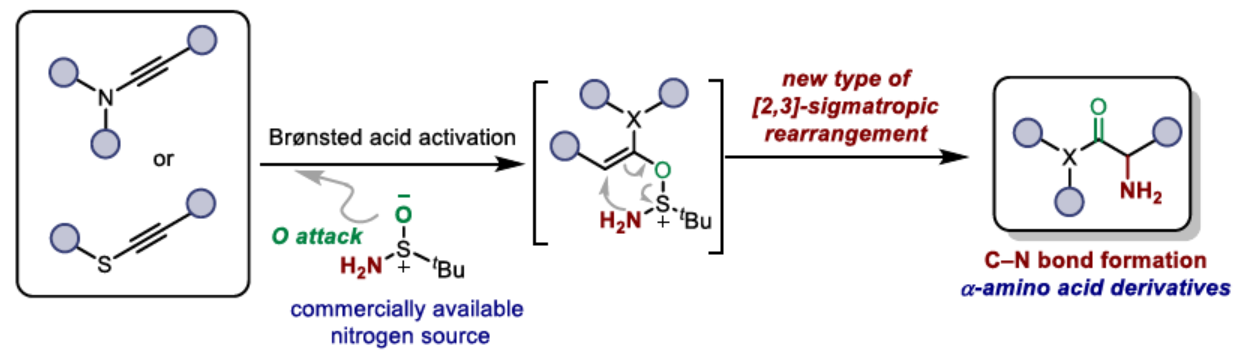
α-氨基酸衍生物广泛存在于各类药物活性化合物和复杂的天然产物中。由于其在调节肽性质方面具有关键的作用,化学家们已开发出了一系列非天然α-氨基羰基衍生物的合成方法。其中,炔烃的水合官能团化反应是合成α-官能团化羰基化合物的有效策略。同时,化学家们还通过Brønsted酸或软过渡金属催化的方法,合成了一系列不同的α-取代羰基产物。然而,上述合成α-氨基羰基化合物的策略存在胺源种类少以及反应需多步操作等弊端。
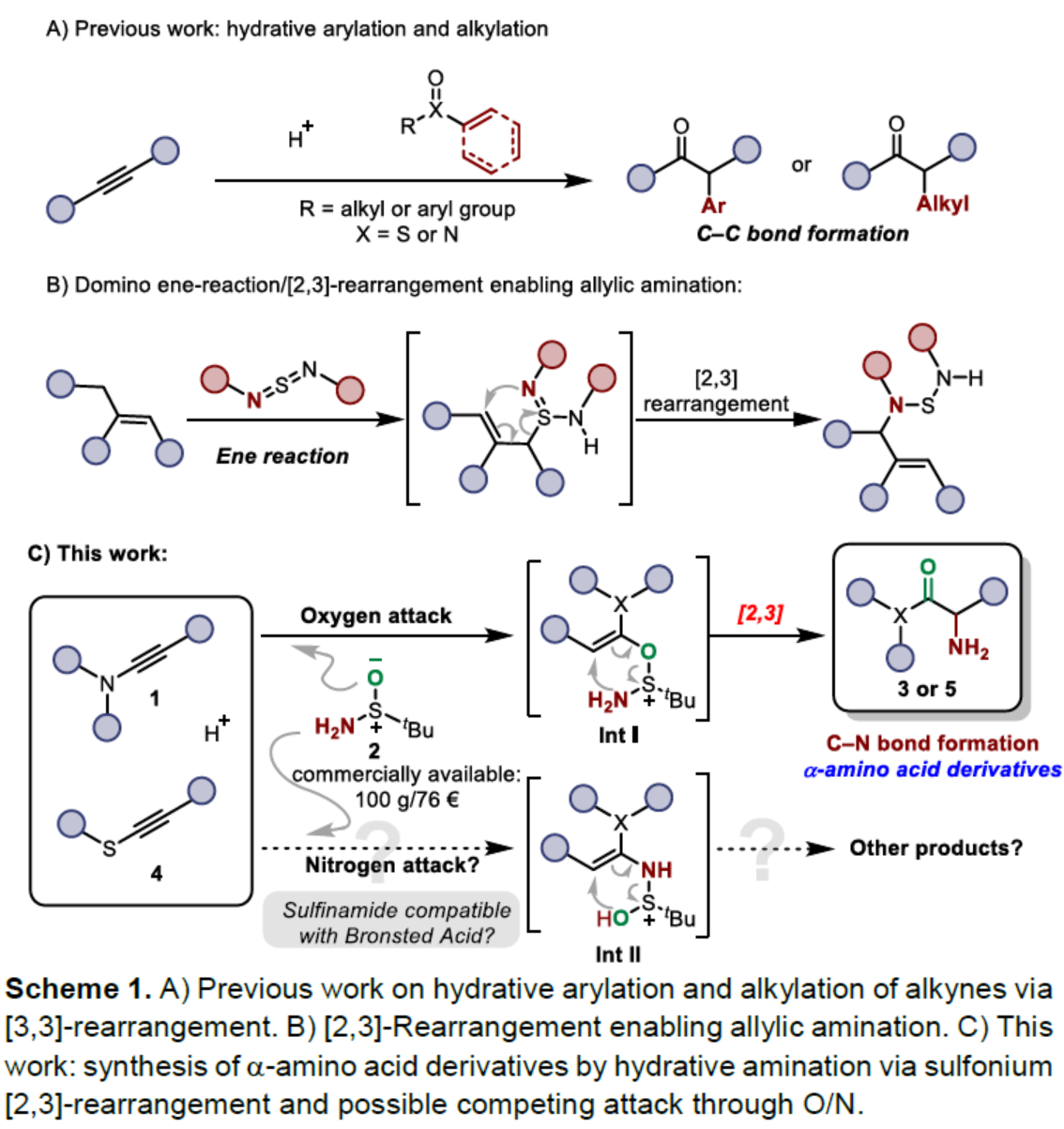
前期,Maulide等课题组基于[3,3]-σ重排策略实现了炔烃的水合官能团化反应,如水合芳基化和烷基化反应(Scheme 1A)。相比之下,[2,3]-σ重排的研究相对较少,尽管Sharpless早在1976年已报道了一份相关的研究成果(Scheme 1B),其中通过ene反应/[2,3]-重排串联过程合成了烯丙基胺类化合物。近日,奥地利维也纳大学Nuno Maulide课题组报道了一种炔烃的水合胺化反应,直接合成了一系列α-氨基酸衍生物。其中,反应涉及关键中间体Int I经[2,3]-σ重排的过程(Scheme 1C)。
(图片来源:Angew. Chem. Int. Ed.)
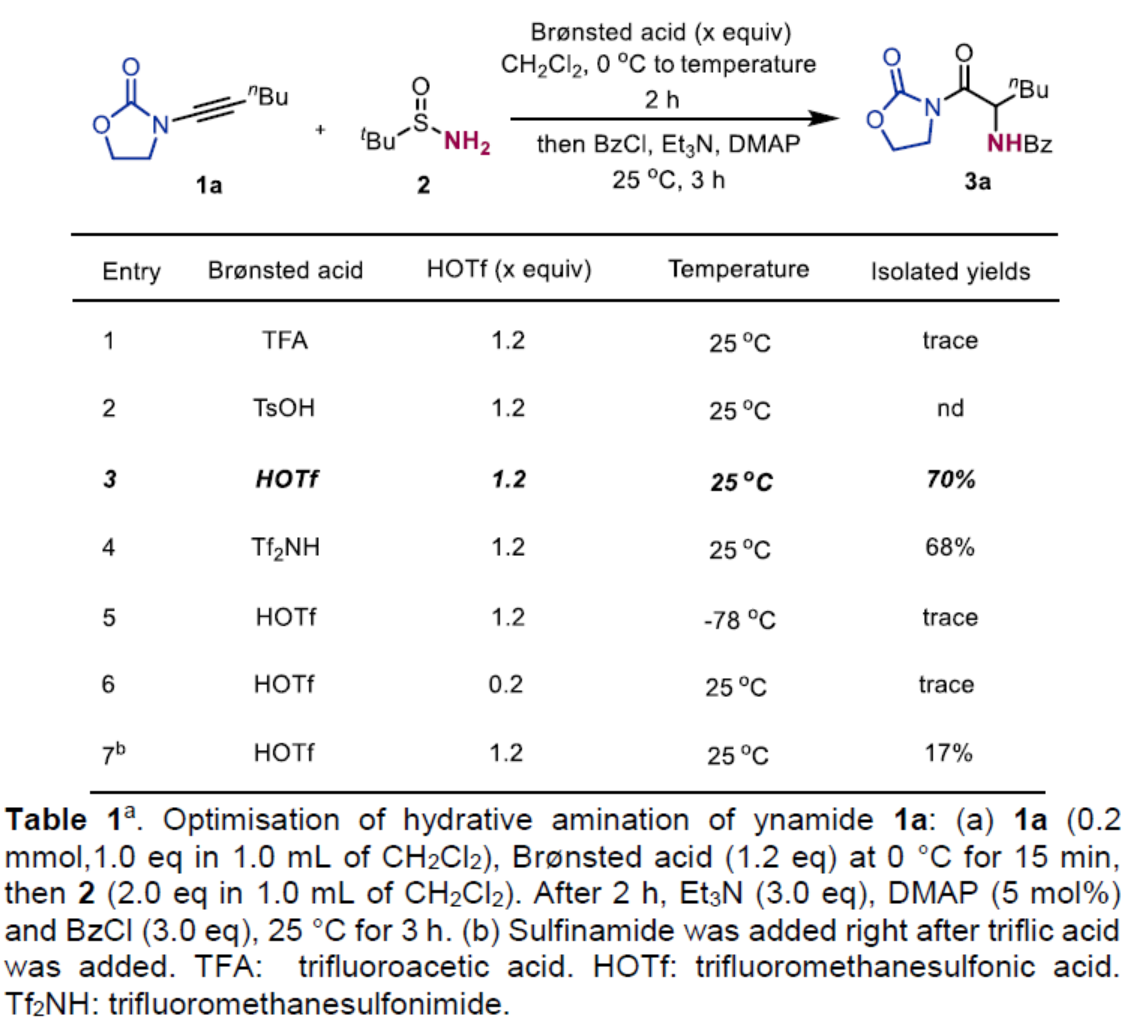
首先,作者以炔酰胺衍生物1a与叔丁基亚磺酰胺2作为模型底物,进行了相关反应条件的筛选(Table 1)。当以HOTf作为Brønsted酸,1a在CH2Cl2溶剂中0 oC反应15 min后,再加入2,并在室温下继续反应2 h。随后,在Et3N /DMAP/BzCl条件下,在CH2Cl2溶剂中25 oC反应3 h,可以70%的收率得到产物3a。
(图片来源:Angew. Chem. Int. Ed.)
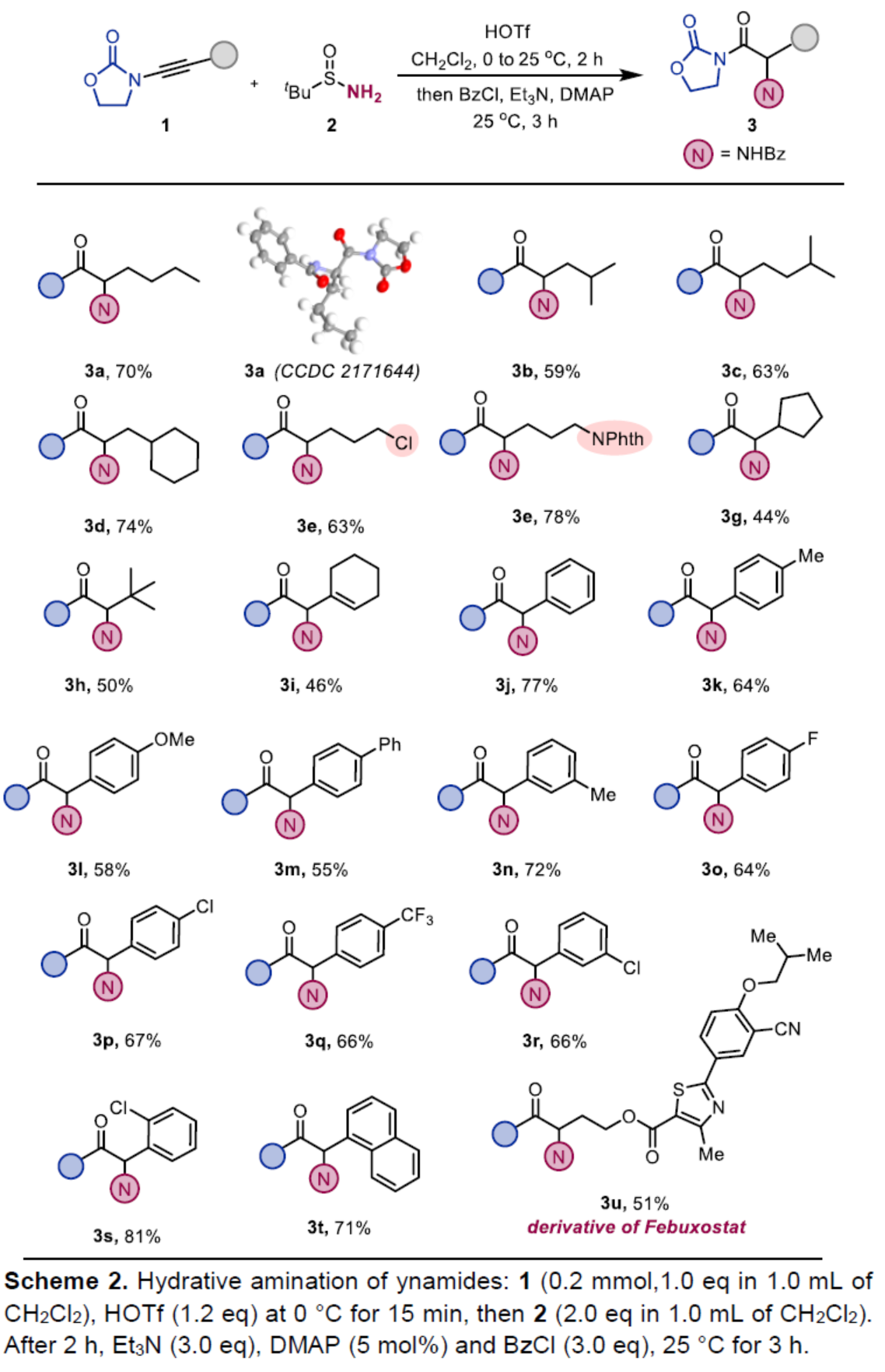
在获得上述最佳反应条件后,作者首先对炔酰胺底物1的范围进行了扩展(Scheme 2)。首先,当炔酰胺底物1的末端炔基含有各种烷基与环烷基时,均可顺利与2反应,获得相应的产物3a-3i,收率为44-78%。其次,当炔酰胺底物1的末端炔基含有不同电性的芳基与萘基时,也能够与2顺利反应,获得相应的产物3j-3t,收率为55-81%。值得注意的是,该策略还可用于药物分子非布司他(febuxostat)的后期衍生化实验,获得相应的产物3u,收率为51%。
(图片来源:Angew. Chem. Int. Ed.)
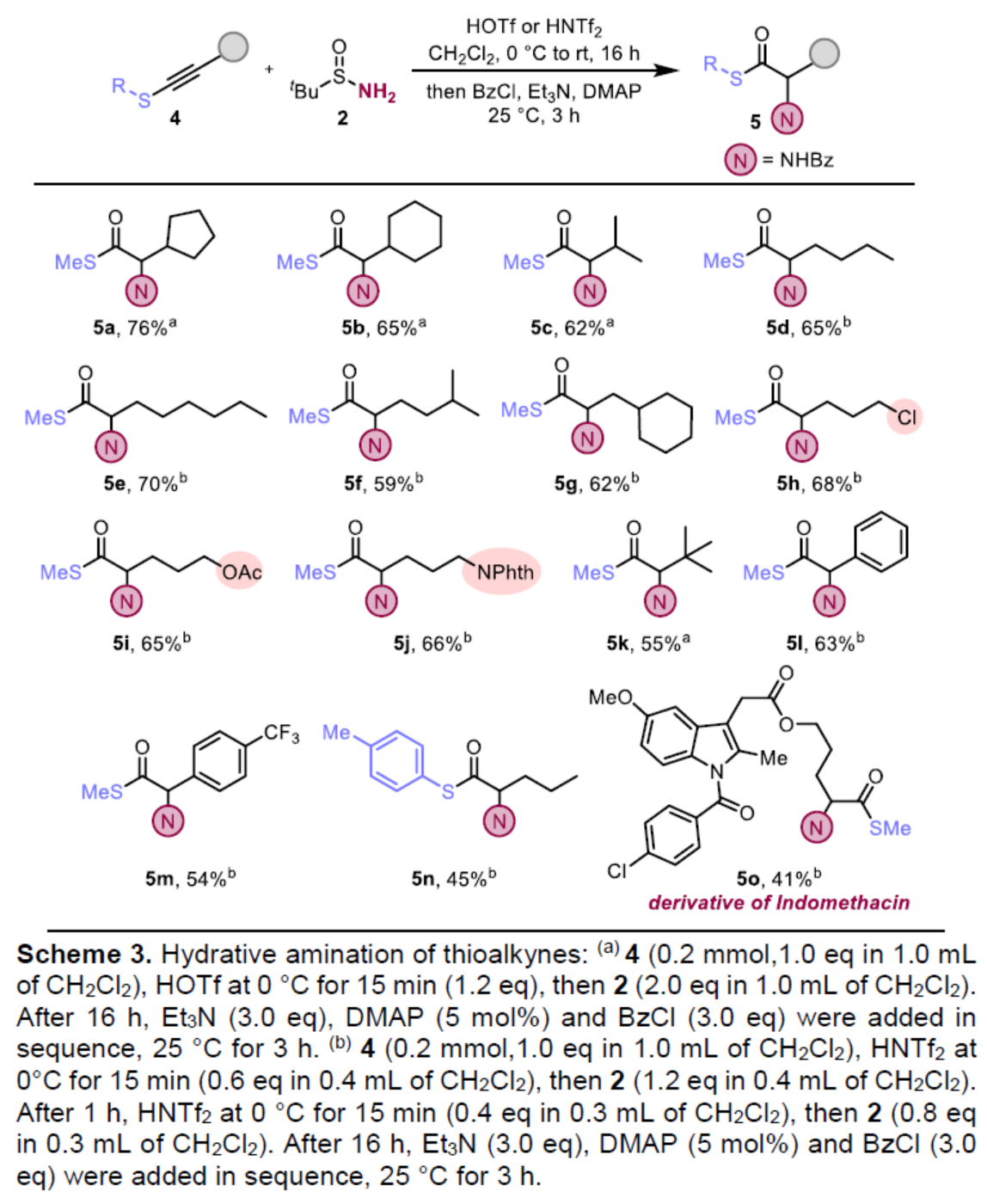
紧接着,作者对炔硫醚底物4的范围进行了扩展(Scheme 3)。首先,当炔硫醚底物4的末端炔基含有各种烷基与环烷基时,均可顺利与2反应,获得相应的产物5a-5k,收率为55-76%。其次,炔硫醚底物4的末端炔基含有芳基或三氟甲基取代的芳基时,也能够与2顺利反应,获得相应的产物5l-5m,收率为54-63%。此外,当炔硫醚底物4中的R为对甲苯基时,也是合适的底物,获得相应的产物5n,收率为45%。值得注意的是,该策略还可用于药物分子吲哚美辛(indomethacin)的后期衍生化实验,获得相应的产物8o,收率为41%。
(图片来源:Angew. Chem. Int. Ed.)
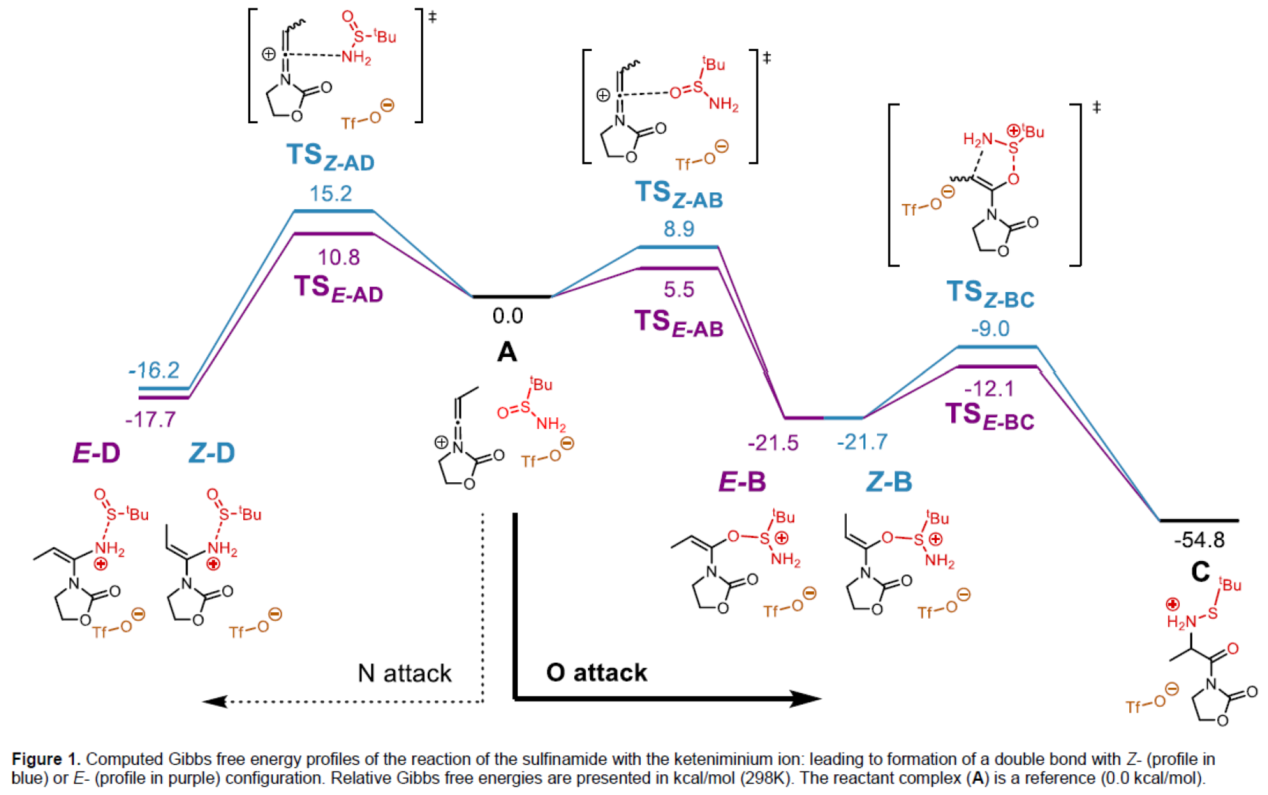
为了进一步阐明反应的机理,作者进行了相关的计算研究(Figure 1)。首先,第一步是亲核进攻过程,假设通过炔酰胺活化瞬间形成烯酮亚胺离子,可能导致中间产物含有Z-或E-双键构型。由于亚磺酰胺反应物含有两个亲核中心(氧和氮),也可通过O(steps A→E-B and A→Z-B,right)或N(steps A→E-D and A→Z-D,left)对烯酮亚胺离子进行亲核进攻。研究表明,通过氧原子对烯酮亚胺离子进行表面进攻,形成E-构型的中间体(A→E-B),具有最低的活化能垒。同时,通过对比TSE-AB与TSE-AD两种过渡态结构发现,氧进攻可能发生在试剂之间的更远距离上。此外,在热力学上,反应有利于中间体E-B和Z-B的形成(通过氧的进攻),从而导致观察到的反应选择性。同时,它们具有等效的热力学稳定性,并且容易发生[2,3]-σ重排(steps E-B→C and Z-B→C),且仅需一步。此外,通过计算发现,在形成含有E-烯烃中间体的路径(紫色轮廓)比所有涉及形成Z-烯烃中间体的路径具有更低的活化能垒,主要是由于烯酮亚胺离子中的甲基与亚磺酰胺中叔丁基的空间排斥导致。
(图片来源:Angew. Chem. Int. Ed.)
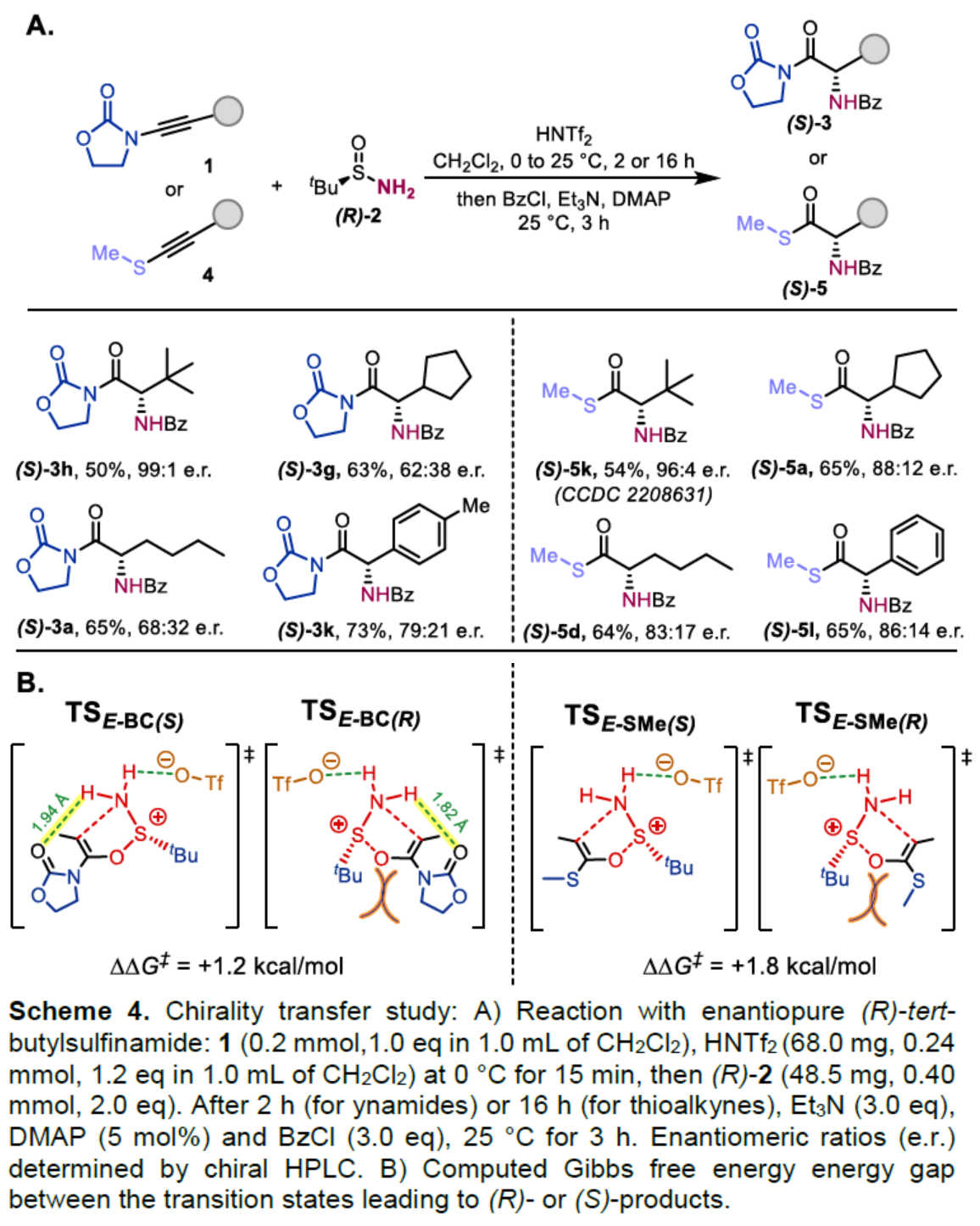
此外,作者还对[2,3]-σ重排过程中的手性转移进行了研究(Scheme 4)。首先,当以炔酰胺衍生物1与(R)-2反应时,可获得(S)-3a、(S)-3h、(S)-3g和(S)-3k,收率为50-73%,e.r.为62:38-99:1。当以炔硫醚衍生物4与(R)-2反应时,可获得(S)-5a、(S)-5k、(S)-5d和(S)-5l,收率为54-65%,e.r.为83:17-96:4。同时,作者还通过相关的过渡态Gibbs自由能的计算,进一步揭示了形成(S)-或(R)-产物的原因(Scheme 4B)。
(图片来源:Angew. Chem. Int. Ed.)
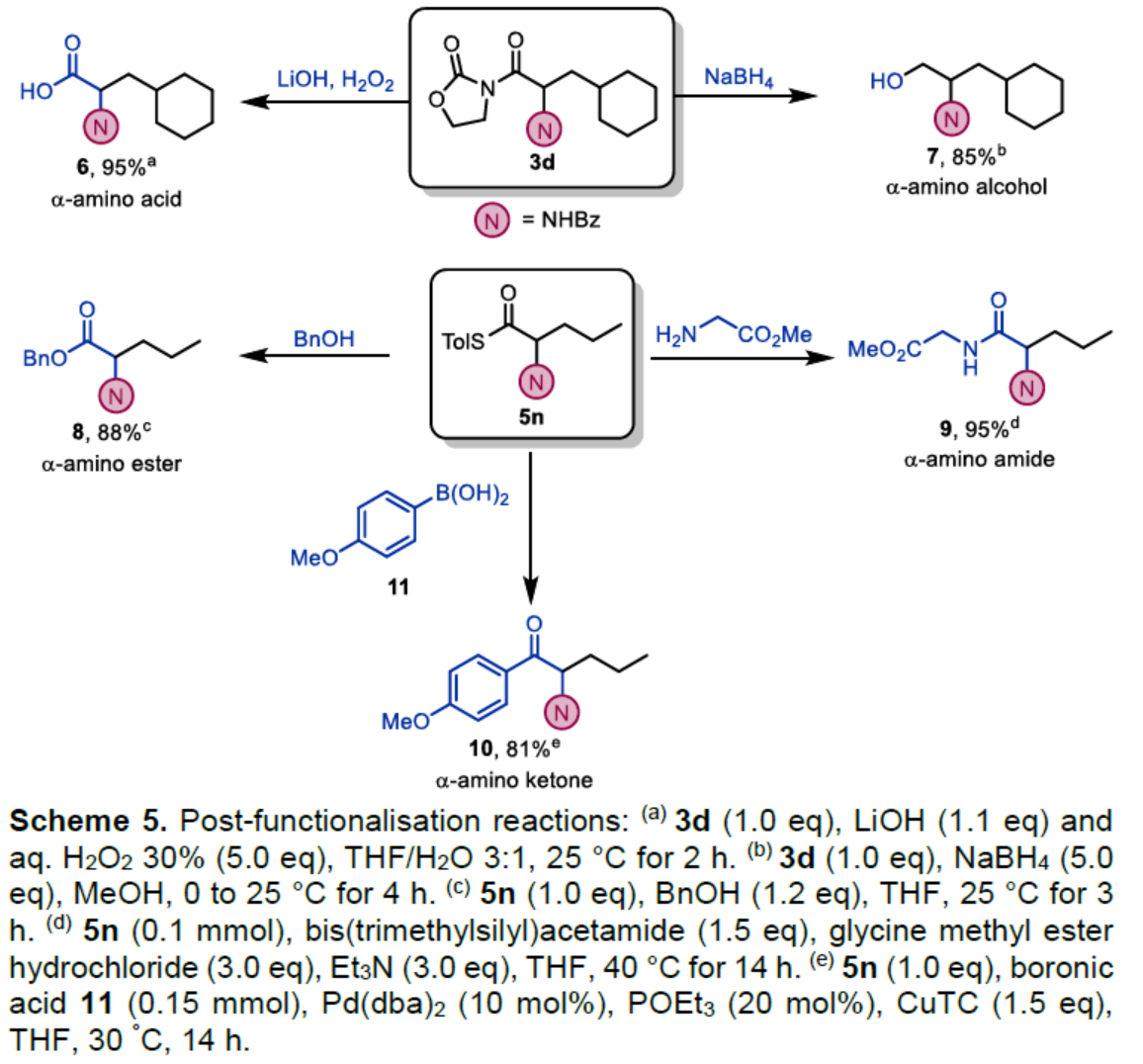
最后,作者对反应的实用性进行了研究(Scheme 5)。首先,3d在LiOH/H2O2条件下进行水解,可以95%的收率得到α-氨基酸衍生物6。3d在NaBH4条件下进行还原,可以85%的收率得到α-氨基醇衍生物7。其次,5n在BnOH条件下,可以88%的收率得到α-氨基酯衍生物8。5n与甘氨酸甲酯反应,可以88%的收率得到α-氨基酰胺衍生物9。此外,5n与硼酸衍生物11反应,可以81%的收率得到α-氨基酮衍生物10。
(图片来源:Angew. Chem. Int. Ed.)
总结
奥地利维也纳大学Nuno Maulide课题组报道了一种炔硫醚/炔酰胺的水合胺化反应,直接合成了一系列α-氨基酸衍生物。其中,该反应以亚磺酰胺作为氮源。同时,该反应无需使用金属催化,具有底物范围广泛、反应条件温和、收率高等特点。机理研究表明,反应涉及一种新型的硫[2,3]-σ重排的过程。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn