

(图片来源:Nat. Commun.)
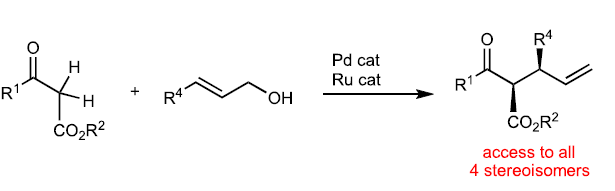
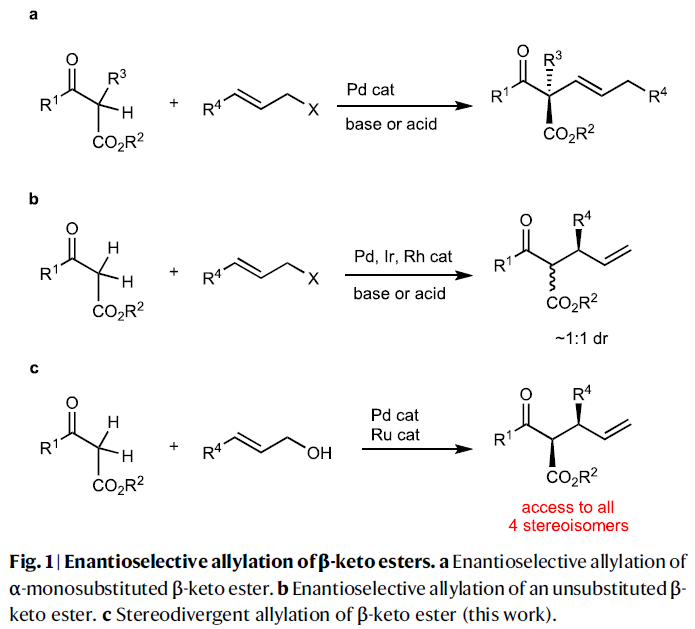
β-酮酯的α-烷基化反应是构建C-C键的有效手段,其广泛的应用于有机合成中。而发展其立体选择反应仍然是一个重大的挑战,主要是由于产物容易在酸性或碱性条件下发生外消旋化。近些年,化学家们利用Tsuji–Trost类型的不对称烯丙基化反应来实现1,3-二羰基化合物的烷基化,但是其通常仅能实现单一立体中心的构建(Fig. 1a),且催化体系不能同时控制两个季碳中心的立体化学(Fig. 1b)。最近,日本名古屋大学Masato Kitamura和日本国家先进工业科学技术研究所Shinji Tanaka课题组发展了Ru/Pd协同催化体系,实现了α-非取代β-酮酯与烯丙基醇的不对称脱水缩合反应,以良好的区域选择性、对映选择性以及非对映选择性实现了具有两个连续手性中心的α-单取代产物合成(Fig. 1c)。
(图片来源:Nat. Commun.)
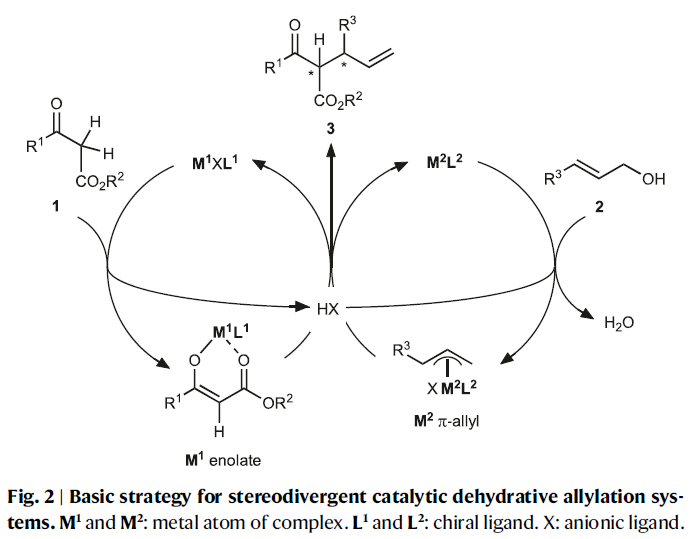
基于立体发散烯丙基化反应的二元手性催化体系(M1XL1和M2L2),作者提出了此转化的基本策略(Fig. 2):首先,催化剂M1XL1活化β-酮酯1形成相应的金属烯醇中间体(M1 enolate)。阴离子X作为Brønsted碱攫取β-酮酯1中的质子形成HX。催化剂M2L2活化烯丙基醇2形成π-烯丙基络合物(M2 π-allyl)。由于烯丙醇与HX之间形成氢键后会活化C-O键,因此会促进其与M2L2的氧化加成过程,并伴随着水的释放。最后,金属烯醇中间体(M1 enolate)与π-烯丙基络合物(M2 π-allyl)反应得到烯丙基化产物3。由于M1L1和M2L2的不同手性环境可以区分金属烯醇中间体和π-烯丙基的对映面选择性。因此,对M1XL1和M2L2的选择至关重要。
(图片来源:Nat. Commun.)
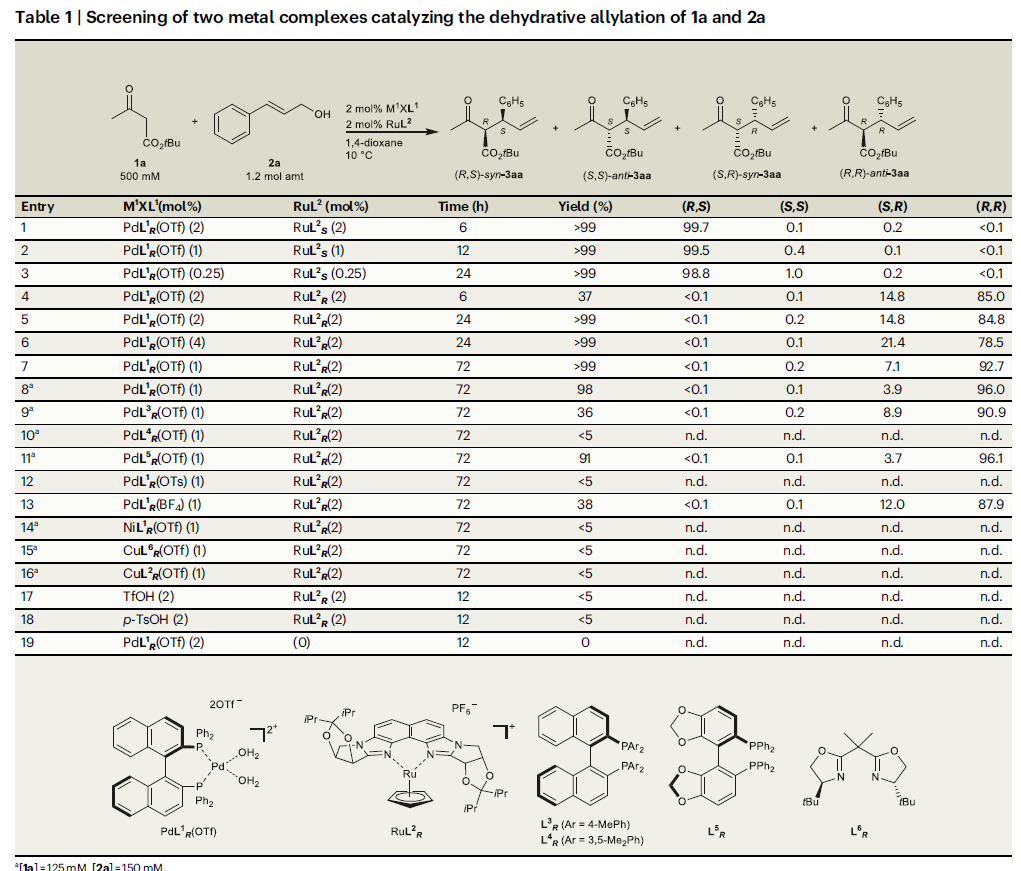
作者首先利用3-氧代丙酸叔丁酯1a和肉桂醇2a作为模板底物对反应进行探索(Table 1)。通过条件筛选,作者发现RuL2R/PdL1R(OTf)(非匹配的催化体系)和RuL2S/PdL1R(OTf) (匹配的催化体系)体系可以以良好的区域选择性、对映选择性以及非对映选择性实现α-单取代产物的合成。
(图片来源:Nat. Commun.)
在得到最优条件后,作者对在PdL1R(OTf)/RuL2S催化体系(匹配的催化体系)中β-酮酯1与肉桂醇2a反应时的底物兼容性进行探索(Table 2)。将1中羰基所连接的Me变化成H、Et、iPr、CH2OCH3、Ph后均未对反应性和选择性产生影响(entries 1-4,6,7)。具有较大位阻的tBu存在时会完全抑制反应(entry 5)。此外,无论缺电子苯环还是富电子苯环均可与此体系兼容(entries 8,9)。α-位Me或F取代的β-酮酯具有良好的兼容性,而α-位Bn取代的底物并没有反应活性(entries 10-12)。值得注意的是,环状酮酯底物也具有良好的反应性(entry 13)。
接下来,作者对烯丙基醇2的底物适用性进行探索(Table 2)。实验结果表明,将F、Me、OMe、Cl、CF3等一系列取代基引入到肉桂醇苯环的邻、间、对位后均具有良好的兼容性(entries 14-24)。此外,将苯基替换成其它芳环也具有良好的反应性(entries 25-27)。值得注意的是,烷基取代的烯丙基醇参与反应时以中等的对映选择性(64:36 er)得到线性产物(entry 28)。

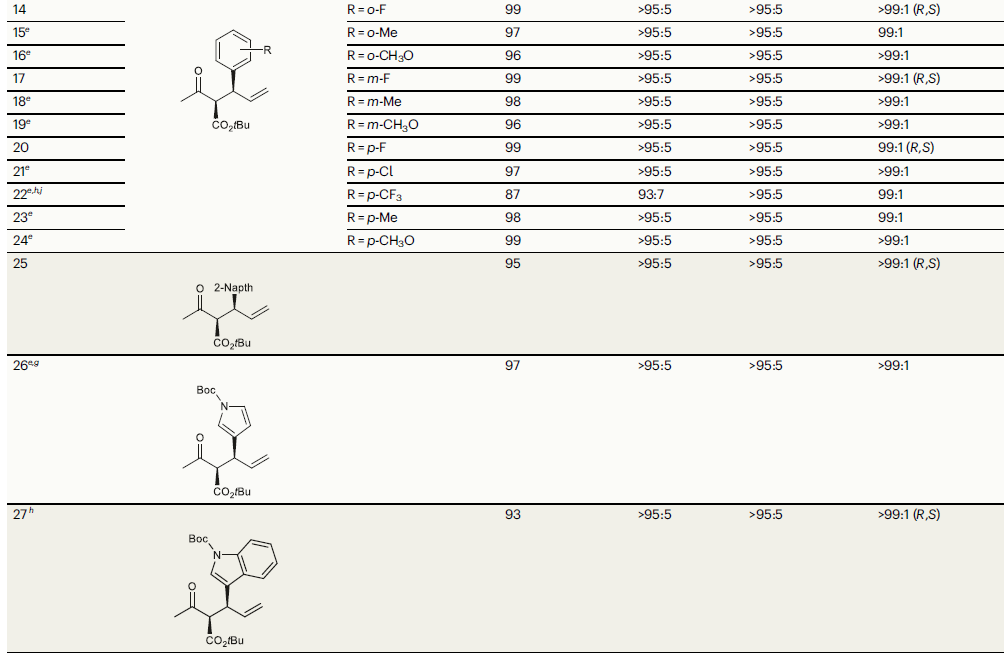
(图片来源:Nat. Commun.)
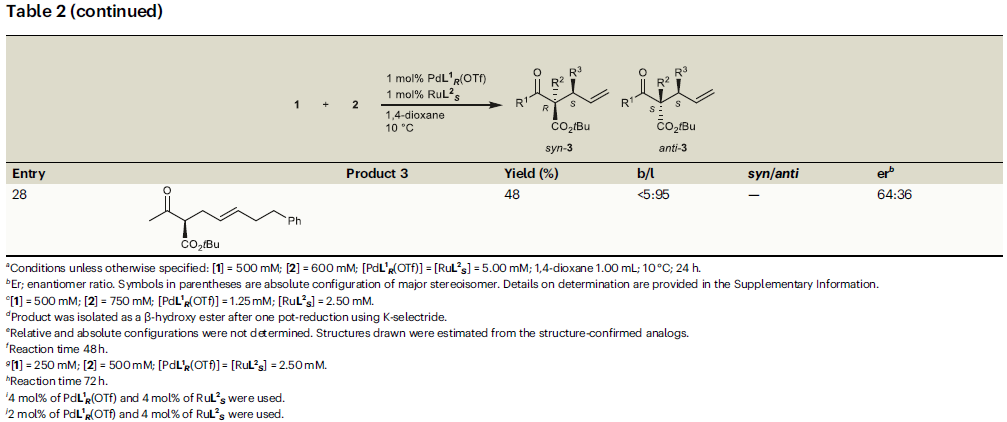
(图片来源:Nat. Commun.)
在非匹配的催化体系(PdL1R(OTf)和RuL2R)中(Table 3),乙基或苯基取代的β-酮酯与匹配的催化体系反应结果基本类似,但是异丙基取代的底物不能兼容(entries 1-4)。α-位F代的β-酮酯仍具有良好的兼容性(entry 5)。此外,烯丙基醇2的底物适用性与匹配的催化体系反应结果基本类似(entries 6-10)。
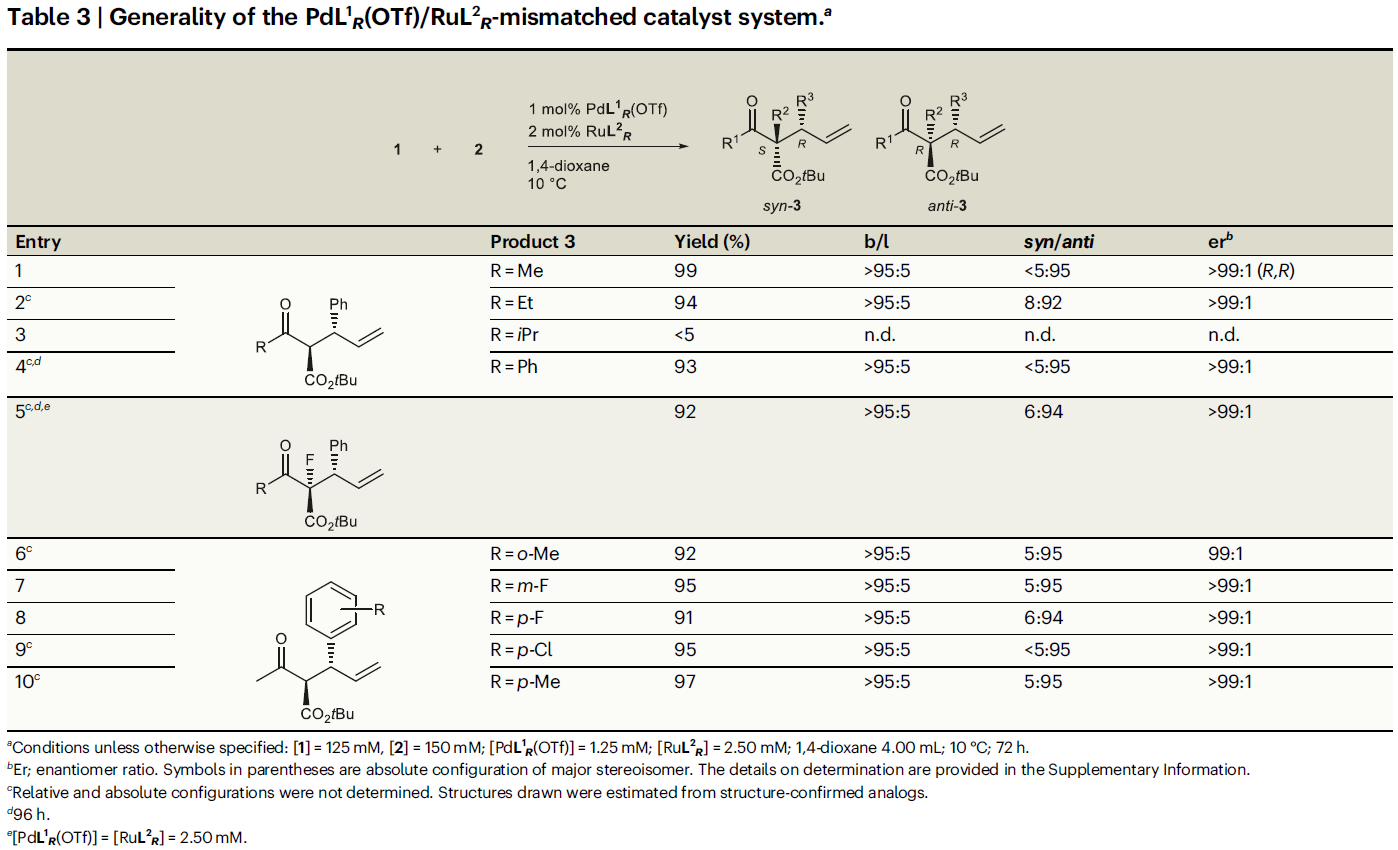
(图片来源:Nat. Commun.)
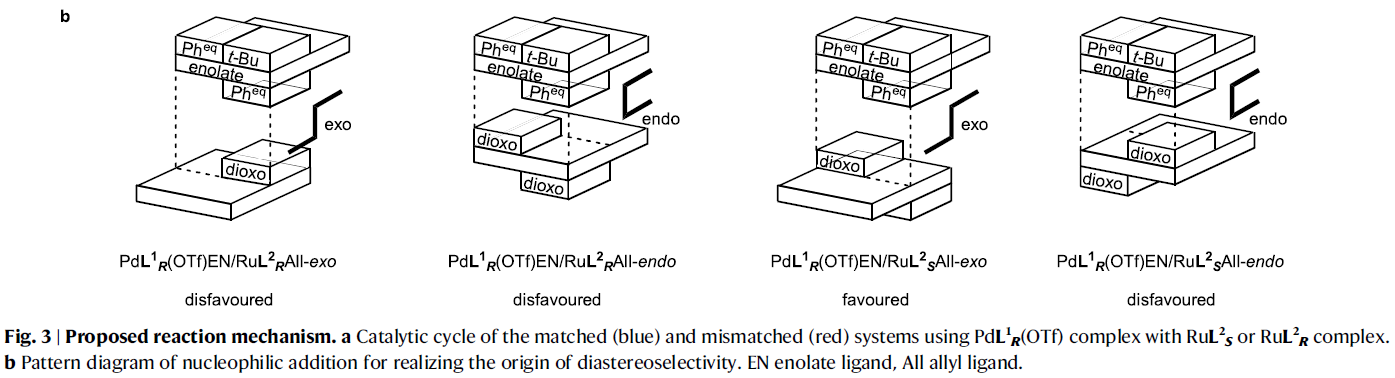
接下来,作者提出了此反应可能的反应机理(Fig. 3)。首先,PdL1R(OTf)与底物1反应形成钯烯醇中间体(Pd enolate),且烯醇阴离子与钯金属中心以双齿模式配位。此外,反应中释放的TfOH会与RuL2S结合来实现烯丙基醇的活化从而形成endo-π-烯丙基物种RuL2SAll,并释放一分子水(RDACat机理)。最后,钯烯醇中间体进攻烯丙基物种得到目标产物3并再生PdL1R(OTf)和RuL2S。值得注意的是,在π-烯丙基络合物RuL2SAll的形成过程中,由于手性配体L2S的存在,使得其可以选择性的以单一异构体形成RuL2SAll络合物。此外,由于π-烯丙基上的取代基R2处于远离手性配体L2S大位阻部分的位置,因此Ru占据了π-烯丙基配体的Si面(R2 = Ph)(如RuL2SAll所示)。在PdL1REN中,由于BINAP骨架上的两个苯基遮挡了平面烯醇化物的一侧,而羧酸盐上的叔丁基为了避免与BINAP的一个苯基的立体排斥作用而处于另一侧。由于两个苯基和一个叔丁基均占据了一定的空间,使得钯烯醇中间体只仅能从外部接近RuL2SAll从而形成(R,S)-3作为主要的异构体。此外,反应中大位阻的叔丁基对非对映选择性至关重要,而当使用甲基代替叔丁基时,仅得到混合的非对映异构体(1:1)。值得注意的是,不论是在匹配或不匹配的催化体系中,π-烯丙基部分的对映面选择性几乎是完美的,且烯醇中间体的选择受到空间位阻的高度影响(Fig. 3a)。此外,Fig. 3b展示了匹配或非匹配催化体系的亲核进攻模型。模型表明亲核进攻过程由于BINAP (L1)的联萘骨架和Naph-diPIM-dioxo-iPr (L2)的萘骨架的相对立体化学不同会产生exo和endo两种模式。
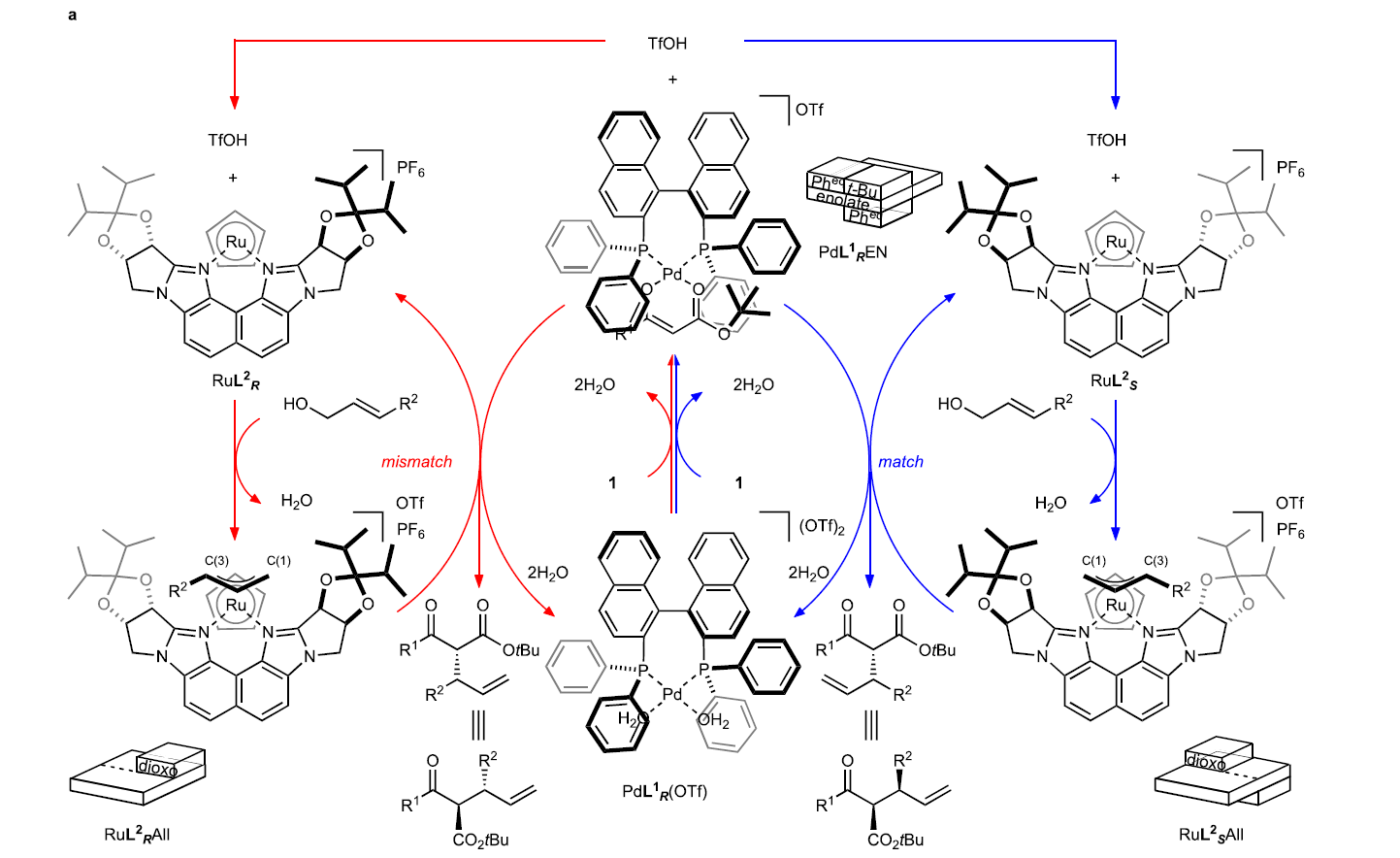
(图片来源:Nat. Commun.)
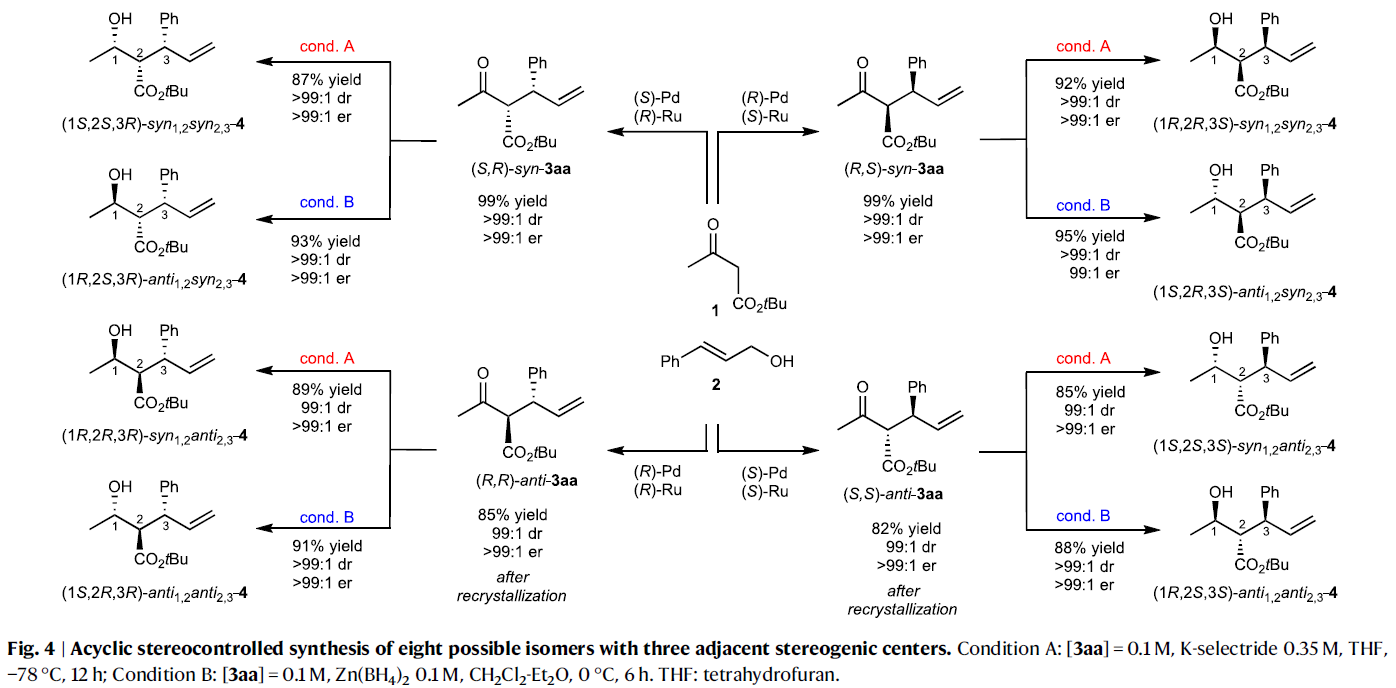
对产物3中的羰基进行还原可以实现另一个立体中心的构建。如Fig. 4所示,通过非对映选择性还原过程可以控制三个相邻的手性碳中心。例如,在匹配的PdL1R(OTf)/RuL2S体系中得到的产物(R,S)-syn-3aa可以被K-selectride(cond. A)还原得到产物syn, syn-4。且用Felkin-Ahn模型可以进一步解释非对映选择性的来源。此外,使用Luche还原(LaCl3/NaBH4)仍可以以较高的选择性实现syn, syn-4(93:7 dr)的合成。相反,当使用Zn(BH4)2(cond. B)还原(R,S)-syn-3aa时却得到另一种异构体anti, syn-4。而此还原过程可以通过Zimmerman–Traxler螯合模式进行解释。并且,利用上述方法还可以将(S,R)-syn-3aa分别还原(S,S,R)-syn, syn-4和(R,S,R)-anti, syn-4。此外,(R,R)-anti-3aa和(S,S)-anti-3aa也可以分别利用上述还原方法实现高对映选择性还原。总体来说,利用上述还原方法与发展的立体发散烯丙基化反应相结合,可以实现8种非对映异构体的合成。
(图片来源:Nat. Commun.)
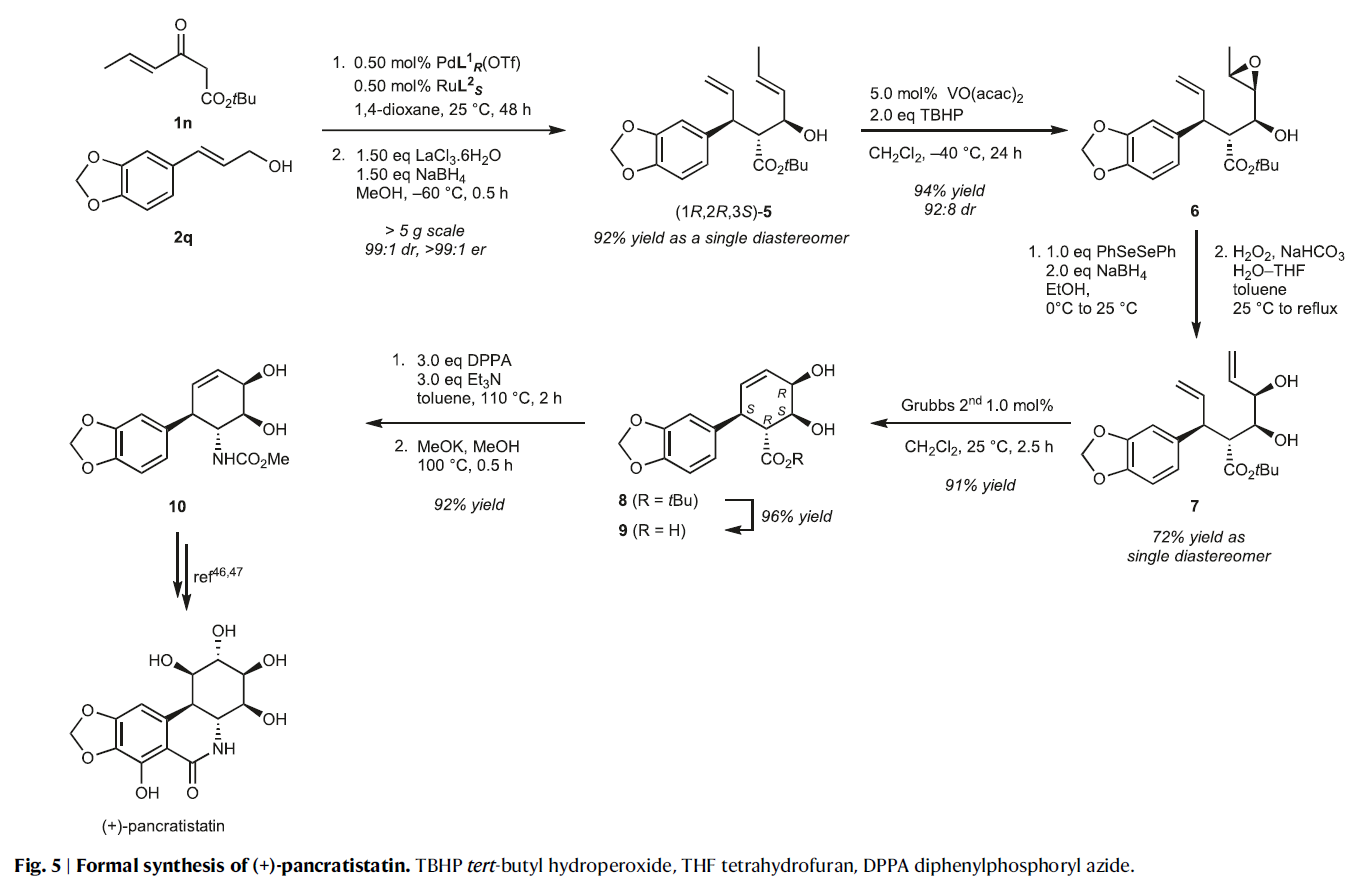
最后,作者应用发展出的方法实现了(+)-pancratistatin的形式合成,证明了此方法的实用性(Fig. 5)。首先,作者使用β-酮酯1n和烯丙基醇2q并利用发展出的催化方法(0.5 mol% PdL1R(OTf), RuL2S, 1,4-dioxane, 25 °C, 48 h, > 99% yield (NMR), >99:1 er, 99:1 dr)和Luche还原一锅实现单一异构体5的合成(92%)。随后,5中的内烯部分可以通过与VO(acac)2/TBHP反应,高区域选择性和非对映选择性实现环氧化产物6的合成(94%, 92:8 dr)。接下来,6的环氧部分通过区域选择性开环、亲核硒醇加成、硒醚的氧化以及β-消除过程得到烯丙基醇产物7。随后7利用Grubbs二代催化剂通过关环复分解反应以91%的产率得到邻二醇产物8。而8可以通过酯水解过程以接近定量产率得到相应的羧酸产物9。最后,9通过Curtius重排以92%的产率得到中间体10,并根据Hudlicky报道的过程即可实现(+)-pancratistatin的合成(J. Am. Chem. Soc. 1996, 118, 10752)。虽然此合成方法在合成步数和总产率并不是最突出的,但其每一步的化学产率都很高。而当每种手性催化剂使用得当时,实现立体控制是很简单的。即通过改变催化剂的手性和试剂的种类,即可实现各种立体异构体的合成。此外,此方法还可以减少保护基的使用。
总结
日本名古屋大学Masato Kitamura和日本国家先进工业科学技术研究所Shinji Tanaka课题组发展了Ru/Pd协同催化体系,实现了α-非取代β-酮酯与烯丙基醇的不对称脱水缩合反应,以良好的区域选择性、对映选择性以及非对映选择性实现了α-单取代产物的合成。通过对催化体系中钯或钌络合物的立体化学的调控,可以分别选择性实现四种非对映体的合成。此外,通过对产物中羰基的非对映选择性还原可以实现三个连续立体中心的构建,实现八种非对映异构体的合成。值得注意的是,利用发展的催化体系可以实现(+)-pancratistatin的形式合成,证明了此反应具有良好的实用性。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn