

(图片来源:J. Am. Chem. Soc.)
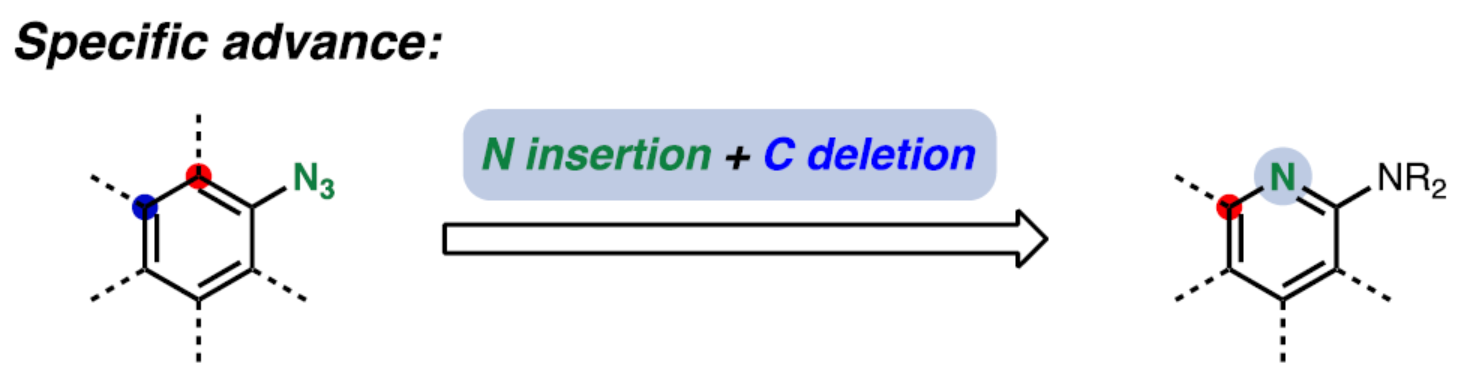
官能团相互转化是合成有机化学的基础。尽管如此,许多常见官能团之间的直接相互转换仍然难以捉摸。例如,苯直接转化为吡啶,涉及碳到氮原子的交换过程(Figure 1A)。吡啶是最常见的芳香杂环,也是在美国FDA批准的药物中第二常见的杂环。吡啶也是一种重要的苯等排体,可用于调节亲脂性并提高水溶性、代谢稳定性和氢键能力,同时仍保持类似苯的特性。事实上,药物发现程序通常会进行系统的氮原子扫描(N-scans),其中先导化合物中的CH单元被氮原子取代,以改善分子和物理化学性质。这种所谓的“必要的氮原子”效应已被证明可以改善各种关键药理参数,包括从10倍到1000倍的效力(Figure 1B)。然而,目前进行N-扫描的策略依赖于先导化合物及其衍生物的自下而上的再合成。在理想情况下,若能通过单反应操作直接将CH基团交换为氮原子,则更具吸引力。
一个多世纪以来,修饰常见分子的反应引起了化学家的浓厚兴趣。这类反应的最早例子包括Ciamician-Denstedt重排、Beckmann重排和Baeyer-Villiger氧化。近年来,令人兴奋的进展还包括Levin课题组的氮和碳删除(nitrogen and carbon deletion),以及Sarpong课题组饱和杂环的光化学环收缩反应。虽然环扩张/收缩已被广泛探索,但单原子交换却较少有相关的研究。化学家们认为,在不改变环大小的情况下,使用另一个原子替换环体系中的一个原子的能力,能够实现骨架的高效编辑。近日,美国斯坦福大学Noah Z. Burns课题组报道了一种将芳基叠氮化物(易从相应的苯胺获得,且无需柱色谱分离)转化为氨基吡啶的策略(Figure 1C)。同时,氨基吡啶是许多药物中的常见结构单元(Figure 1D)。
(图片来源:J. Am. Chem. Soc.)
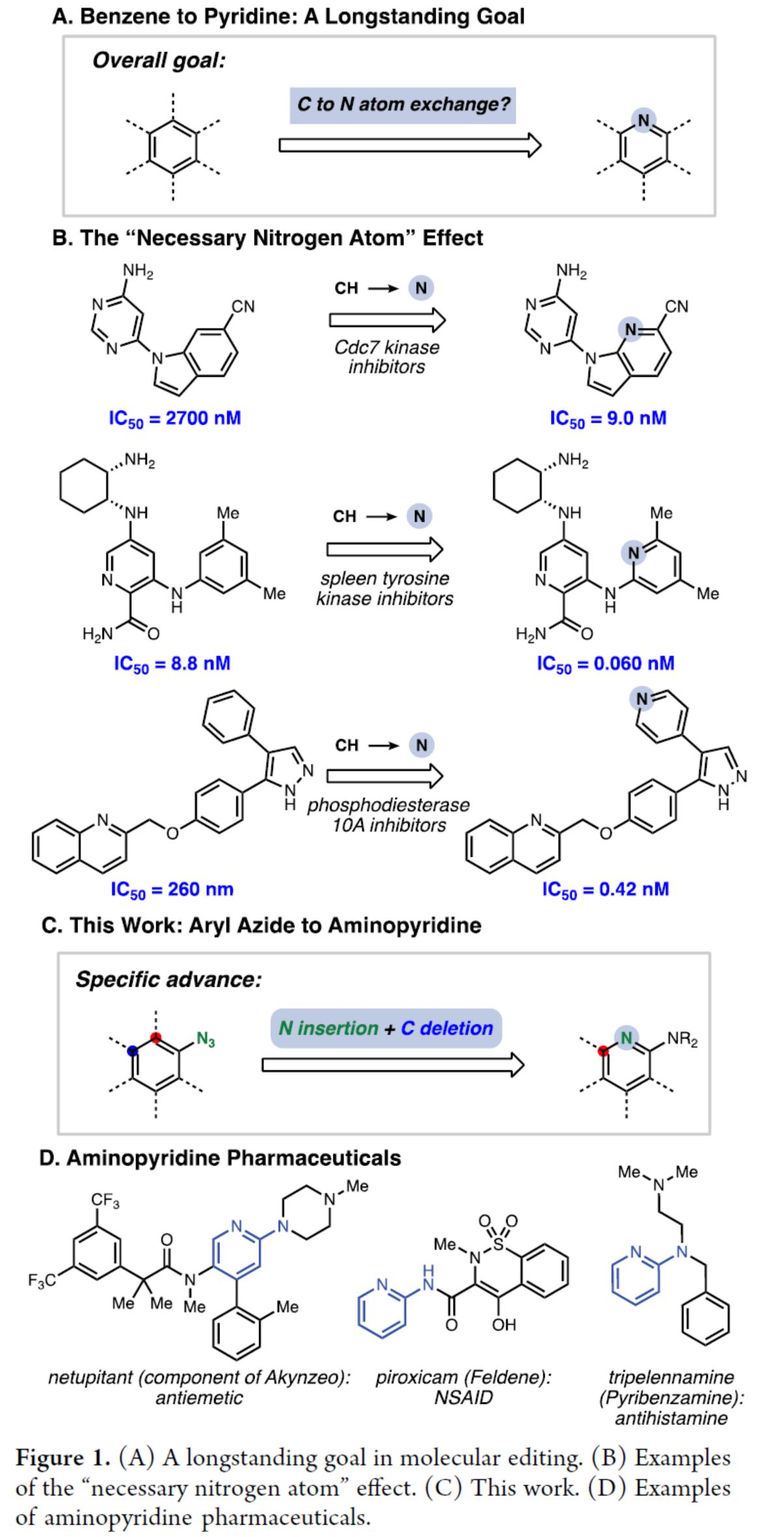
1972年,Sundberg课题组开发了一种在中压汞灯与二乙胺条件下,可光解烷基和芳基取代的苯基叠氮化物,生成几种混合产物,包含两种2-氨基吡啶产物(Figure 2A)。然而,亲核试剂二乙胺以溶剂量使用,中压汞灯用作光源,限制了官能团的耐受性。此外,该反应的收率低,并生成多种的混合产物,包括两种不同取代的吡啶,需要使用制备气相色谱进行分离。
为了解决上述的问题,作者以芳基叠氮化物1a作为底物,进行了光化学反应的研究(Figure 2B)。当在氧气中于各种辐照条件下反应时,可获得少量(≤9%)的2-氨基吡啶3a,以及主要产物3H-䓬2a。作者认为,2a可能是合成3a的关键中间体,因此作者探索了相关的氮插入的过程。
(图片来源:J. Am. Chem. Soc.)
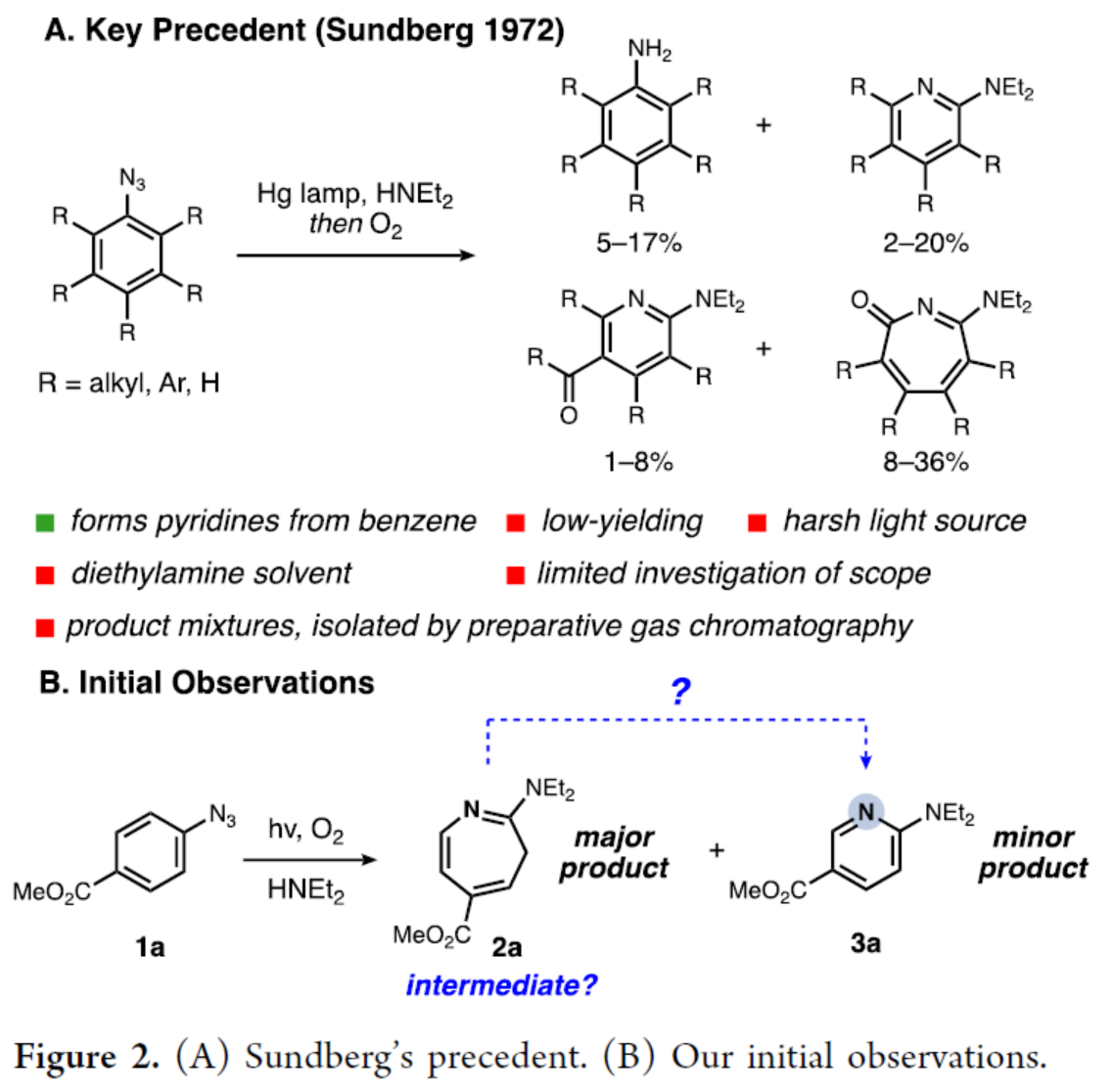
首先,通过氮插入反应条件的优化后发现(Scheme 1A),当以蓝色LEDs作为光源,Et2NH(1.1 eq)作为亲核试剂,THF作为溶剂,在氮气氛围中反应,可以>99%的收率得到䓬产物2a。其次,通过对“碳删除”反应条件的优化后发现(Scheme 1B),当以蓝色LEDs作为光源,苊烯作为光敏剂,在氧气氛围中反应,可以54%的收率得到2-氨基吡啶产物3a。此外,为了进一步简化合成的过程,作者还进行了一锅法的研究(Scheme 1C)。研究表明,在蓝色LEDs辐射下,1a先于Et2NH/THF条件下进行氮插入反应,随后在氧气氛围中于苊烯/MeOH条件下进行碳删除反应,可以57%的收率得到2-氨基吡啶产物3a。
(图片来源:J. Am. Chem. Soc.)
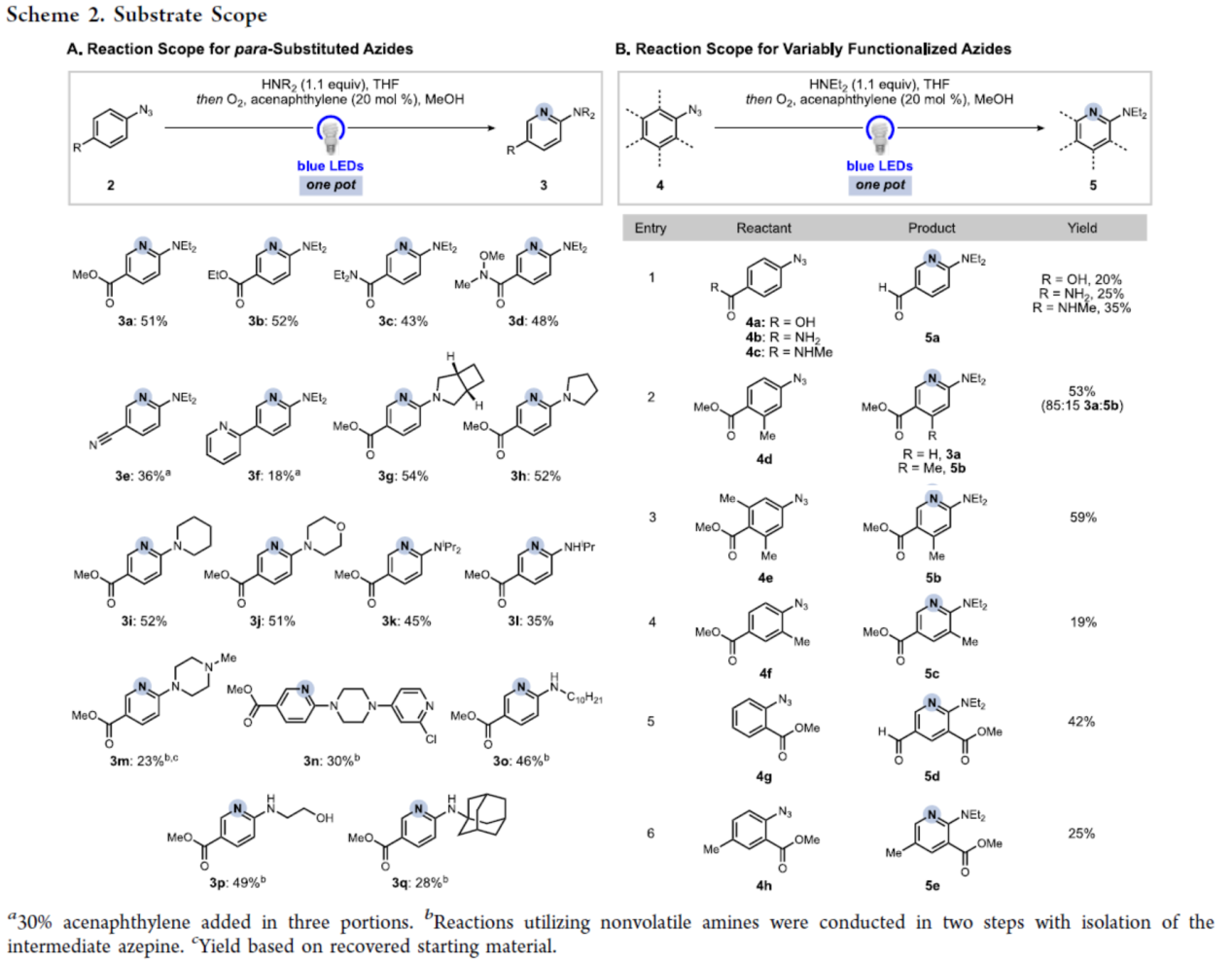
在获得上述最佳反应条件后,作者对底物范围进行了扩展(Scheme 2)。首先,对位含有一系列吸电子取代基的芳基叠氮化物,均可顺利与Et2NH进行反应,获得相应的产物3a-3f,收率为18-52%。其次,一系列伯胺或仲胺,均与体系兼容,获得相应的产物3g-3q,收率为23-54%。此外,一系列具有不同官能团的芳基叠氮化物,均可与Et2NH顺利进行反应,获得相应的产物5a-5e,收率为19-59%。
(图片来源:J. Am. Chem. Soc.)
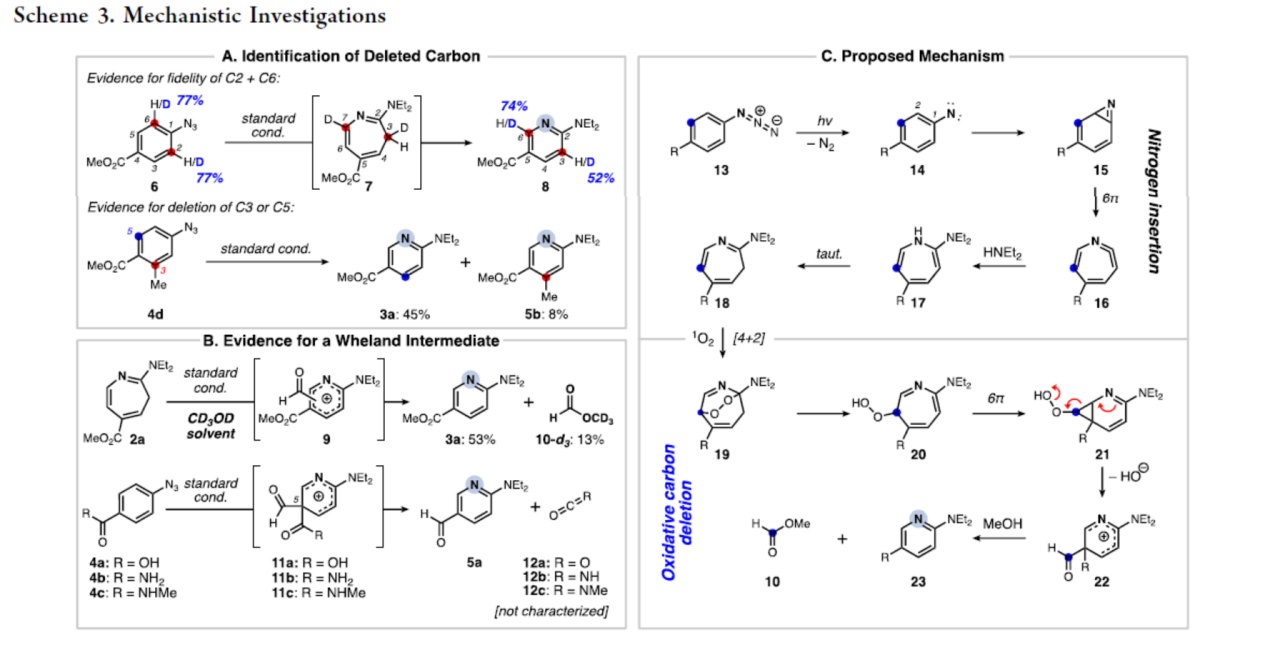
紧接着,作者还对反应机理进行了进一步的研究(Scheme 3)。首先,通过碳删除的相关实验,从而排除了从6中删除邻位碳的可能性。同时,在第二阶段删除了间位碳(Scheme 3A)。其次,通过对Wheland中间体的研究发现,删除的碳被氧化,然后作为甲酰基单元被切除,并与醛中间体沿着反应途径进行(Scheme 3B)。基于上述的研究,作者提出了一种合理的催化循环过程(Scheme 3C)。在蓝光辐射下,叠氮化物13脱去氮气生成氮烯14,氮烯14插入C1-C2芳烃π-键中,生成具有张力的2H-氮杂丙烯啶15。15经热6π-电环化开环生成亲电的酮亚胺16,16可与胺亲核试剂反应生成1H-䓬17,17经互变异构化后生成3H-䓬18。随后,18与氧气进行[4+2]环加成反应生成内过氧化物(endoperoxide)19,19经开环生成过氧化物取代的䓬20。20经6π-电环化生成环丙基稠合二氢吡啶21。21中的环丙烷开环以及氢氧根的离去,生成Wheland中间体22。22在甲醇介导的去甲酰化作用下,从而生成2-氨基吡啶23和甲酸甲酯10。
(图片来源:J. Am. Chem. Soc.)
总结
美国斯坦福大学Noah Z. Burns课题组报道了一种温和且简单的一锅法将芳基叠氮化物转化为氨基吡啶的策略。这种破坏性转化(disruptive transformation)可用于药用相关化合物的合成和衍生化。虽然上述策略具有一定的局限性,但预计该策略会可促进分子编辑的发展。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn