

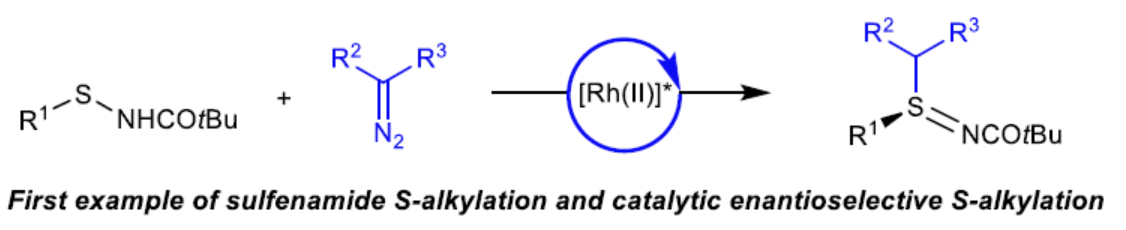
(图片来源:J. Am. Chem. Soc.)
亚砜亚胺类化合物是一种砜的单氮杂类化合物,作为药物化学中的特殊功能化基团,受到了广泛地关注。同时,用氮替换砜氧之一有利于水溶性和代谢稳定性。亚磺酰的氮既可以不被取代而成为氢键供体,也可以引入不同的官能团来探索额外的化学空间。目前,亚砜亚胺单元广泛存在于各类药物分子中(Scheme 1A)。其中,亚砜亚胺类药物已成为药物化学中的药效团,但其立体控制合成则具有挑战。虽然化学家们已开发出多种优雅的手性反应试剂(chiral reagent-based)和动力学拆分方法,但通过催化对映选择性引入硫立体中心是获得对映体富集亚砜亚胺类化合物最为有效的方法。现有的催化对映选择性方法主要集中于硫醚的对映选择性氧化或胺化反应,可分别获得对映体富集的亚砜或硫亚胺(sulfilimine)中间体(Scheme 1B)。随后,通过立体专一性胺化或氧化反应,可获得对映体富集的亚砜亚胺类化合物。值得注意的是,此类反应常需对两个硫醚碳取代基进行空间或电子区分,从而实现高对映选择性。近日,耶鲁大学Jonathan A. Ellman课题组报道了一种全新铑催化次磺酰胺与重氮化合物的不对称S-烷基化反应以及氧化反应,合成了一系列对映体富集的亚砜亚胺衍生物(Scheme 1C)。据文献查阅,目前仅有次磺酰胺的氮烷基化反应的相关研究,对于次磺酰胺的硫烷基化反应尚未被报道。
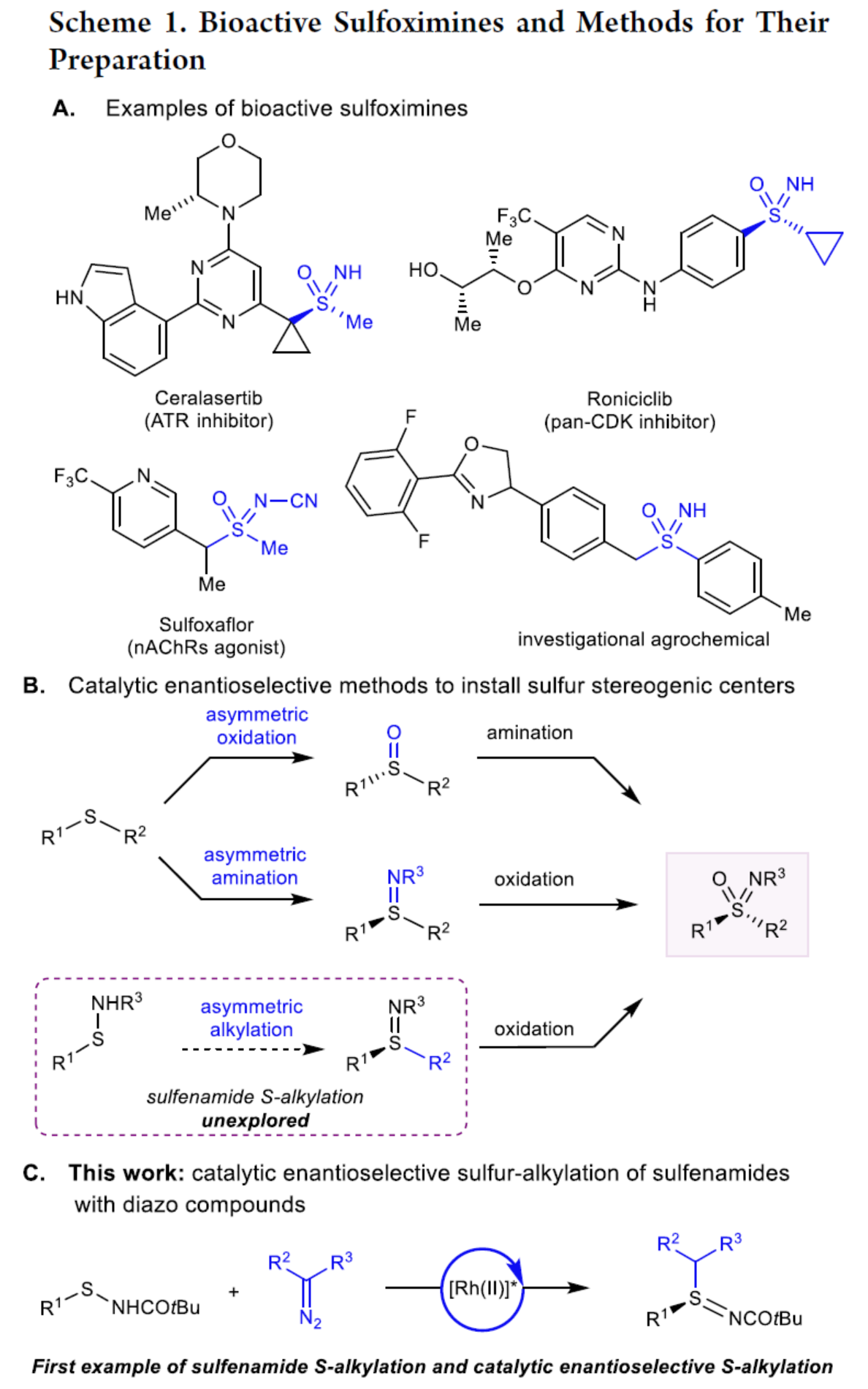
(图片来源:J. Am. Chem. Soc.)
首先,作者对外消旋S-烷基化的底物范围进行了扩展(Table 1)。对于含有两个吸电子基的对称取代重氮化合物,均可顺利进行反应,获得相应的产物3a-3d,收率为73-80%。对于非对称取代的重氮化合物,如含有砜基、酰胺基、膦酸酯基和腈基,均与体系兼容,获得相应的产物3e-3h,收率为85-99%。重氮芴或重氮喹啉酮,也是合适的底物,获得相应的产物3i-3j,收率为82-96%。含有单个吸电子基且具有简单氢、烷基或芳基官能团的重氮化合物,也可顺利进行反应,获得相应的产物3l-3n,收率为78-96%。
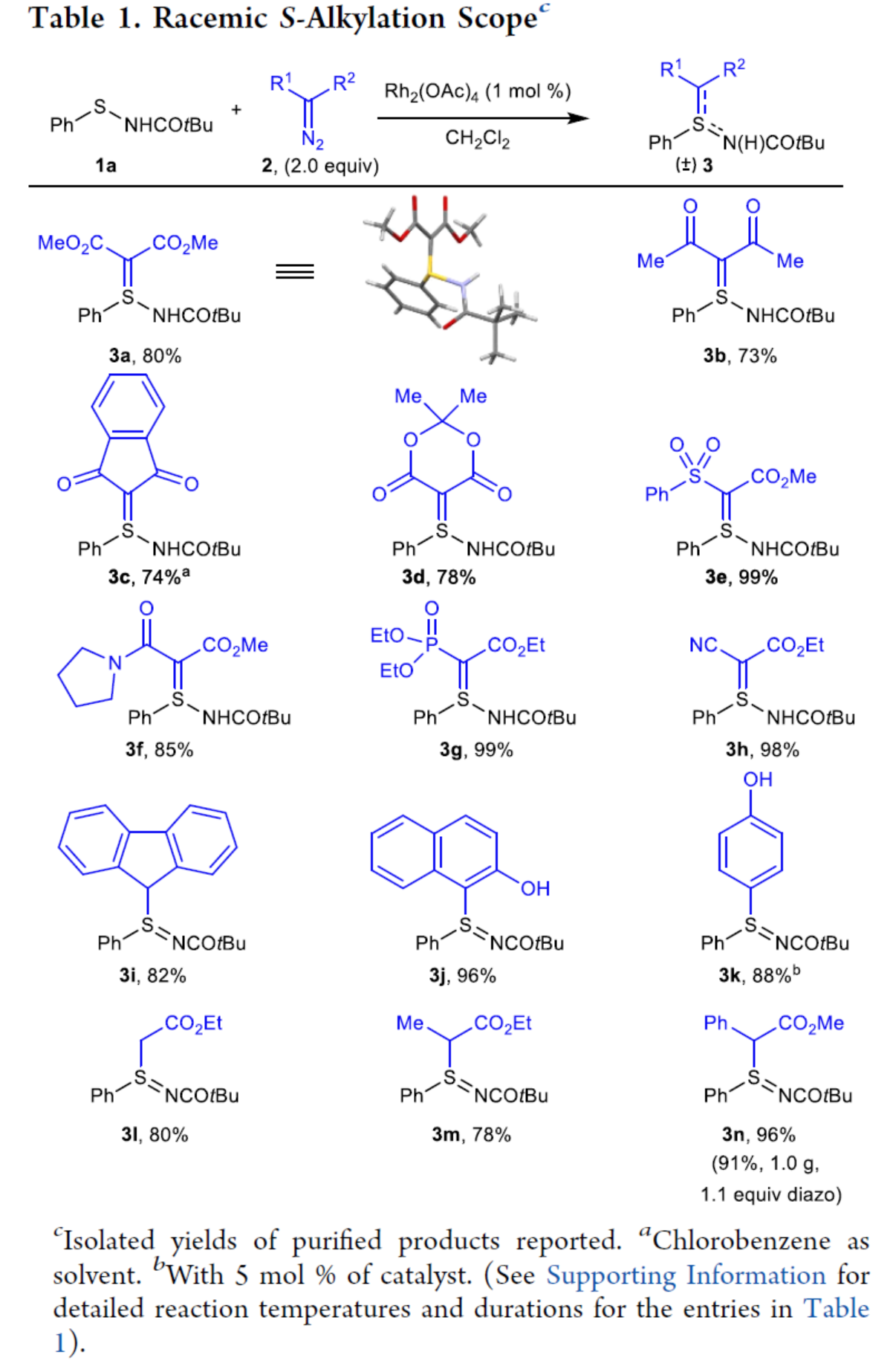
(图片来源:J. Am. Chem. Soc.)
同时,作者还对不对称S-烷基化反应的条件进行了筛选(Table 2)。当以1a和2n作为底物,Rh2(R-p-Ph-TPCP)4作为手性催化剂,在DCE溶剂中室温反应1 h,可以97%收率和97:3 er得到手性产物3n。
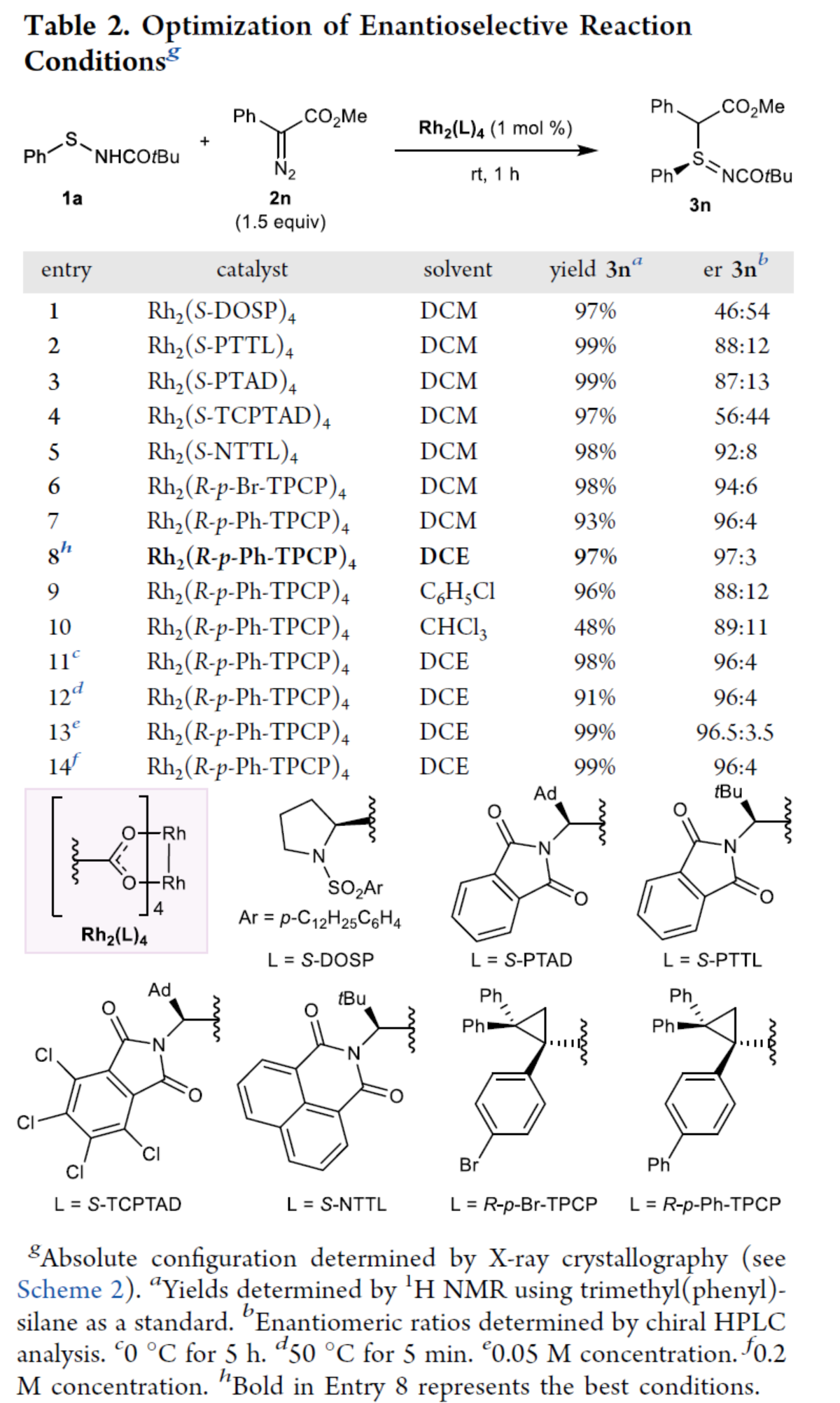
(图片来源:J. Am. Chem. Soc.)
紧接着,作者对反应的机理进行了研究(Scheme 2)。首先,由于硫亚胺3n中α-氢的酸性,在碳立体中心发生快速异构化,导致形成平衡异构体的混合物(Scheme 2A)。其次,作者提出了一种合理的催化循环过程(Scheme 2B)。2n与催化剂(Rh2L4)反应并释放氮气,生成了铑卡宾中间体II。次磺酰胺1a进攻II生成了硫立体中心,并释放催化剂和叶立德III(互变异构为亚砜亚胺3n),完成催化循环。
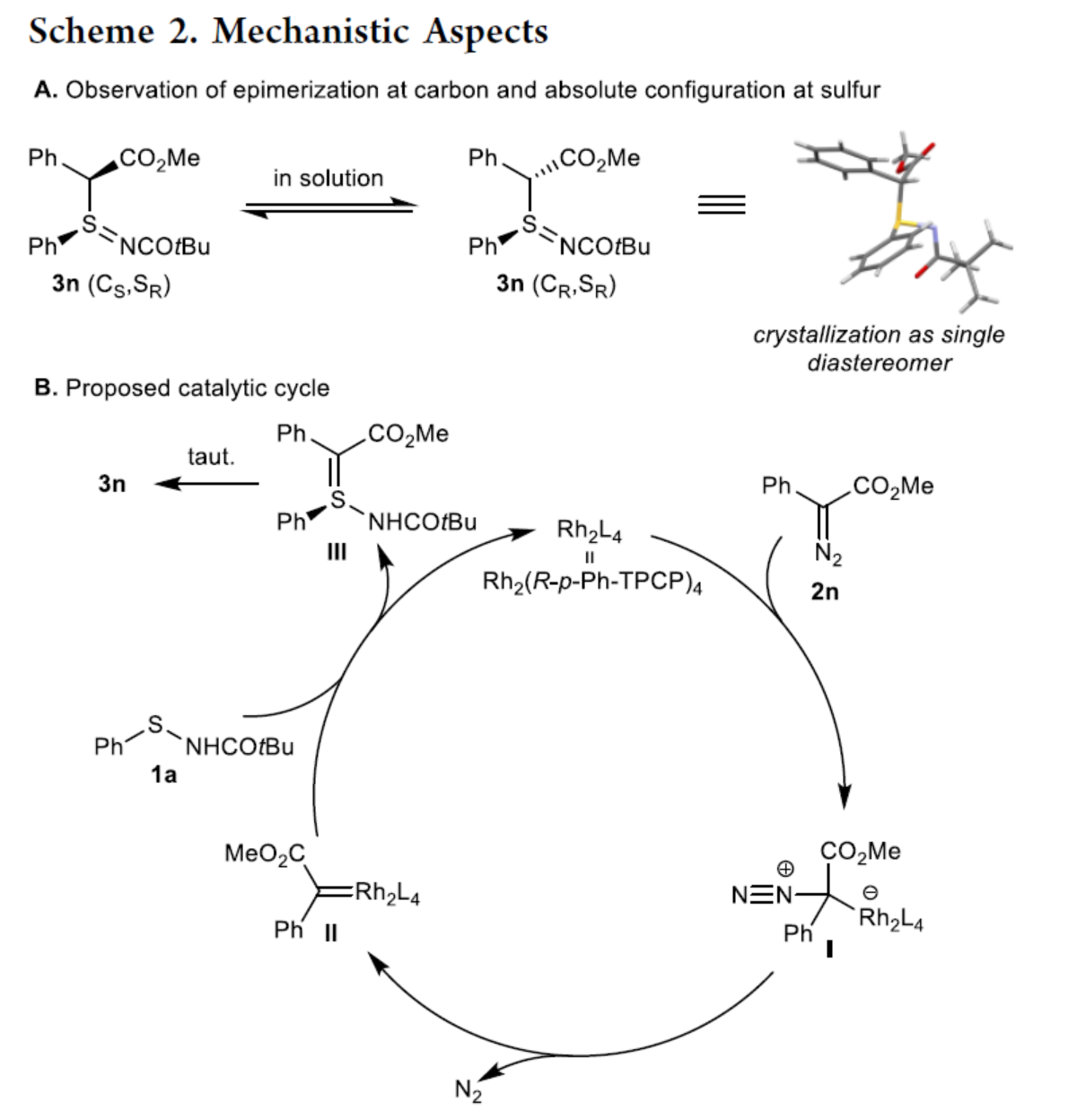
(图片来源:J. Am. Chem. Soc.)
随后,作者对不对称S-烷基化的底物范围进行了扩展(Table 3)。首先,当底物1的R1为一系列不同电性取代的芳基、萘基、杂芳基以及环烷基时,均可顺利进行反应,获得相应的产物3n-3ac,收率为66-99%,er为85:15-98:2。值得注意的是,次磺酰胺底物中的α-支链是实现高对映体选择性的必要条件,例如产物3ad仅具有中等的对映选择性。其次,当底物2的R2为一系列具有不同电性取代的芳基、萘基、杂芳基时,均可顺利进行反应,获得相应的产物3ae-3at,收率为93-99%,er为86:14-97:3。当底物2的R3为乙基时,也是合适的底物,获得相应的产物3au,收率为97%,er为93:7。
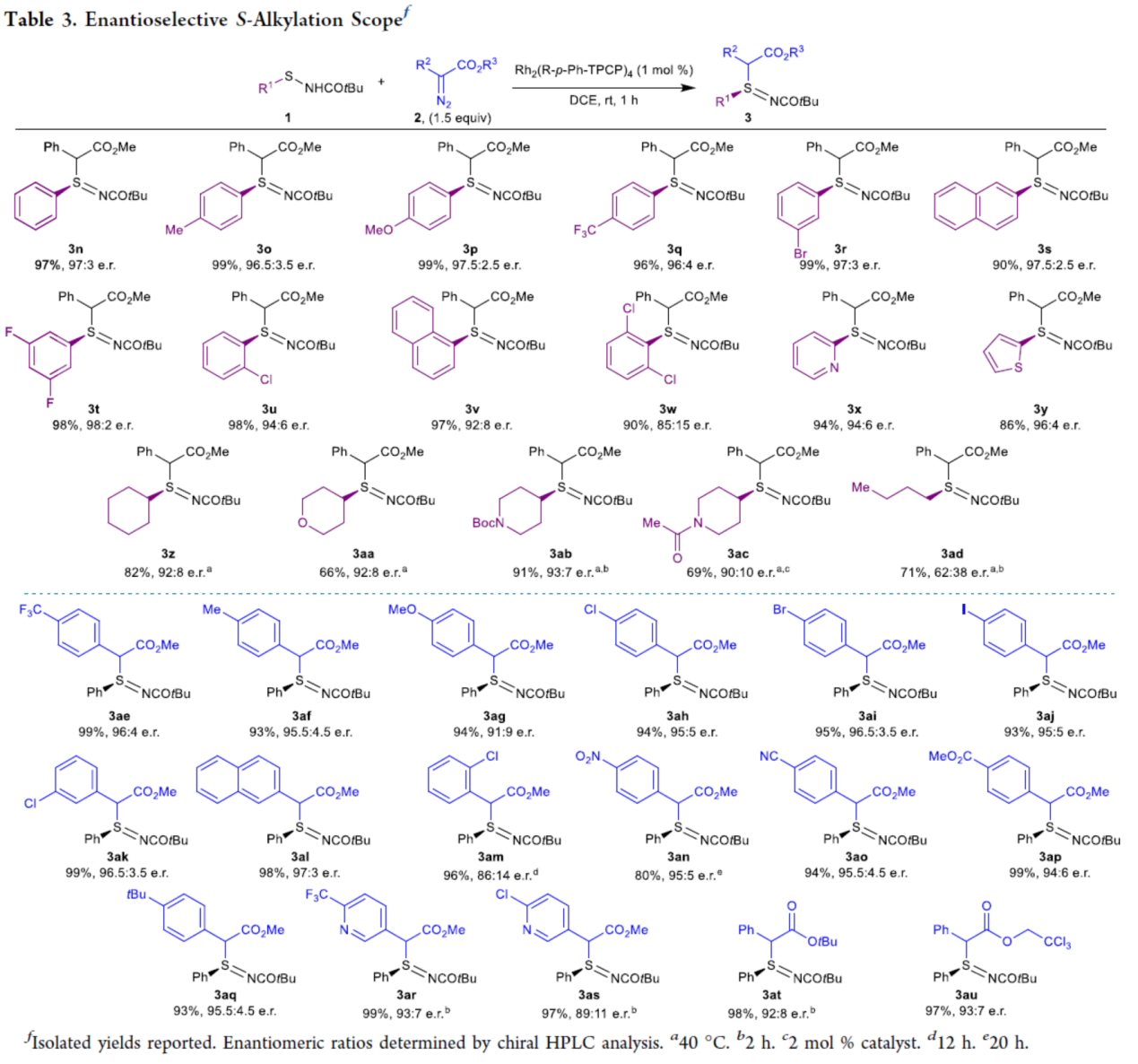
(图片来源:J. Am. Chem. Soc.)
紧接着,作者对反应的实用性进行了研究(Scheme 3)。首先,克级规模实验,可将催化剂的负载量降低至0.1 mol%,同样能够以96%收率和96:4 er得到产物3n。3n可进行立体专一性得氧化反应,可以88%的收率得到亚砜亚胺化合物4,er为96:4。4还可进行多种衍生化实验,例如在NaOH/MeOH或NaHMDS/MeI条件下,可获得一系列亚砜亚胺衍生物5-7,收率为76-99%。此外,该策略还可用于复杂的亚砜亚胺类农药的不对称合成,如13和14,共涉及三步反应。首先,以市售的氨基醇对映体8-(S)和8-(R)为底物,可与2,6-二氟苯甲酰氯进行缩合反应,生成噁唑啉中间体9-(S)和9-(R)。随后,9-(S)和9-(R)经Negishi偶联以及重氮化反应,生成关键重氮酯中间体10-(S)和10-(R)。10-(S)和10-(R)在上述标准条件下进行S-烷基化反应,生成非对映异构亚砜亚胺11和12。最后,11和12经硫氧化和酯脱羧过程,从而获得非对映体13和14。
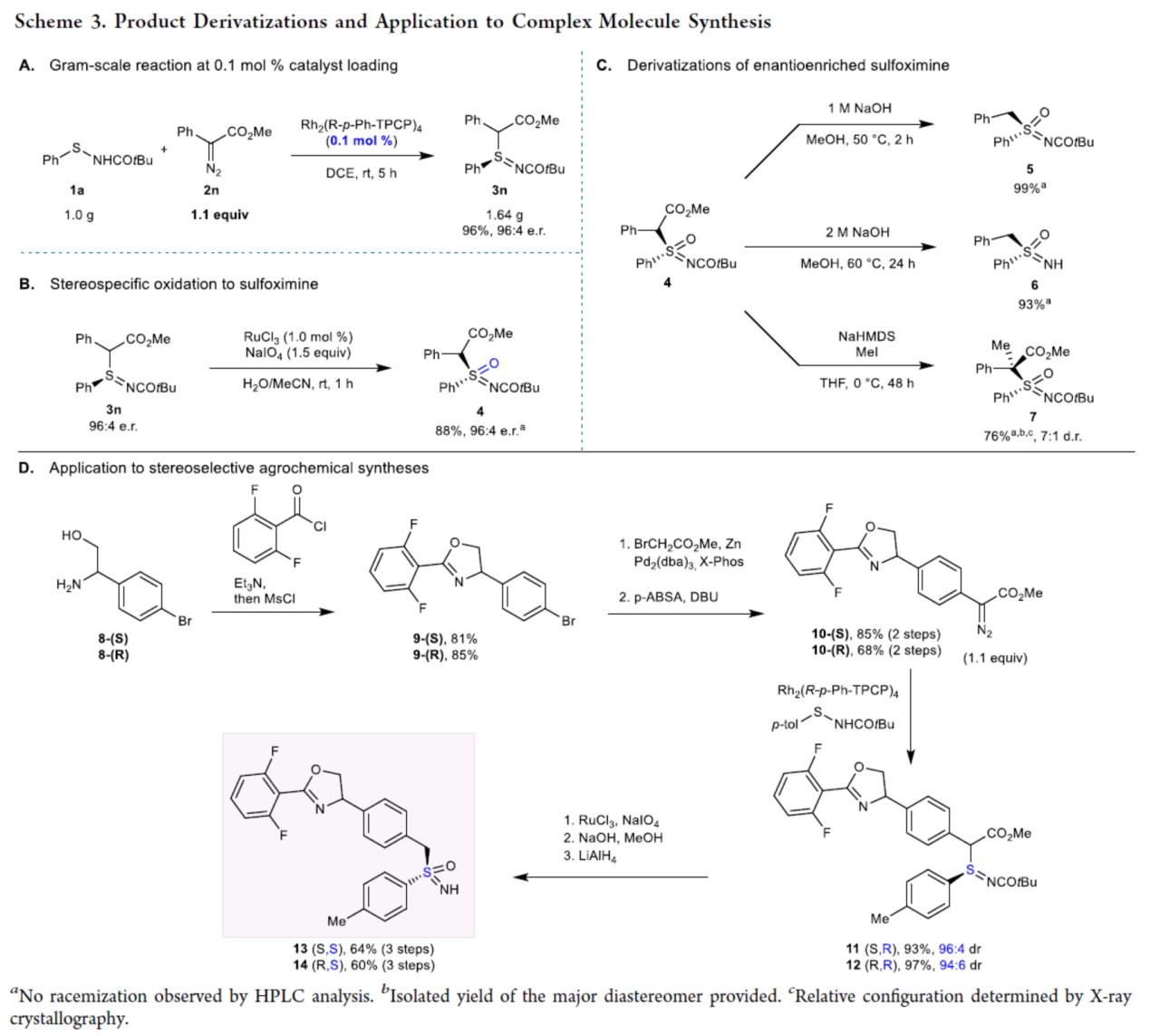
(图片来源:J. Am. Chem. Soc.)
总结
耶鲁大学Jonathan A. Ellman课题组报道了一种全新铑催化次磺酰胺与重氮化合物的不对称S-烷基化反应以及氧化反应,合成了一系列亚砜亚胺衍生物。同时,该策略具有底物范围广泛、官能团兼容性高、反应条件温和、对映选择性出色等特点。此外,通过对复杂的亚砜亚胺类农药的不对称合成,进一步证明了反应的实用性。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn