

(图片来源:Angew. Chem. Int. Ed.)
近年来,C(sp3)-H官能团化的研究在有机合成领域经历了惊人的发展。这些转化的一个关键优势在于它们的高原子经济性,这源于省略了预官能化步骤以形成新的C-C或C-X(X = N、O或卤素)键。它们在串联过程中的整合对于构建复杂分子具有很高的合成价值。尽管涉及氢原子转移或卡宾/氮宾插入串联反应的发展取得了长足的进步,但在内部氧化还原过程中通过氢提取的功能化却发展相对缓慢。
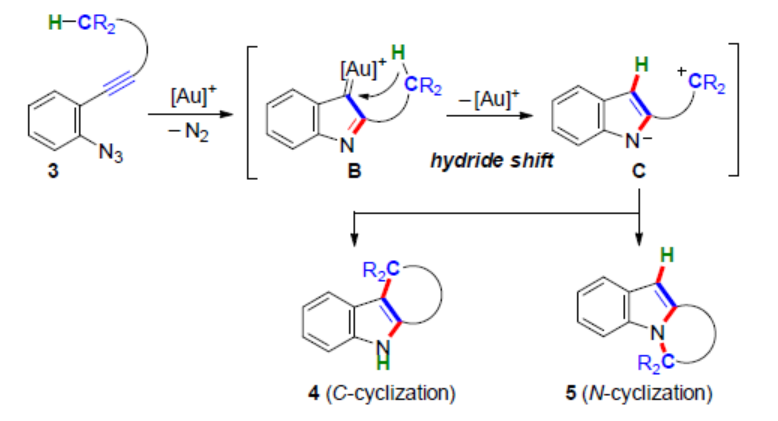
目前,涉及金催化C(sp3)-H官能团化的串联反应备受关注。由于金的高π-酸性具有非凡的选择性,可用于不同亲核加成反应中炔烃的活化过程,金参与电子反馈(electron back-donation)以稳定阳离子中间体的能力导致其具有双重反应模式。2005年,Toste课题组报道了一种金催化高炔丙基叠氮化物的反应,通过1,2-氢转移合成了一系列取代的吡咯衍生物,涉及形成α-亚氨基金卡宾。随后,化学家们还将这一概念进一步扩展到串联环化反应中,合成了一系列多环吲哚衍生物(Scheme 1A)。然而,涉及1,5-迁移到金卡宾中心的反应,却少有报道。
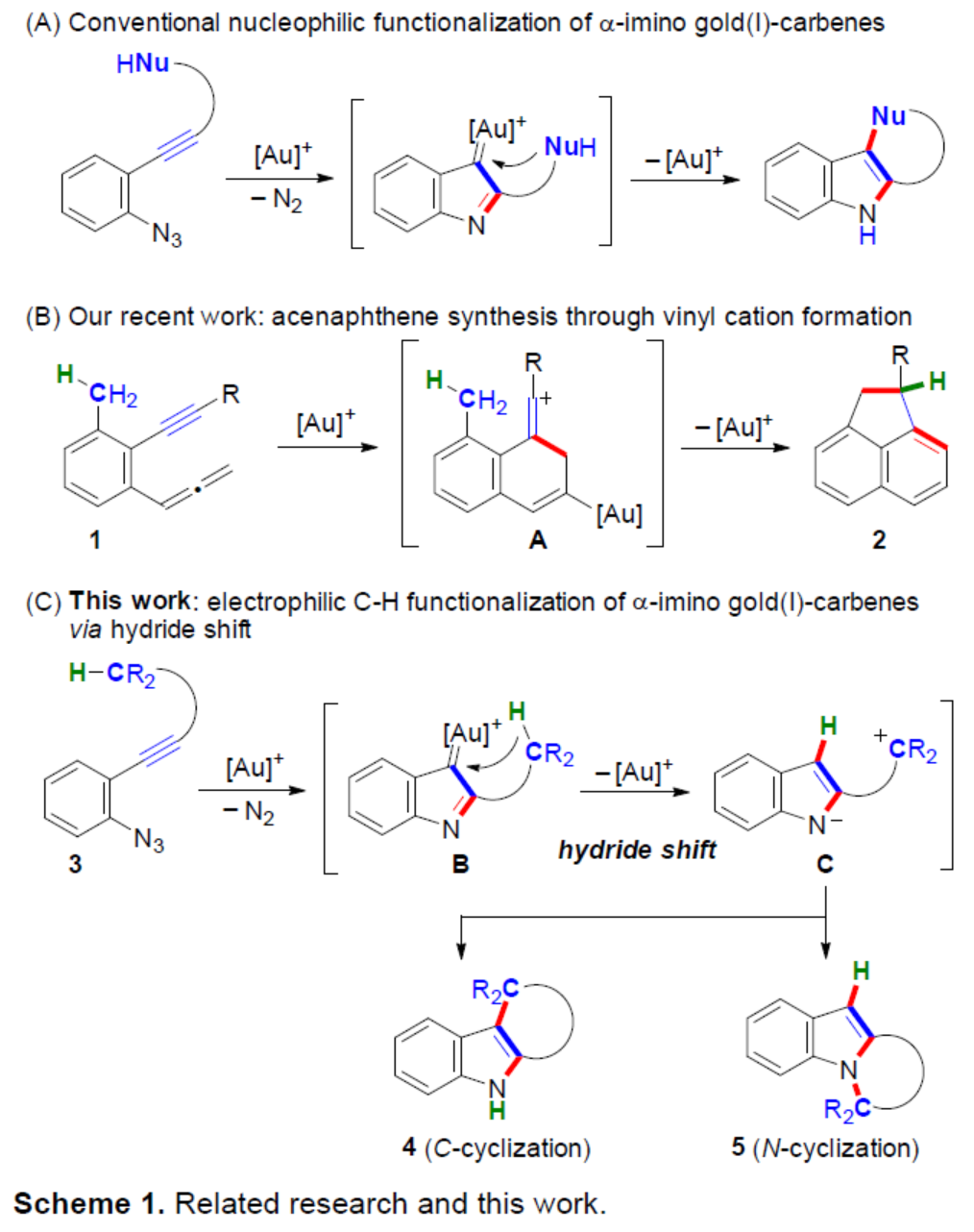
前期(Angew. Chem. Int. Ed. 2019, 58,7792.和Angew. Chem. Int. Ed. 2021, 60, 27019.),Hiroaki Ohno课题组报道了一种金催化联烯基苯乙炔衍生物(allenynes)1合成acenaphthenes 2的方法,涉及形成乙烯基阳离子金配合物A的过程(Scheme 1B)。近日,日本京都大学Hiroaki Ohno课题组报道了一种金催化叠氮炔衍生物的苄基sp3(C-H)官能团化反应,通过发散性N-或C-环化合成了一系列吲哚稠合的四环或五环化合物(Scheme 1C)。
(图片来源:Angew. Chem. Int. Ed.)
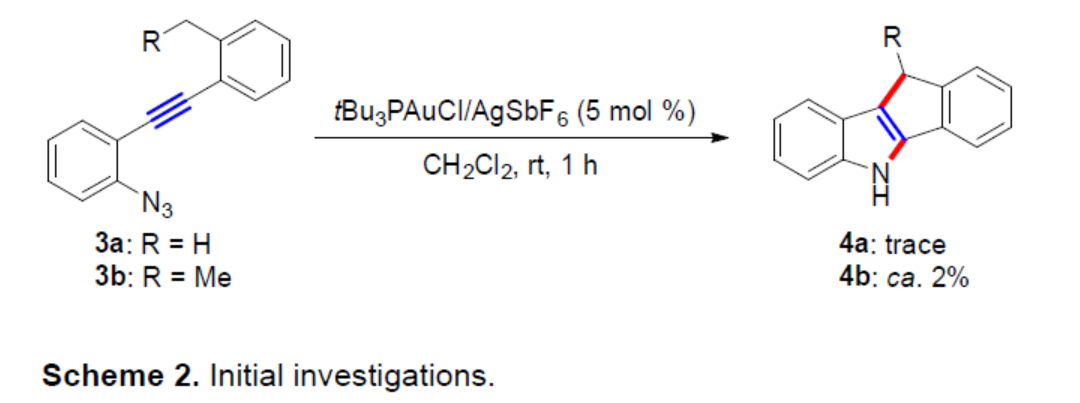
最初,作者选择了tBu3PAuCl/AgSbF6作为催化体系,当以3a作为底物时,仅获得微量的目标产物4a。为了提高氢化物供体的反应性,作者引入一个额外的甲基(3b)用于稳定相应的苄基阳离子,可以2%的收率得到所需产物4b(Scheme 2)。
(图片来源:Angew. Chem. Int. Ed.)
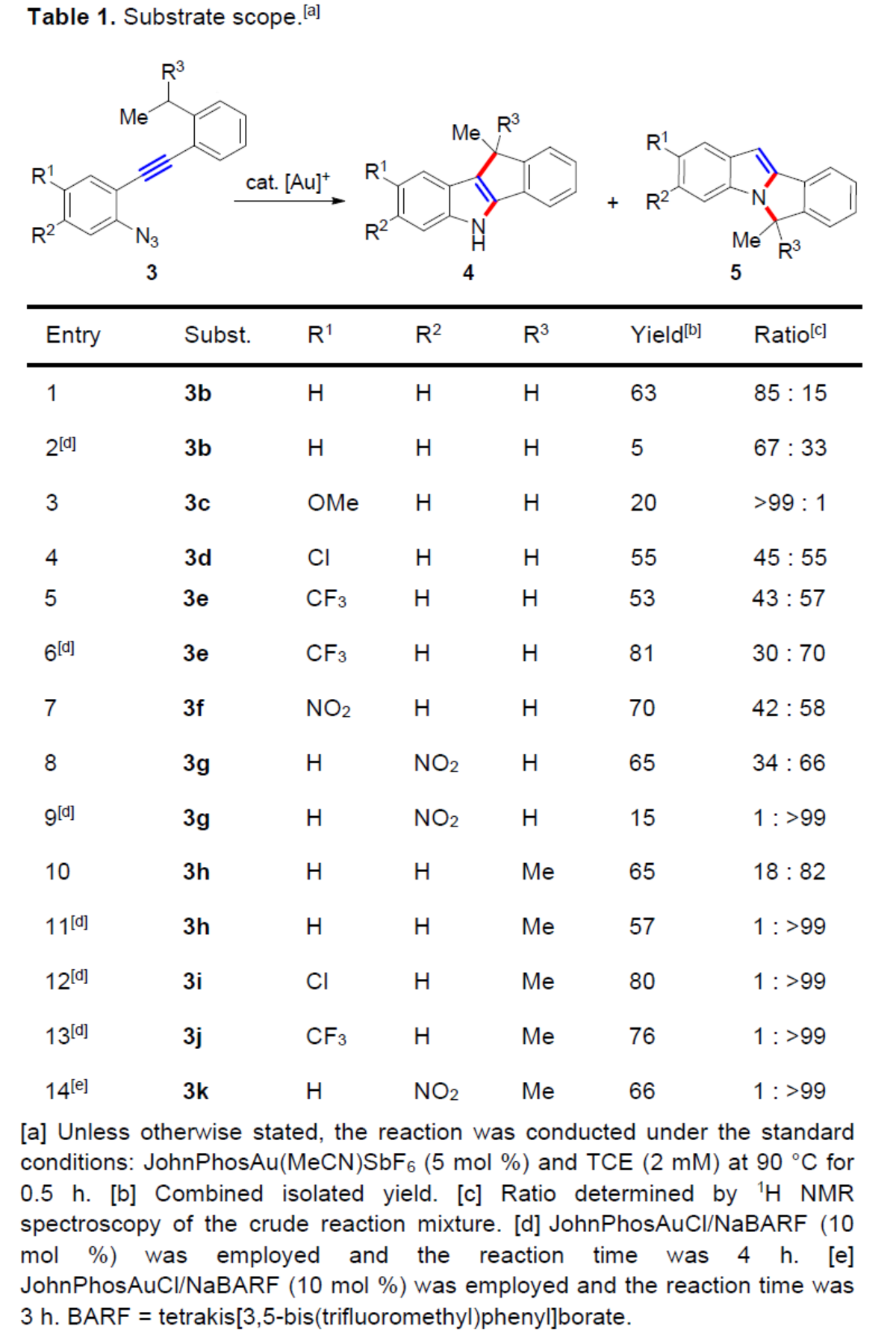
紧接着,作者对底物范围进行了扩展(Table 1)。首先,在JohnPhosAu(MeCN)SbF6催化体系中,底物3b-3h,均可顺利进行C-环化反应,合成了一系列吲哚稠合的四环产物,收率为20-81%,C-环化/N-环化为18:82->99:1。其次,在JohnPhosAuCl/NaBARF催化体系中,底物3b、3e、3g和3h-3k,可选择性进行N-环化反应,收率为5-80%,C-环化/N-环化为67:33-1:>99。此外,芳基单元的吸电子基团、弱配位平衡阴离子和碳阳离子诱导的稳定性,对于选择性N-环化具有一定的影响。
(图片来源:Angew. Chem. Int. Ed.)
(图片来源:Angew. Chem. Int. Ed.)
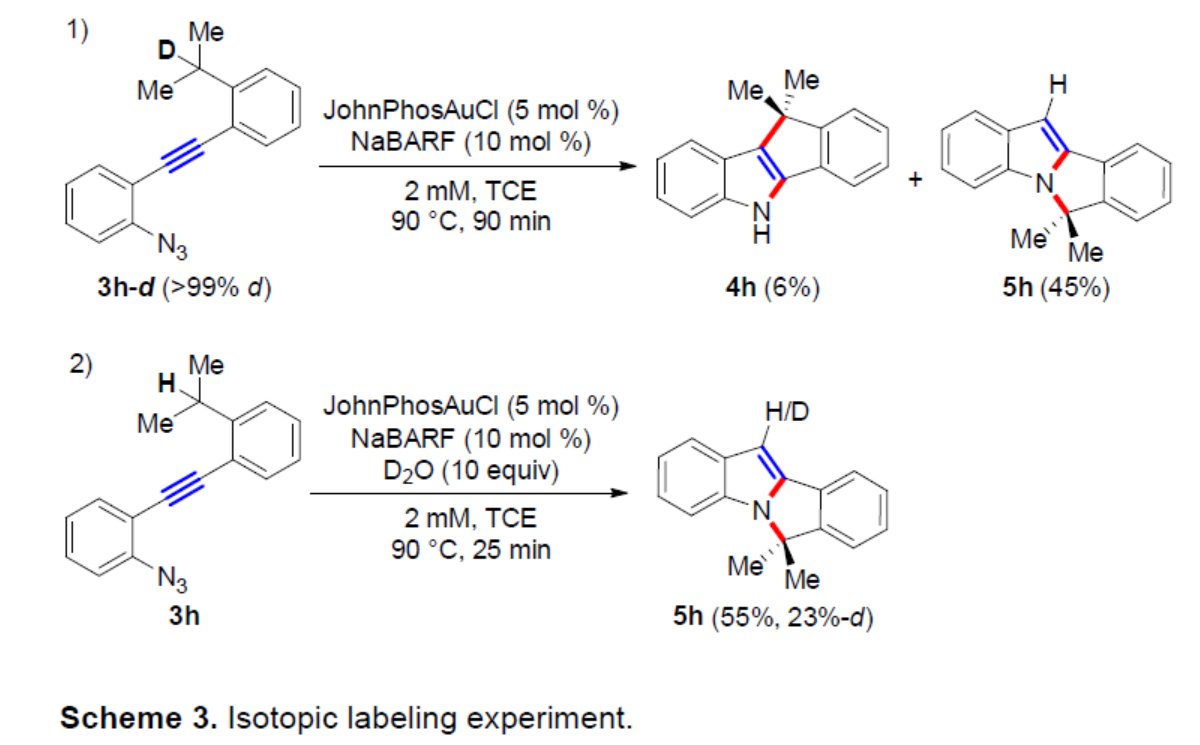
为了进一步了解苄基C(sp3)-H官能团化反应的机理,作者进行了同位素标记实验(Scheme 3)。首先,当以3h-d(>99% d)作为底物,在金催化的串联环化反应中,氘标记的完全消失,获得6%收率的产物4h和45%收率的产物5h,从而表明D/H置换涉及串联反应序列中的基本步骤之一。其次,当使用D2O作为氘源,3h进行反应时,可以55%的收率得到5h-d(23%-d),从而表明在反应混合物中存在D2O、HDO或H2O时,吲哚3-位的H/D可以置换为D/H。
(图片来源:Angew. Chem. Int. Ed.)
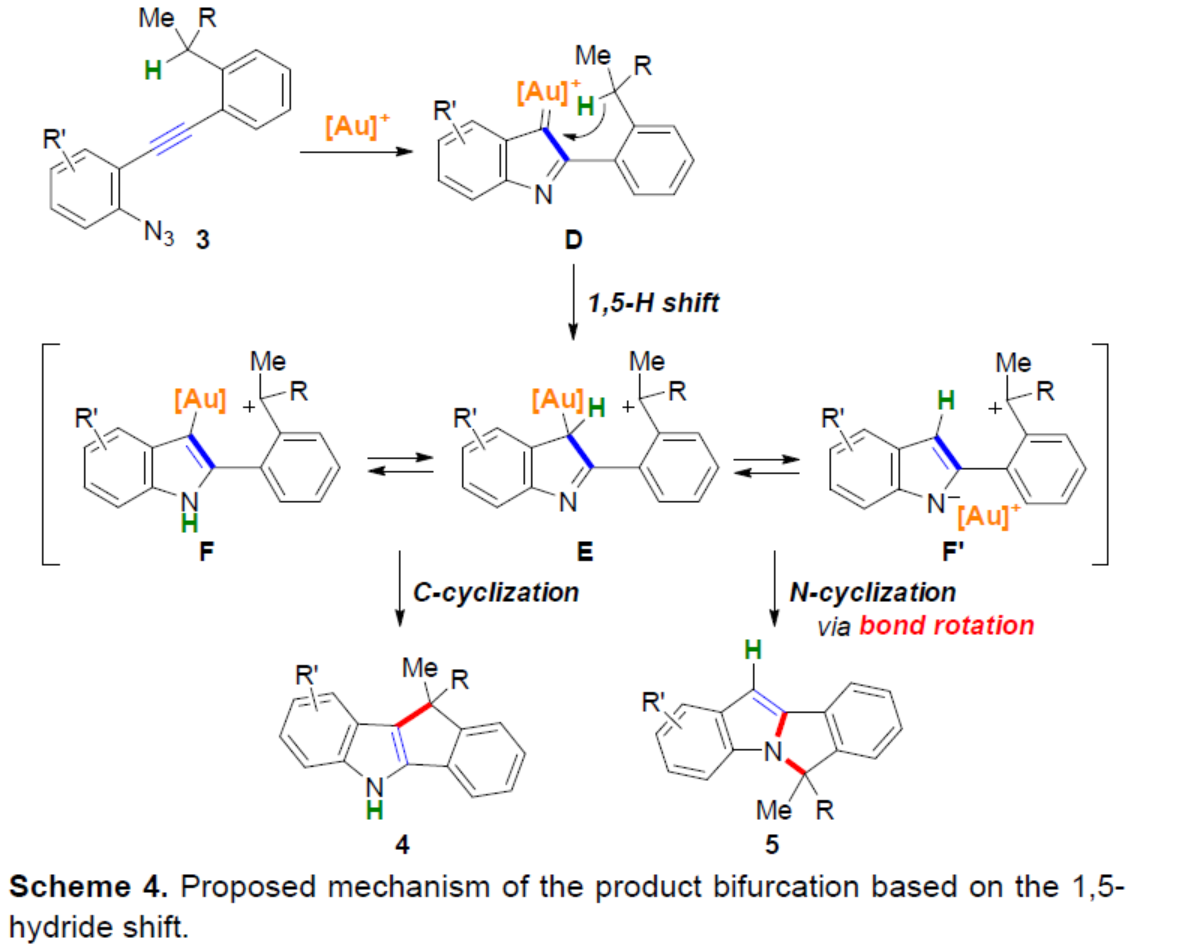
基于上述的研究,作者提出了一种合理的催化循环过程(Scheme 4)。首先,金催化底物中炔基的Schmidt反应,生成α-亚氨基-金卡宾D。随后,D经1,5-氢转移生成相应的碳阳离子中间体E,其处于芳构化中间体F和F’之间的平衡状态。紧接着,通过去金化碳-碳键的形成,可获得C-环化产物4。同时,通过键旋转和C-N键形成,可获得N-环化产物5。
(图片来源:Angew. Chem. Int. Ed.)
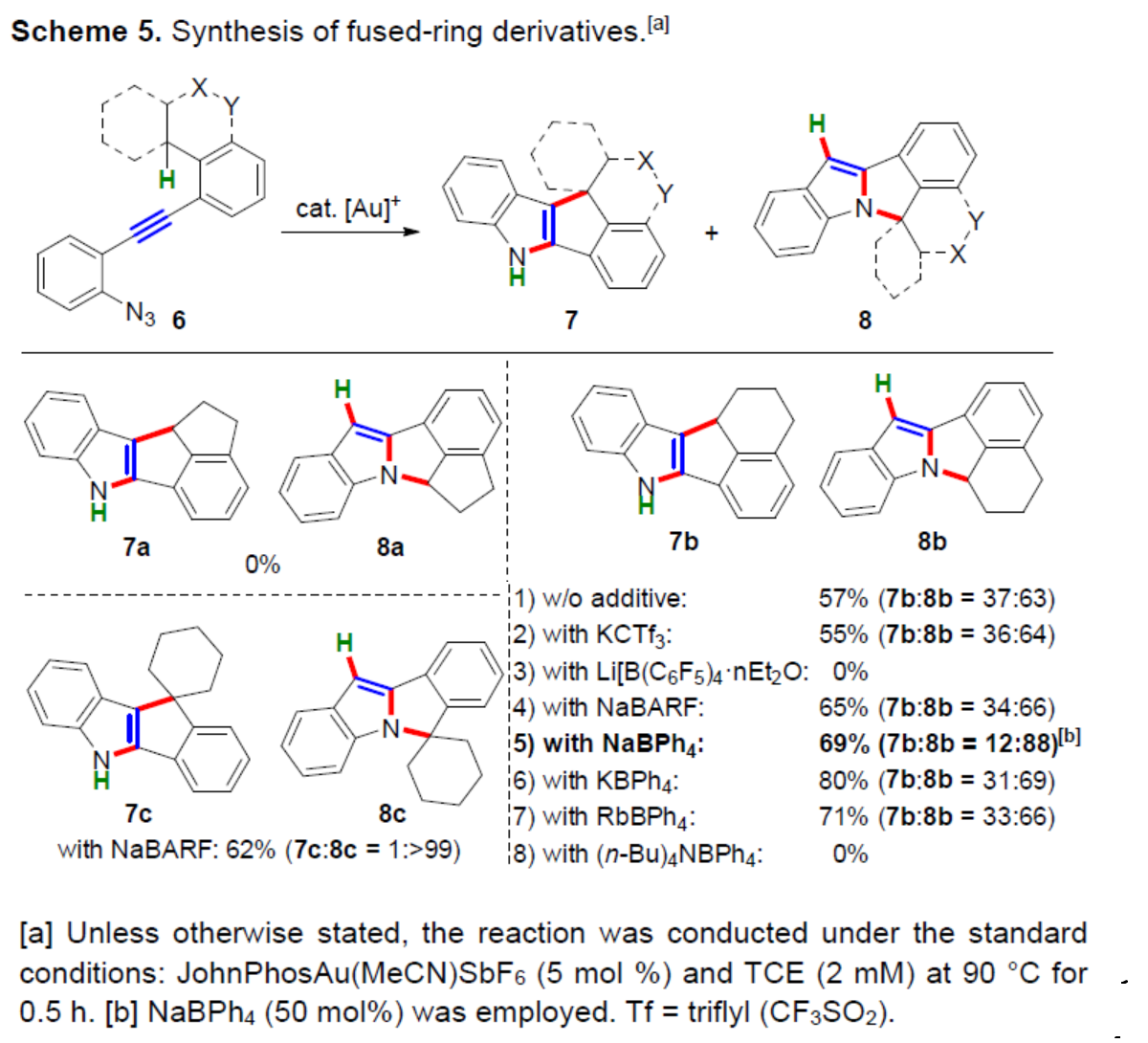
紧接着,作者对碳环底物6的底物范围进行了进一步的扩展(Scheme 5)。当使用茚烷衍生物6a时,聚合是观察到的唯一反应,未检测到所需产物7a和8a。考虑到与7a和8a中五元环稠合的三环茚环的高张力,作者随后考察了四氢萘衍生物6b的反应性。在无添加剂时,可以57%的收率得到吲哚稠合五环产物7b和8b(7b:8b=37:63)。通过对反应条件的简要调查后发现,使用NaBPh4可显著提高了N-环化的选择性(7b:8b=12:88),而添加KCTf3、LiB(C6F5)4、NaBARF、KBPh4、RbBPh4和(nBu)4NBPh4的效果较差。同时,四苯基硼酸盐的分解在这一过程中可能起到重要的作用,但也可能产生平衡阴离子效应,从而影响吲哚骨架的离子特性。当使用NaBARF时,可以62%的收率得到螺稠五环化合物8c。
(图片来源:Angew. Chem. Int. Ed.)
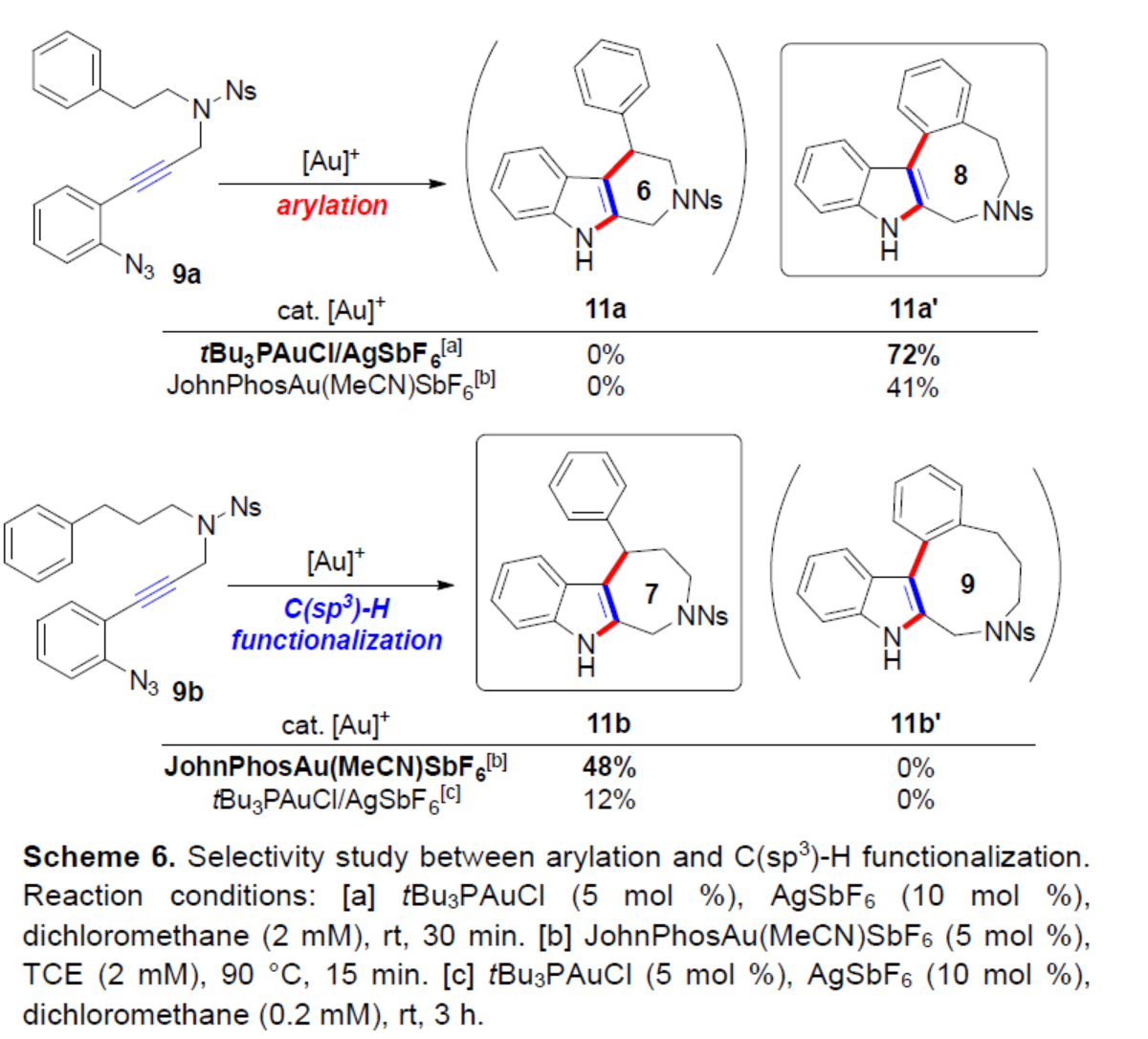
最后,作者对芳基化与C(sp3)-H官能团化的选择性进行了研究(Scheme 6)。当以六元环前体9a为底物,在两种不同的金催化体系中反应,可以41-72%的收率得到八元环芳基化产物11a’,从而表明反应更有利于芳基化,可能是由于七元ipso-环化途径导致。相比之下,当以亚甲基同源物9b作为底物,在JohnPhosAu(MeCN)SbF6催化体系中反应,通过远端苄基的官能团化,可以48%的收率得到七元环吲哚稠合产物11b,而不是九元环芳基化产物11b’。上述结果表明,与通过苄基C(sp3)-H途径进行C-环化反应相比,直接芳基化对高张力产物(如九元环)的影响较小。
(图片来源:Angew. Chem. Int. Ed.)
总结 日本京都大学Hiroaki Ohno课题组报道了一种金催化叠氮炔衍生物的苄基sp3(C-H)官能团化反应,通过发散性N-或C-环化合成了一系列吲哚稠合的四环或五环化合物。其中,该反应需在稀释条件下使用非配位TCE和阳离子JohnPhosAu(MeCN)SbF6。此外,通过对乙基和异丙基底物的研究表明,可以通过C-环化或N-环化形成两种异构体。化学选择性可通过调整叠氮取代的芳基单元的电子密度和苄基碳阳离子的稳定性以及调节平衡阴离子效应来控制。
声明:化学加刊发或者转载此文只是出于传递、分享更多信息之目的,并不意味认同其观点或证实其描述。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。 电话:18676881059,邮箱:gongjian@huaxuejia.cn