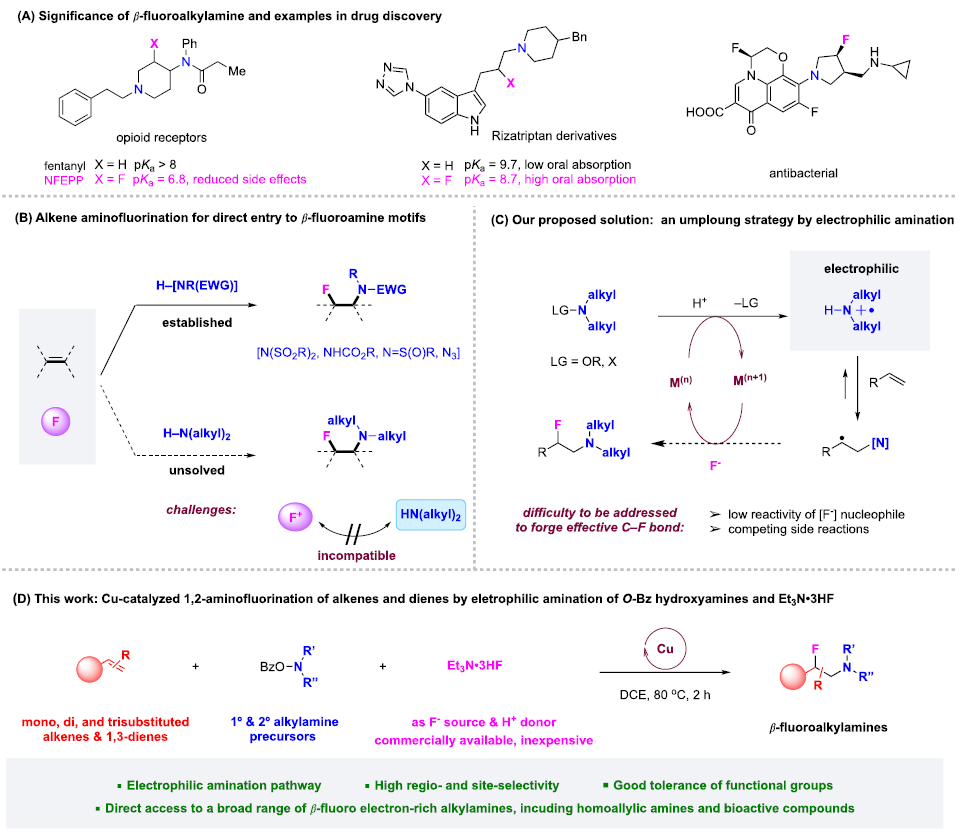
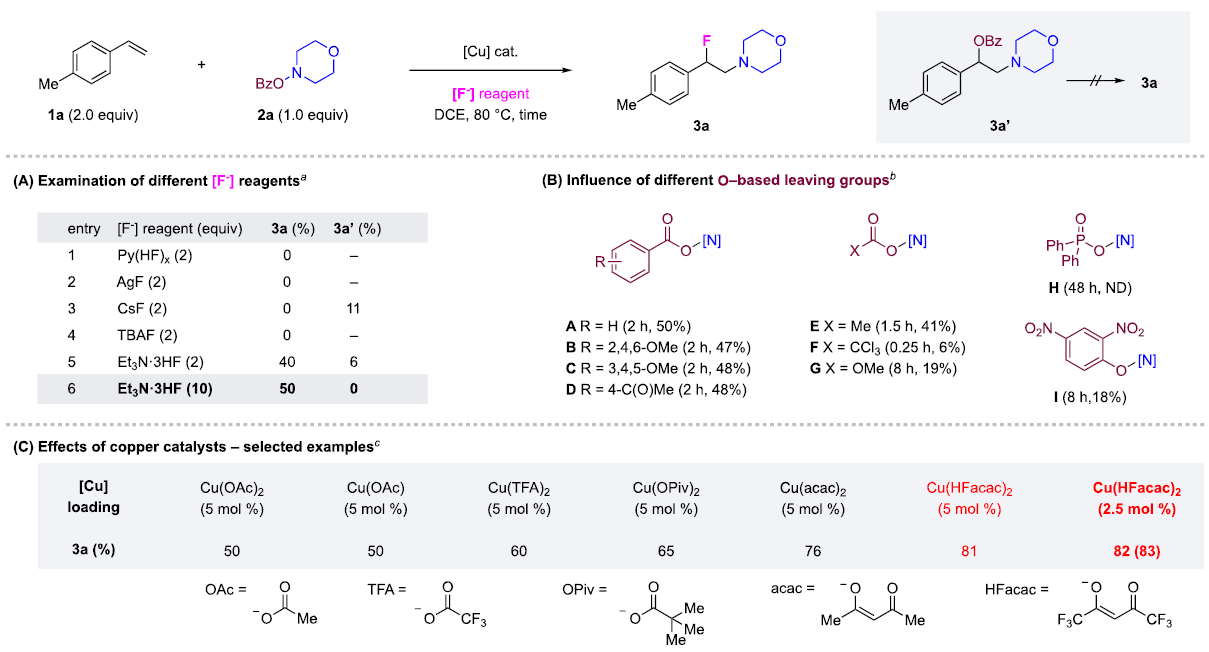
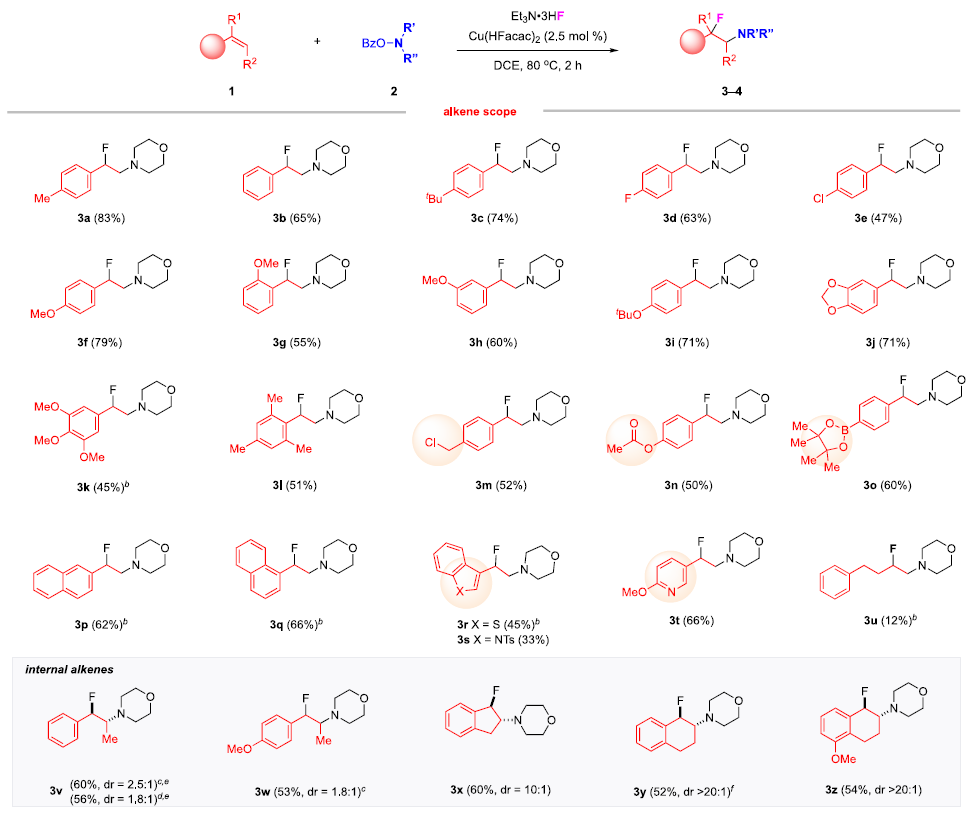
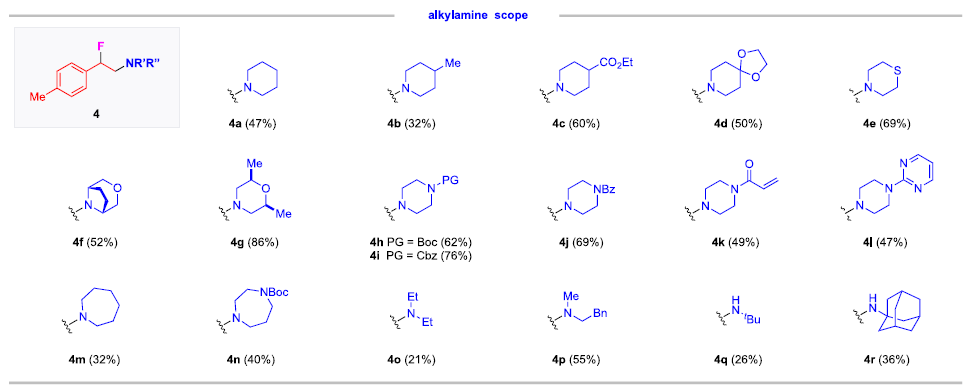
快速、高效地合成具有生物活性的新型含氮化合物在生物医学研究和药物开发中具有极其重要的意义。在含胺化合物中引入氟是药物化学和药物发现的一个有力策略,可以有效地影响其构象、pKa、物理化学性质、生物和药代动力学特性。特别是氨基的β-氟化修饰可以极大地调节邻近氨基的碱度,显著增强生物利用度、亲脂性和生物活性。烯烃的1,2-氨基氟化反应是一种合成β-氟烷基胺的理想策略。近年来,烯烃氨基氟化反应的研究得到了广泛发展,但是底物的范围仅限于特定的缺电子胺,为获得真正有药用价值的分子仍需进行复杂的后续转化。考虑到富电子烷基胺与亲电氟化试剂固有的不相容性,使用传统思路一步合成β-氟烷基胺从根本上存在挑战。作者提出,可以通过使用杂原子取代的烷基胺前体(LG−NR2)对烯烃进行亲电胺化后再与亲核氟源偶联。作者此前利用这一策略实现了铜催化的烯烃氨基氧化反应。Morandi课题组也报道了铁催化氨基氯化反应的例子。虽然该策略代表了烯烃胺化的新方向,但与不同亲核试剂的组合却很有挑战性。一方面是瞬时氮或碳自由基的高反应性极易发生降解等副反应;另一方面,F-在质子溶剂中的亲核性较低,不易参与反应。于是,作者使用现成的N,N-二烷基羟胺作为富电子烷基胺的前体,选用Et3N·3HF作为亲核试剂,它不仅可以作为氟化剂,还可以作为质子源形成氨基自由基。这项工作首次实现了β-氟烷基胺的一步合成,在含β-氟胺药物、天然产物和生物活性化合物的快速合成中具有重要的应用价值。图1. 研究背景(图片来源:J. Am. Chem. Soc.)随后,作者以4-甲基苯乙烯1a和2a作为模型底物进行了条件筛选。首先,作者对氟源进行筛选,并最终确定为Et3N·3HF。在此条件下可以观察到副产物3a',这是由BzO-的亲核加成生成的,同时作者还证实了3a'并不是反应的关键中间体,且当过量的Et3N·3HF(10当量)存在时可以有效抑制3a'的形成。接下来,作者又对离去基团和铜催化剂进行了筛选,最终确定苯甲酸A和2.5 mol %的Cu(Hacac)2效果最好,可以以82%收率得到目标产物。图2. 条件筛选(图片来源:J. Am. Chem. Soc.)作者在上述最佳反应条件下进行了底物拓展。首先,作者用2a测试了烯烃的适用范围,发现各种官能团的耐受性都很好。从吸电子基团(3d-3e)、给电子基团(3f-3k)、位阻大的基团(3l),到一些活泼官能团 (3m-3o) 、苯并噻吩(3r)、吲哚(3s)和吡啶(3t)等其杂环底物也能顺利地生成相应产物。作者还尝试了简单烷基取代烯烃的反应,但只以12%的收率得到3u。不只是末端烯烃,内烯也能生成对应产物(3v−3z)。在无环内烯 (3v−3w)的反应中只观察到中等水平的非对映选择性,而环烯烃(3x−3z)的反应则获得了较高的非对映比(高达20:1)。作者同样测试了烷基胺的适用范围。不同含哌啶的胺化试剂的反应可以得到不同的对应产物。4b(产率32%)和4c-4d(产率50-60%)之间的差距表明,哌啶上的吸电子取代基对反应有促进作用。其它六元环胺底物(4e-4l)也适用于该反应。七元环胺底物产率较低,分别以32%和40%的产率得到了4m和4n。最后,无环羟胺底物(4o和4p)也可以参与反应。该方法甚至适用于仲胺(4q-4r)的直接生成,大大扩展了可获得的β-氟烷基胺的种类。图3. 底物拓展一(图片来源:J. Am. Chem. Soc.)作者还探究了1,3-二烯的氨基氟化反应。这类底物对该反应提出了更高要求。首先,两个碳碳双键的存在导致反应可以发生在两个不同位置;第二,反应既可以发生1,2-加成,也可以发生1,4-加成。因此,1,3-二烯的氨基氟化反应可能产生1,2-加成产物6和6'以及1,4-加成产物7和7'等一系列同分异构体。作者针对该底物再次进行条件筛选发现IPrCuCl(5.0 mol%)是最有效的催化剂。随后作者对1,3-二烯进行了底物拓展。虽然产率普遍较低,但可以很明显发现反应更倾向于得到1,2-加成的产物。图4. 底物拓展二(图片来源:J. Am. Chem. Soc.)最后,作者对该反应的机理进行探究。为了探测反应中是否涉及自由基中间体,在存在BHT作为自由基捕获剂的情况下,使用1a和2a进行对照实验。其中,以54%的收率生成了BHT加成物13a,这表明在标准反应条件下生成了稳定的碳自由基中间体。13b和13c均未检测到,表明不存在长寿命的亲核氮自由基。此外,作者利用14a和14b进行了自由基钟实验。在标准条件下,14a只产生了微量的氨基氟化产物15,而以64%的收率得到了开环产物16,这有力地证明了该反应是通过自由基机理进行的。相比之下,14b的反应没有产生预期的产物17,也没有检测到任何开环副产物。作者认为1,2-双取代烯烃的位阻可能抑制了反应。根据实验结果和相关研究,作者提出了以下反应途径。首先,2在Et3N·3HF和铜催化剂的存在下发生N-O键裂解,生成质子化的氨基自由基阳离子(I)。随后,(I)与碳碳双键发生亲电胺化反应产生(II)。最后, (II)将经过铜介导的氟化得到目标产物。考虑到烯烃亲电胺化反应中C−N键的形成是容易且快速的,C−F键的形成可能是该反应的决速步。图5. 反应机理(图片来源:J. Am. Chem. Soc.)Qiu Wang课题组开发了一种前所未有的铜催化的烯烃氨基氟化反应,直接合成了(杂)芳基、烷基和烯丙基β-氟烷基胺。该方法具有区域选择性高、条件温和、官能团耐受性好等特点。机理实验表明,铜介导的烯烃亲电胺化反应可依次形成以胺和碳为中心的自由基中间体,这些中间体经氟化反应后生成目标产物。该方法的提出在合成和药物化学领域有着重要意义。